Lanifibranor治疗NASH:FDA授予“突破性疗法称号”
2020-10-13 Allan MedSci原创
美国食品和药品监督管理局(FDA)授予该公司的主要候选药物Lanifibranor治疗非酒精性脂肪性肝炎(NASH)的“突破性疗法称号”。
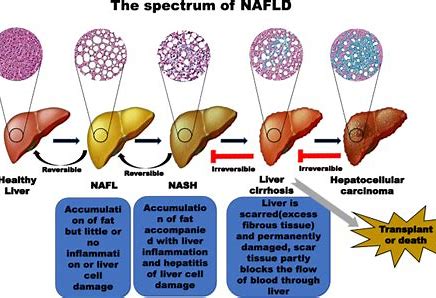
非酒精性脂肪肝病是一类临床-组织病理学疾病,它具有类似酒精性肝损伤的组织学特征,但根据定义其发生于基本没有饮酒史的患者。此类疾病具有一系列组织学表现,轻者表现为不伴炎症或纤维化的肝细胞内脂肪蓄积,重者表现为伴坏死性炎症的肝脂肪变,并且可能伴或不伴纤维化。
生物制药公司Inventiva今天宣布,美国食品和药品监督管理局(FDA)授予该公司的主要候选药物Lanifibranor治疗非酒精性脂肪性肝炎(NASH)的“突破性疗法称号”。自2015年1月以来,Lanifibranor被认为是首个获得该称号的NASH治疗药物。
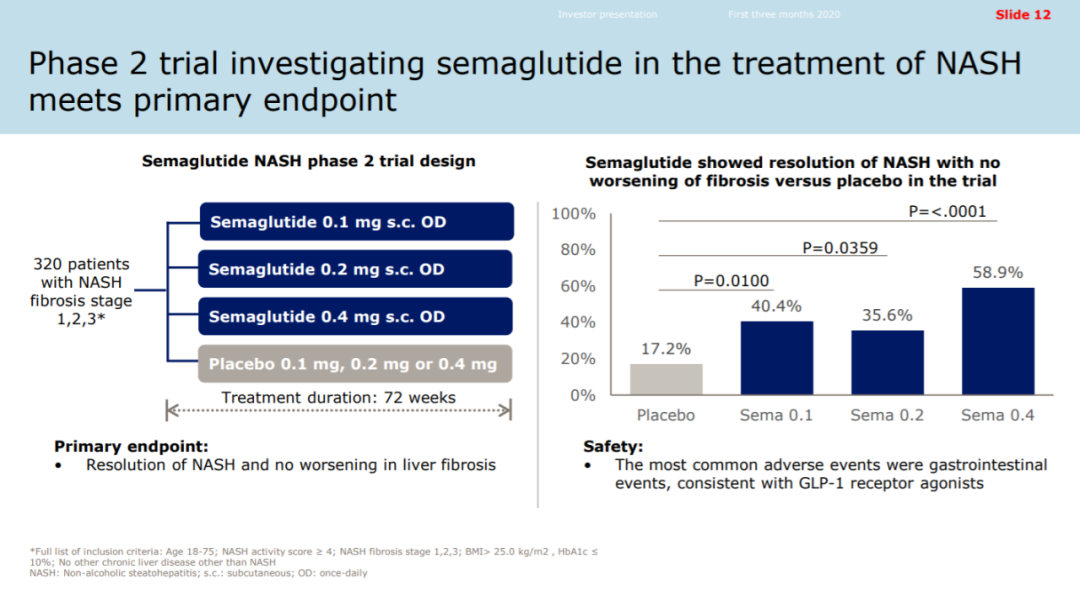
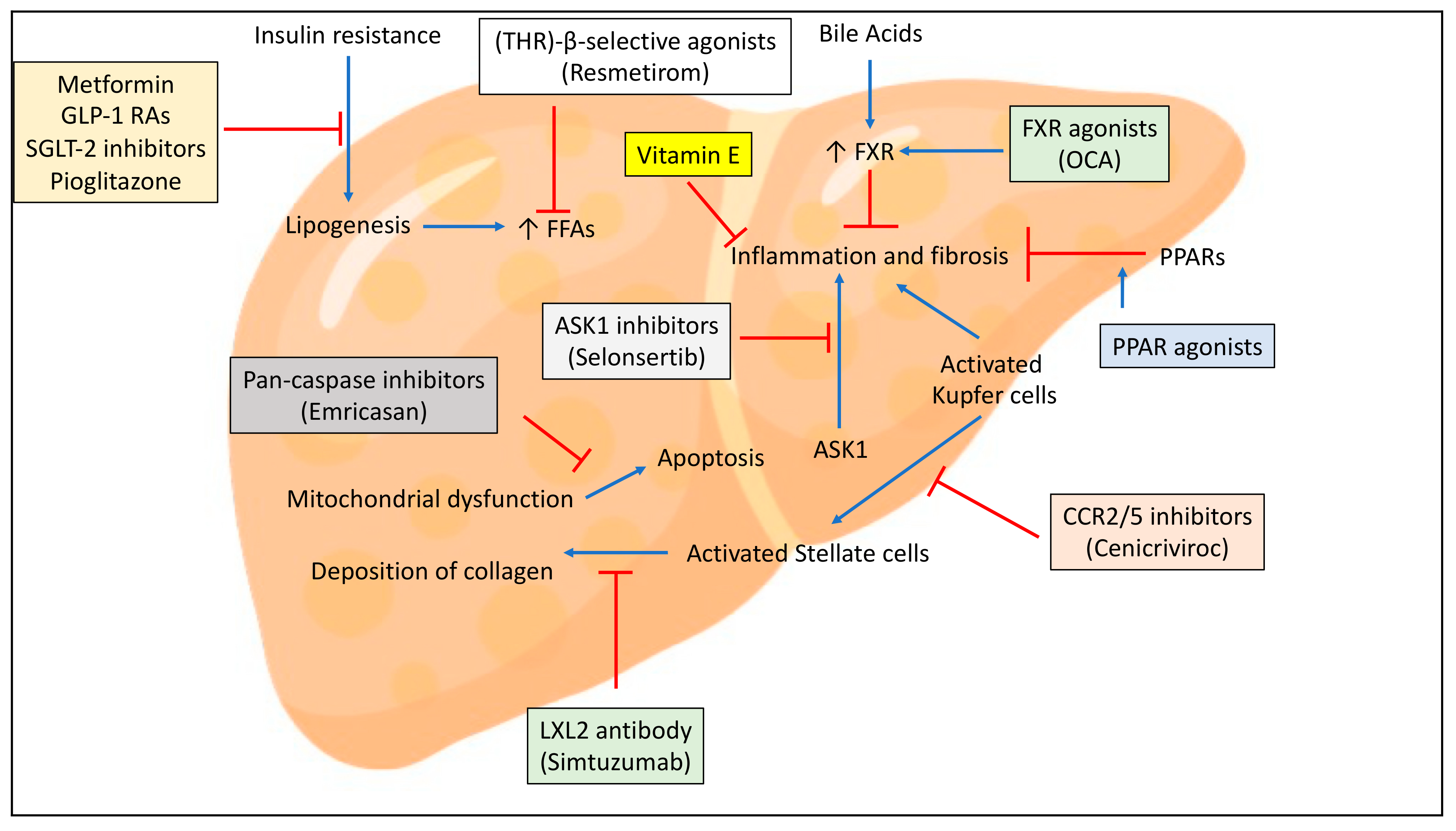
lanifibranor是泛PPAR激动剂,在治疗非酒精性脂肪性肝炎(NASH)的2b期临床试验中达到试验的主要终点和多个关键性次要终点。

FDA的“突破性疗法称号”旨在加快针对严重或危及生命的疾病的候选药物的开发和审查。为了获得这一资格,候选药物必须显示出初步的临床疗效,即显示出比现有疗法或安慰剂(如果没有批准的疗法)的实质性改善。
在2020年6月,IIb期临床试验是一项为期24周的临床研究,结果显示,lanifibranor达到了主要终点,显著降低了Steatosis Activity Fibrosis评分(SAF)。此外,lanifibranor也达到了关键的次要终点,包括NASH消退、纤维化无恶化和肝纤维化改善。
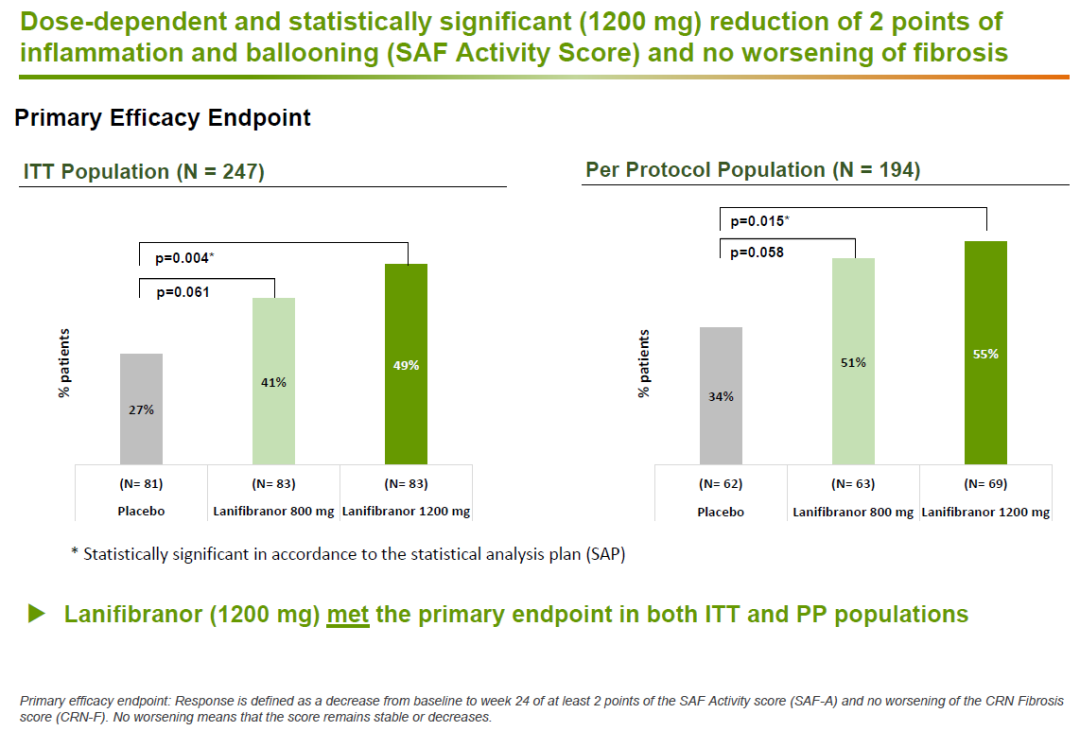
NATIVE是一项随机双盲,含安慰剂对照的2b期临床试验,NASH确诊患者接受了两种不同剂量的lanifibranor或安慰剂的治疗。试验结果表明,在这项为期24周的临床试验中,lanifibranor达到试验的主要终点。在接受剂量为1200 mg/day的lanifibranor治疗的意向治疗(ITT)患者群中,评估肝细胞炎症和肝细胞气球样变(hepatocellular ballooning)的SAF评分与基线相比,显著降低(同时肝纤维化程度没有恶化)。Lanifibranor治疗组(1200 mg/day)的患者中49%达到这一终点,安慰剂组的数值为27%(p=0.004)。
同时,lanifibranor还达到多个关键性次要终点,包括在1200 mg/day剂量组中达到改善纤维化至少一级的同时保持NASH症状不恶化。
Inventiva公司表示,基于公布的顶线结果,该公司已决定将这一临床研究项目推进到关键性3期临床阶段。该公司将与FDA和EMA进行讨论,确定相关临床试验的设计。Inventiva同时计划在今年11月的医学会议上汇报这一临床试验结果。
不过,去年Lanifibranor在一个叫做FASST的全身性硬化病二期临床(IIb)失败。这个实验招募145位弥漫性皮肤全身性硬化病("dcSSc")患者,比较一日两次400、600毫克两个剂量Lanifibranor、安慰剂对一个叫做mRSS皮肤指数的改善。结果在标准疗法背景上用药48周三组患者无差异,该试验也错过所有二级终点。
原始出处:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













签到学习
47
#突破性疗法称号#
66
#ASH#
72
#突破性疗法#
79
#非酒精性脂肪肝#这是世界级难题,与#老年性痴呆#一起被称为新药研发的黑洞,这次#lanifibranor#二期成功了,但只是牛刀小试,到3期临床试验,未必能成功,仍然有相当高的风险。看数据,到1200mg才有效,这个剂量很吓人,即使在这个剂量下,3期仍然面临很大的风险。
245