多中心研究:对奥希替尼获得性耐药的T790M突变NSCLC更有效
2023-10-23 苏州绘真医学 苏州绘真医学 发表于上海
该研究表明,基于抗血管生成的治疗可能改善对奥希替尼获得性耐药的EGFR突变NSCLC患者的PFS和OS。此外,基于安罗替尼的治疗可能是此类患者的一种有前景的有效治疗方法。
本项多中心研究回顾性收集了中国科学技术大学附属第一医院和上海市胸科医院的268例EGFR T790M突变的奥希替尼耐药非小细胞肺癌(NSCLC)患者,并探讨了安罗替尼在患者和体外的疗效。结果显示,抗血管生成治疗组的PFS显著长于免疫治疗组(HR:0.71,p=0.050)和化疗组(HR:0.28,p=0.001)。抗血管生成组的ORR和DCR均高于免疫治疗组和化疗组。亚组分析显示,在PFS(HR:0.63,p=0.087)和OS(HR:0.52,p=0.063)方面,基于安罗替尼的治疗比基于贝伐珠单抗的治疗有更多获益的趋势。体外试验证实,安罗替尼单药或与奥希替尼联合,对奥希替尼获得性耐药的T790M突变H1975细胞系具有有效的细胞毒性。该研究表明,基于抗血管生成的治疗可能改善对奥希替尼获得性耐药的EGFR突变NSCLC患者的PFS和OS。此外,基于安罗替尼的治疗可能是此类患者的一种有前景的有效治疗方法。

研究背景
在亚洲NSCLC患者中,约45.1%的患者携带EGFR突变。EGFR TKI治疗已成为EGFR突变NSCLC患者的标准治疗方案。然而,获得性耐药是奥希替尼治疗肺癌的瓶颈。由于患者基因和临床背景的复杂性,耐药机制谱大多是异质的且尚未完全明确,包括EGFR依赖性机制(如C797S突变)和 EGFR非依赖性机制(如MET扩增)。目前正在研究的两种主要治疗策略是替代TKIs或EGFR TKIs联合其他药物。此外,免疫疗法或与化疗和抗血管生成疗法相联合的益处和安全性也在研究中。总体而言,针对奥希替尼耐药的多种治疗策略仍在探索中。对奥希替尼获得性耐药的NSCLC患者的治疗仍无定论。
此外,再次活检在现实世界中也面临着不同方面的局限性,使得医生很难了解患者对奥希替尼耐药的机制。在本中心,大多数对奥希替尼耐药的患者在医师评估的指导下定期接受抗血管生成治疗、免疫治疗、化疗或免疫治疗联合化疗。对于基于抗血管生成的治疗,安罗替尼和贝伐珠单抗是两种常见的选择。然而,最近多项临床试验的结果表明,奥希替尼联合贝伐珠单抗作为一线治疗未能改善EGFR突变非鳞状NSCLC患者的PFS,也未能改善既往接受过EGFR-TKI治疗患者的PFS。安罗替尼是一种口服多靶点TKI,可抑制VEGFR(1-3)、PDGFR α/β、FGFR(1-4)和c-Kit。安罗替尼在体外和体内显示出强大的抗血管生成作用和抗肿瘤作用。根据一项3期随机临床试验(ALTER 0303)的结果,安罗替尼已在中国被批准用于晚期NSCLC的三线或三线以上治疗。此外,ALTER 0303试验的亚组分析表明,安罗替尼单药治疗延长了EGFR突变患者的OS。
因此,需要为更广泛的奥希替尼获得性耐药患者找到标准治疗。在这项研究中,研究者比较了该中心的患者接受常规治疗方案的疗效,并研究了安罗替尼或与奥希替尼联合对EGFR-T790M突变的奥希替尼耐药NSCLC细胞系的潜在抗肿瘤作用。
研究结果
临床特征:
在本项多中心研究中,来自中国科学技术大学附属第一医院和上海市胸科医院的268例患者符合以下纳入标准:(1)携带EGFR 20号外显子T790M继发突变的晚期NSCLC;(2)接受过至少一线化疗和奥希替尼治疗;(3) 奥希替尼耐药后接受抗血管生成治疗、免疫治疗或化疗;(4) 东部肿瘤合作组体能状态 (ECOG PS) 0-1。
患者的临床病理特征见表1。大多数患者是女性(54.5%)和非吸烟者(71.6%)。64名患者(23.9%)出现脑转移。最常见的EGFR突变类型是EGFR L858R/T790M(57.1%)。大多数患者 ( N=145) 接受了基于抗血管生成治疗,包括安罗替尼(N=103)和贝伐珠单抗(N=42)。47名患者接受了抗PD-1或抗PD-1联合化疗治疗。76名患者仅接受化疗治疗。
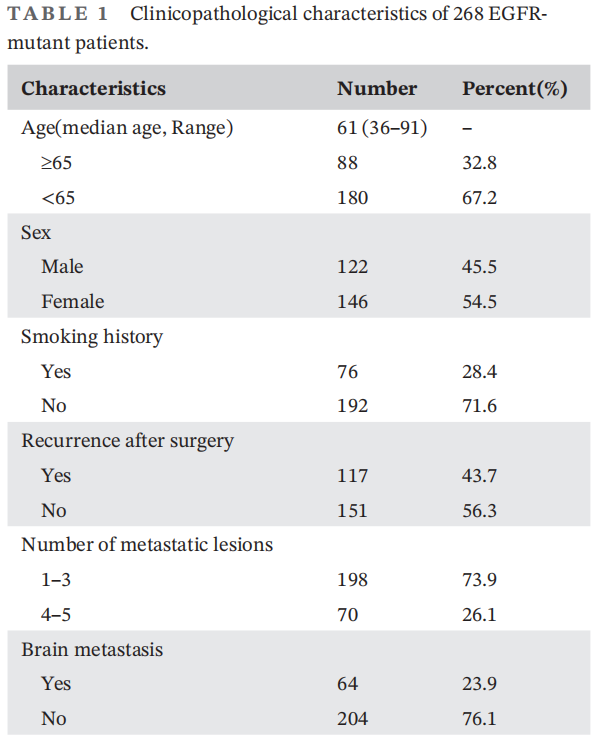

表1
PFS和OS:
268例患者的中位随访时间为9.63个月(范围:0.63-20.17个月),190例(70.1%)患者发生疾病进展(PD)。总中位PFS为4.50个月(95%CI:3.93-5.08)(图1A)。单变量分析结果显示,脑转移(p=0.072)和治疗[p(基于抗血管生成治疗vs.化疗)<0.001,p(免疫治疗vs.化疗)<0.001]与PFS相关(表2)。此外,多变量分析发现,接受基于抗血管生成治疗或免疫治疗的患者比接受化疗的患者有更长的PFS。无脑转移患者的PFS长于有脑转移患者(表2)。这些结果表明,脑转移和治疗是PFS的独立预后因素。
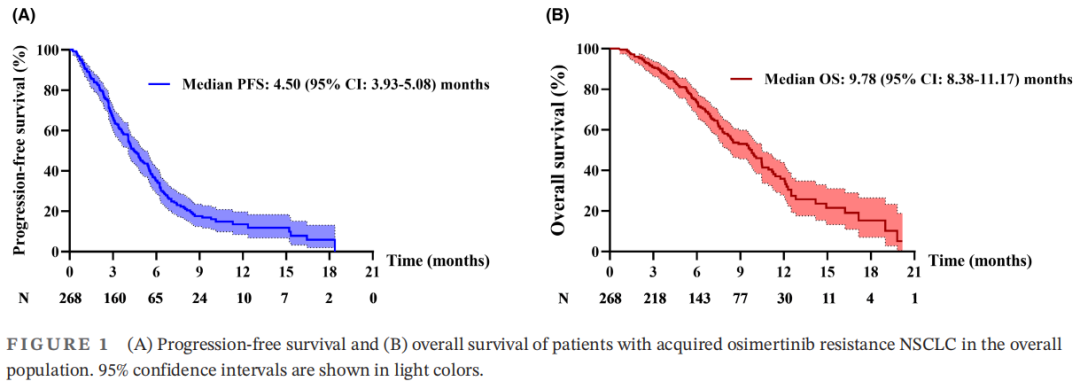
图1
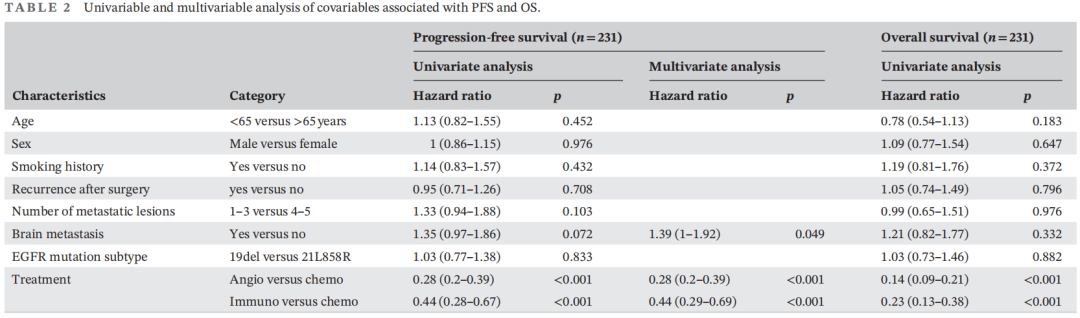
表2
128例(47.8%)患者死亡。中位OS为9.78(95%CI:8.38-11.17)(图1B)。单因素分析还发现治疗与OS相关(表2),基于抗血管生成治疗组的OS更长[p(基于抗血管生成治疗vs.化疗)<0.001,p(免疫治疗vs.化疗)<0.001],表明治疗是OS的独立预后因素。
治疗组的生存分析:
为了进一步探讨三种方案的生存差异,研究者根据总体人群的治疗分为三组,分别分析PFS和OS。三组患者的临床病理特征见表3。三组间临床病理特征差异无统计学意义,提示不存在明显的选择偏倚。基于抗血管生成治疗组的中位PFS为6.23个月(95%CI:5.69-6.77),免疫治疗组为3.62个月(95%CI:2.45-4.79),化疗组为2.78个月(95%CI:2.50-3.05)(图2A)。基于抗血管生成治疗组的PFS显著长于免疫治疗组(HR:0.71,p=0.050)和化疗组(HR:0.28,p=0.001)。同时,中位OS在基于抗血管生成治疗组为12.18个月(95%CI:11.36-13.00),在免疫治疗组为11.41个月(95%CI:6.14-16.68),在化疗组为5.5个月(95%CI:4.85-6.15)(图2B)。基于抗血管生成治疗组的总生存期显著长于化疗组(HR:0.14,p=0.001),而基于抗血管生成治疗组与免疫治疗组之间的总生存期无显著差异(HR:0.60,p=0.054)。比较三组患者的总缓解率(ORR)和疾病控制率(DCR)。结果显示,基于抗血管生成治疗组的ORR和DCR均长于免疫治疗组和化疗组(图3;ORR:11.6% vs. 10.6%和6.6%;DCR:65% vs. 49%和42.1%)。综上所述,对于奥希替尼耐药的NSCLC患者,基于抗血管生成治疗可能是一种有前景的选择方案。

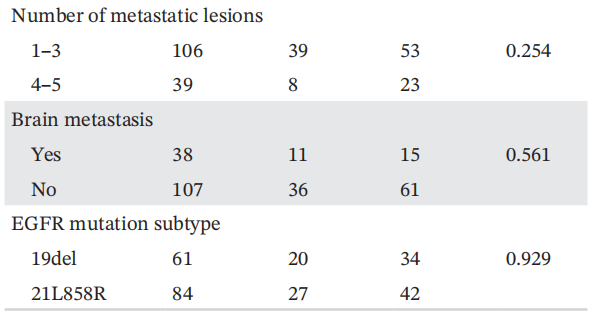
表3
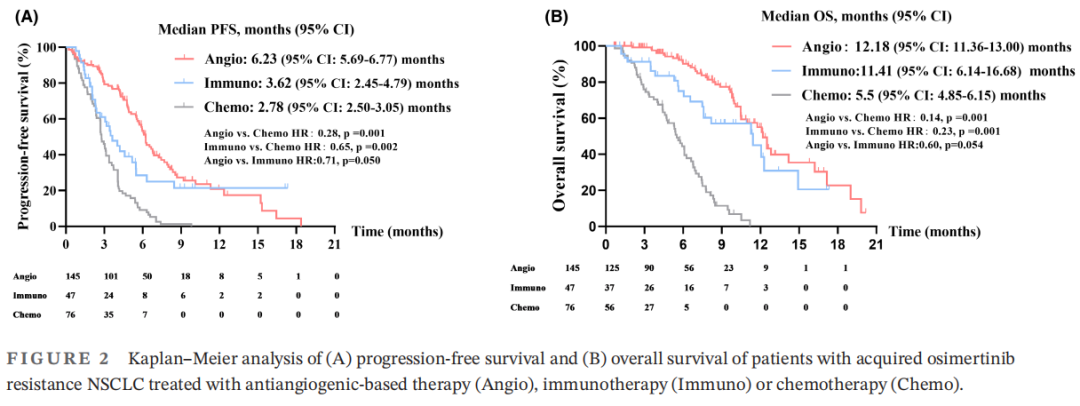
图2
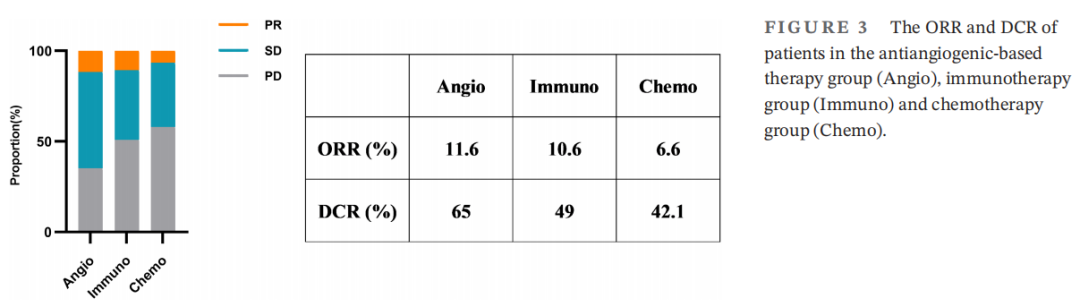
图3
基于抗血管生成治疗亚组的生存分析:
接下来,研究者分析了两种抗血管生成方案(安罗替尼和贝伐珠单抗)之间的差异。为了减少选择偏倚,研究者对两个亚组进行了PS匹配。PS匹配前后的临床病理特征见表4。在PS匹配前,安罗替尼组的中位PFS为6.87个月(95%CI:4.91-8.82),贝伐珠单抗组为5.93个月(95%CI:4.56-7.31)(图4A)。安罗替尼组的PFS显著长于贝伐珠单抗组(HR:0.58,p=0.010)。安罗替尼组的中位OS为12.81个月(95%CI:10.31-15.32),贝伐珠单抗组为10.46个月(95%CI:9.75-11.16)(图4C)。两组的OS无显著差异(HR:0.60,p=0.069),但生存曲线显示安罗替尼组获益更多。经PS匹配后,安罗替尼组的中位PFS为5.93个月(95%CI:4.56-7.31),贝伐珠单抗组为5.75个月(95%CI:0.88-10.62)(图4B)。安罗替尼组的中位OS为12.81个月(95%CI:8.46-17.17),贝伐珠单抗组为10.46个月(95%CI:9.75-11.16)(图4D)。两组患者的PFS和OS差异均无统计学意义(PFS,HR:0.63,p=0.087;OS,HR:0.52,p=0.063),生存曲线也显示出安罗替尼组获益更多的趋势。以上结果提示,奥希替尼耐药的NSCLC患者可能从安罗替尼作为后线治疗中获益更多。
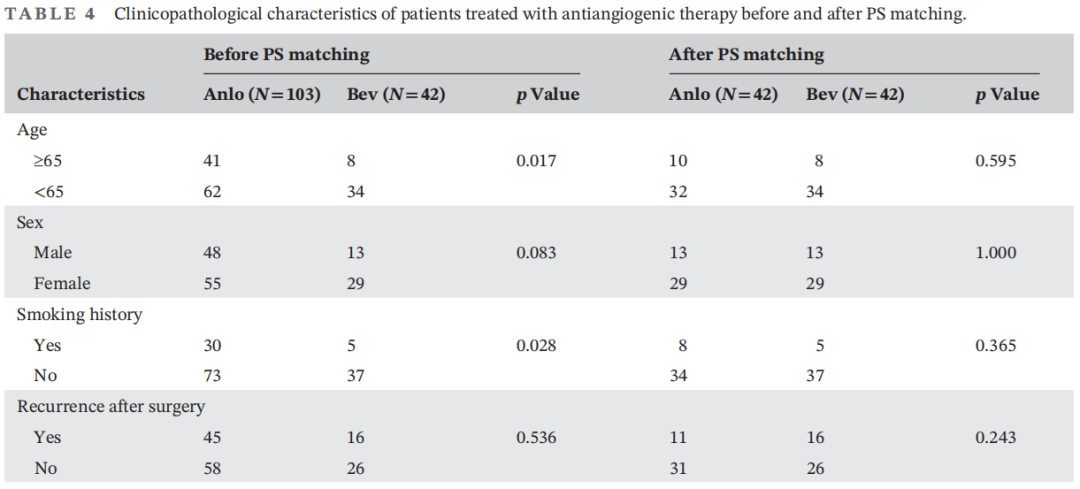
表4
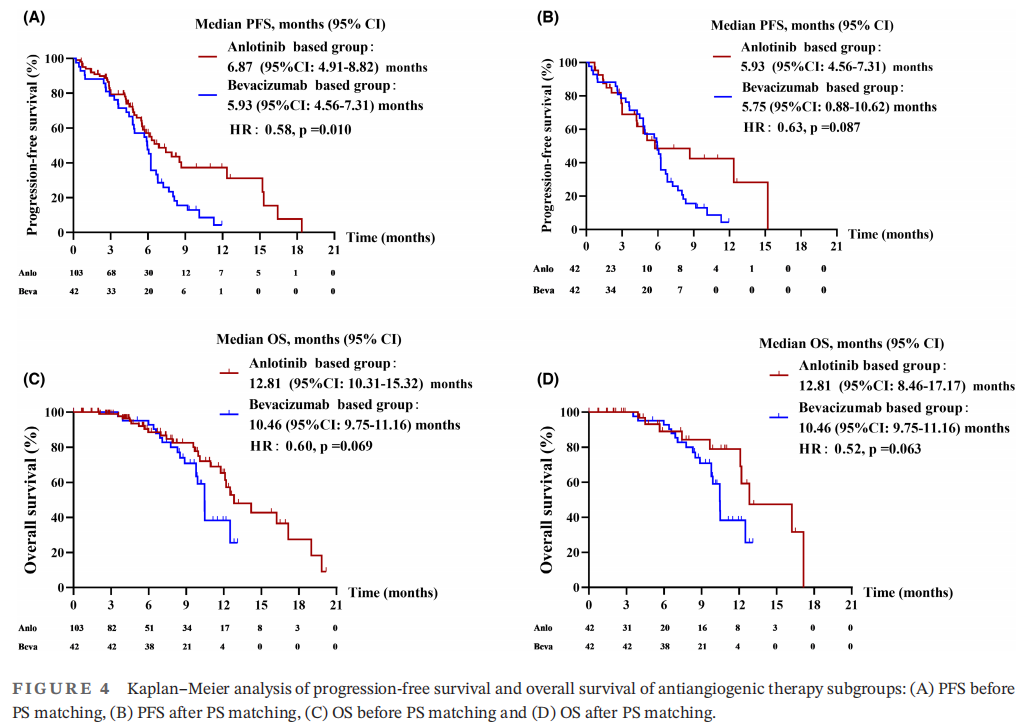
图4
细胞生长、活力和集落形成测定:
为了研究安罗替尼以及联合奥希替尼在奥希替尼耐药的EGFR T790M突变NSCLC中的潜在抗肿瘤作用,研究者在经安罗替尼和/或奥希替尼治疗的H1975和奥希替尼耐药H1975细胞系(H1975OR)中进行了细胞生长和活力测定。结果证实,与亲代细胞系相比,H1975OR细胞系对奥希替尼耐药(H1975OR IC50=6.113μM,图5A)。另一方面,单独使用安罗替尼对H1975OR产生了有效的细胞毒性作用,H1975OR也比亲代细胞系对安罗替尼更敏感(H1975OR IC50=1.513μM;H1975 IC50=2.300μM,图5B)。接下来,研究者探讨了安罗替尼联合奥希替尼的效果。用两种指定浓度的药物处理细胞系,并应用于CCK-8检测。结果表明,与奥希替尼单药治疗相比,联合治疗对H1975OR更有效(图5C)。而在亲代细胞系中,奥希替尼单独用药显示出显著的细胞毒性,但联合用药未产生像H1975OR那样的充分细胞活力抑制(图5D)。此外,用一定浓度的安罗替尼和/或奥希替尼处理H1975OR细胞,比较不同处理组的生长能力和活力。研究结果提示,安罗替尼比奥希替尼更有效,并且安罗替尼联合奥希替尼对H1975OR细胞系表现出比安罗替尼或奥希替尼单独用药更强的抑制作用(图5E、F)。然后,研究者采用集落形成试验探讨安罗替尼或与奥希替尼联合是否能长期抑制细胞生长。H1975OR细胞经单药或联合处理后,培养7天。集落形成试验表明安罗替尼联合奥希替尼对H1975OR细胞系有长期的细胞毒性作用(图5G、H)。这些发现表明,安罗替尼和安罗替尼联合奥希替尼可能是奥希替尼耐药的EGFR T790M突变NSCLC的潜在有效治疗方案。

图5
讨 论
本项多中心研究回顾性评估了奥希替尼获得性耐药患者的三种常用治疗方法的疗效。研究结果表明,与免疫治疗或化疗相比,基于抗血管生成的治疗可以使这组患者获益更多。此外,作为奥希替尼耐药后的后线治疗,安罗替尼(一种多靶点TKI)单药或与奥希替尼联用可能比贝伐珠单抗单药或与奥希替尼联用产生更多的临床获益。
WJOG9717L试验首先研究了对于未经治疗的EGFR突变NSCLC患者,奥希替尼联合贝伐珠单抗是否优于奥希替尼单药治疗。结果显示两组在PFS方面无显著差异(奥希替尼联合贝伐珠单抗组的mPFS为22.1个月,奥希替尼组为20.2个月,HR:0.862 [95%CI:0.531-1.397],p=0.213)。与此同时,BOOSTER试验和WJOG8715L试验研究了该联合疗法作为二线治疗用于EGFR-T790M突变NSCLC患者的疗效。BOOSTER试验显示,奥希替尼联合贝伐珠单抗组(15.4个月[95%CI:9.2-18.0个月])和奥希替尼组(12.3个月[95%CI:6.2-17.2个月])的mPFS无差异(p=0.83,HR:0.96[95%CI:0.68-1.37])。WJOG8715试验也显示,与奥希替尼单药治疗相比,奥希替尼联合贝伐珠单抗治疗的mPFS并不更长(9.4个月vs 13.5个月,HR:1.44[80%CI:1.00-2.08],p=0.20)。然而,抗血管生成治疗对奥希替尼获得性耐药患者的潜在临床效果尚不明确。本研究数据表明,与免疫治疗和化疗相比,基于抗血管生成的治疗可能是最好的治疗方案。亚组分析发现,安罗替尼组的PFS(5.93个月[95%CI: 4.56-7.31] vs 5.75个月[95%CI: 0.88-10.62])和OS(12.81个月[95%CI: 8.46-17.17] vs 10.46个月[95%CI: 9.75-11.16])均长于贝伐珠单抗组。但PS匹配后两组间差异无统计学意义,样本量不足可能是原因之一。安罗替尼和贝伐珠单抗均为抗血管生成药物,但疗效不同,可能与药物作用靶点不同有关。安罗替尼是一种抑制VEGFR(1-3)、PDGFR (α/β)、FGFR(1-4)和c-Kit的多靶点TKI,而贝伐珠单抗是一种仅靶向VEGF-A的单克隆抗体。需要进一步的研究来证明本研究中的推测。
另一方面,在奥希替尼治疗后的免疫疗法也在研究中。既往研究提示,对于携带EGFR突变的患者,单药免疫治疗的疗效下降。KEYNOTE 789试验(NCT03515837)等近期研究更多地关注免疫治疗联合化疗,其结果应该能够阐明免疫治疗在奥希替尼耐药患者中的作用。最近,一项3期临床试验聚焦于免疫治疗+抗血管生成治疗和化疗对EGFR‐TKI治疗后疾病进展的NSCLC患者的疗效,结果显示,与单独化疗相比,信迪利单抗+IBI305+化疗组的mPFS延长(6.9个月[95% CI: 6.0-9.3] vs 4.3个月[95% CI: 4.1-5.4];HR:0.46[95%CI:0.34~0.64],p<0.0001)。值得注意的是,虽然由于基线特征和其他背景的差异,这些研究无法进行比较,但本文的多中心研究和这项3期临床试验的相似mPFS(6.87个月vs. 6.9个月)可能提示,对于免疫治疗或化疗不耐受的这组患者,可以考虑使用安罗替尼联合奥希替尼。
基于本项回顾性研究结果,研究者还进行了初步的体外试验,以评估安罗替尼以及安罗替尼联合奥希替尼对EGFR T790M突变的奥希替尼耐药NSCLC细胞株H1975OR的疗效。安罗替尼单药或联合奥希替尼对H1975OR均表现出较强的细胞毒性,为进一步的临床前和临床研究提供了基础。
然而,本研究有几个局限性。首先,这是一项回顾性、非随机研究,由于不可避免的缺失数据,选择偏倚不可避免地存在。但不同组患者的基线临床特征平衡良好或经过PS匹配处理,提示不存在较大的选择偏倚。其次,在本研究中,基于抗血管生成的联合治疗取得了更好的疗效,但不良事件不可避免地增加。由于本回顾性研究数据缺失,因此未评估不良事件及其对患者生活质量的影响。其不良反应及疗效尚需临床试验进一步探讨。第三,本研究缺乏体内试验进一步验证安罗替尼单独或联合奥希替尼的疗效。最后,越来越多的EGFR突变的晚期NSCLC患者接受奥希替尼作为一线治疗,但基于抗血管生成治疗是否也适用于一线奥希替尼耐药的患者,仍有待进一步研究。
综上所述,安罗替尼单药或与奥希替尼联合可能是奥希替尼获得性耐药的EGFR T790M突变NSCLC患者的有效治疗方案。
参考文献:
Chen, Ya et al. “Survival benefit of anlotinib in T790M-positive non-small-cell lung cancer patients with acquired osimertinib resistance: A multicenter retrospective study and exploratory in vitro study.” Cancer medicine vol. 12,15 (2023): 15922-15932. doi:10.1002/cam4.6232

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









基于抗血管生成的治疗可能改善对#奥希替尼#获得性耐药的#EGFR#突变#NSCLC#患者的PFS和OS。此外,基于#安罗替尼#的治疗可能是此类患者的一种有前景的有效治疗方法。
135