2023年有望在中国获批上市的40款创新药物
2023-02-01 MedSci原创 MedSci原创 发表于上海
以下38款有望于2023年在中国获批的新药,包括创新的小分子靶向药、双特异性抗体、抗体偶联药物(ADC)、siRNA疗法、CAR-T产品等多种分子类型,它们将有望给哪些患者带来新的希望和治疗选择。下面
以下40款有望于2023年在中国获批的新药,包括创新的小分子靶向药、双特异性抗体、抗体偶联药物(ADC)、siRNA疗法、CAR-T产品等多种分子类型,它们将有望给哪些患者带来新的希望和治疗选择。下面按靶点以及同类别进行排序。
图片来源:123RF
实际上在写本文之前,两款新冠治疗药物已经获批。按照药品特别审批程序,进行应急审评审批,附条件批准海南先声药业有限公司申报的1类创新药先诺特韦片/利托那韦片组合包装(商品名称:先诺欣)、上海旺实生物医药科技有限公司申报的1类创新药氢溴酸氘瑞米德韦片(商品名称:民得维)上市。上述两款药物均为口服小分子新冠病毒感染治疗药物,用于治疗轻中度新型冠状病毒感染(COVID-19)的成年患者。患者应在医师指导下严格按说明书用药。
以下还有38种药物在今年有望获批上市。
1、艾迪药业:艾诺米替片(复邦德)
作用机制:首个三合一(三种成分形成的单片给药)艾滋病新药
适应症:艾滋病
此次获批的艾诺米替片适应症主要针对HIV初治患者。目前,针对经治患者的III期临床试验正顺利开展,762例临床受试者的入组工作已于2022年3月末全部完成,目前临床试验工作正按计划有序推进中。
2、武田制药:琥珀酸莫博赛替尼胶囊(安卫力/EXKIVITY)
作用机制:EGFR Exon20插入突变
适应症:EGFR Exon20插入突变NSCLC的疗法
该药适用于含铂化疗期间或之后进展且携带表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。这是国内获批上市的首款用于EGFR Exon20插入突变NSCLC的疗法,实现国内该领域零的突破。
莫博赛替尼是一种专门设计用于选择性靶向EGFR Exon20插入突变的强效口服小分子酪氨酸激酶抑制剂,于2021年9月获得美国FDA批准。在中国,莫博赛替尼曾先后于2020年9月和2021年7月获得CDE突破性治疗品种和优先审评认定。
多款三代 EGFR-TKIs:贝福替尼、瑞泽替尼、Limertinib、奥瑞替尼
3、贝达药业:甲磺酸贝福替尼
作用机制:EGFR
适应症:EGFR-TKI 耐药后产生 T790M 突变的局部晚期或转移性非小细胞肺癌
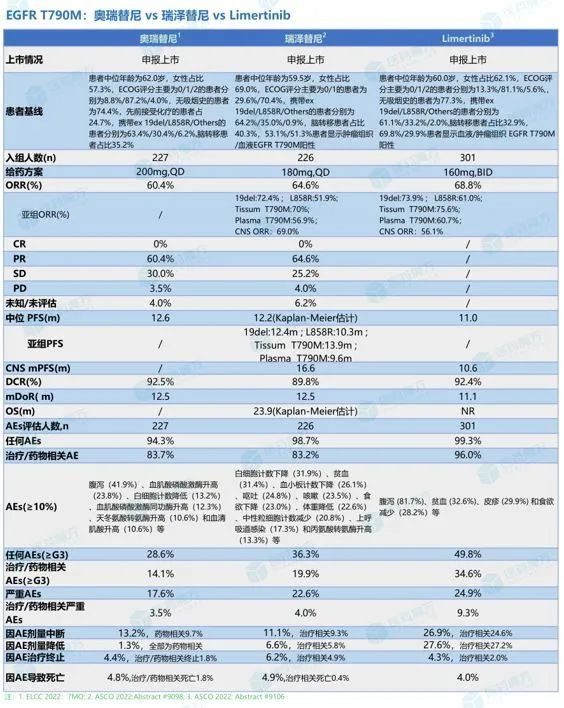
甲磺酸贝福替尼是贝达药业开发的一款针对 T790M 突变的第三代 EGFR-TKI,2021 年 3 月,贝达药业在国内递交上市申请,治疗既往使用 EGFR-TKI 耐药后产生 T790M 突变的局部晚期或转移性非小细胞肺癌。
针对一代 EGFR-TKI 耐药后产生 T790M 突变的局部晚期或转移性非小细胞肺癌患者,II 期临床试验结果显示,经独立评审委员会(IRC)评估的客观缓解率(ORR)为 64.8%,疾病控制率(DCR)为 95.2%。34 例基线有颅内靶病灶的脑转移受试者颅内客观缓解率(iORR)为 52.9%,颅内疾病控制率(iDCR)为 97.1%。
4、圣和药业:奥瑞替尼(oritinib)
作用机制:EGFR
适应症:EGFR-TKI 耐药后产生 T790M 突变的局部晚期或转移性非小细胞肺癌

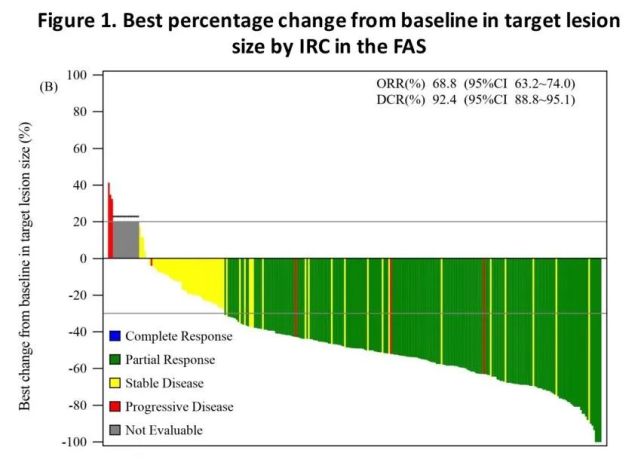
疗效方面,奥瑞替尼经独立放射学评估委员会(IRaC)确认的ORR为60.4%,全部为PR,中位无进展生存期(mPFS)12.6个月;疾病控制率(DCR)为92.5%,中位缓解持续时间(mDOR)为12.5个月。
5、上海倍而达:瑞泽替尼
作用机制:EGFR
适应症:EGFR-TKI 耐药后产生 T790M 突变的局部晚期或转移性非小细胞肺癌
从分子结构看,奥瑞替尼、瑞泽替尼、limertinib和贝福替尼与阿美替尼和伏美替尼的研究思路一致,都是基于奥希替尼进行的修饰。
甲磺酸瑞泽替尼(BPI-7711)是一款不可逆、高选择性的第三代小分子 EGFR-TKI,对 EGFR 敏感突变及 EGFR T790M 耐药突变具有显著的抑制活性。研究表明,BPI-7711 在体外细胞实验中对 EGFR(T790M/L858R、外显子 19 缺失) 基因突变的非小细胞肺癌表现出明显的抗肿瘤活性,且有效抑制浓度(EC50)比 EGFR 基因野生型的抑制浓度低 35 倍以上,体现了较好的安全性。
瑞泽替尼中位随访时间23.5个月,BICR确认的ORR为64.6%,全部为PR;mPFS为12.2个月,mDOR为12.5个月,mOS为23.9个月(Kaplan-Meier生存曲线估计),18例(8.0%)患者疾病进展前死亡。亚组分析中,组织样本T790M阳性患者ORR和mPFS都略高于全人群数据(ORR:70%, mPFS:13.9 m), 而血液样本T790M阳性患者ORR和mPFS略低于全人群(ORR:56.9%, mPFS:9.6 m),携带ex 19del突变患者mPFS获益优于L858R(12.4m vs 10.3m)。
瑞泽替尼治疗中枢转移患者的mPFS为16.6个月,ORR为69.0%,其中包括1例完全缓解。
6、奥赛康:Limertinib
作用机制:EGFR
适应症:EGFR-TKI 耐药后产生 T790M 突变的局部晚期或转移性非小细胞肺癌
2018年4月,Limertinib(ASK120067)公示了其Ⅰ/Ⅱ期临床研究。本届ASCO公布的数据为Ⅱb期疗效和安全性评估结果,301例患者在国内62家医院接受Limertinib每日两次给药(160mg,BID),21天为一个周期。患者中位年龄为60.0岁,女性占比62.1%,ECOG评分为1的患者占比最高(81.1%),无吸烟史的患者为77.3%,携带ex 19del的患者同样多于L858R患者(61.1% vs 33.2%)。主要终点是独立审评委员会(ICR)依据RECIST1.1评估的ORR,次要终点为PFS、OS和安全性等。
7、武田:mobocertinib
作用机制:酪氨酸激酶抑制剂
适应症:特定非小细胞肺癌
Mobocertinib是武田(Takeda)在研的一款“first-in-class”的强效口服小分子酪氨酸激酶抑制剂,专门为选择性靶向EGFR外显子20插入而设计。它曾获得美国FDA授予优先审评资格和突破性疗法认定,并于2021年9月在美国获得加速批准,用于治疗携带EGFR外显子20插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者。2021年7月,mobocertinib针对上述适应症的新药上市申请获得CDE受理并被纳入优先审评。
8、齐鲁制药:依鲁奥克片/依鲁阿克片
作用机制:新型ALK/ROS1抑制剂
适应症:ALK阳性NSCLC
依鲁奥克是齐鲁制药研发的新型ALK/ROS1抑制剂,它不仅可抑制不同融合类型的野生型以及ALK抑制剂耐药突变的ALK激酶活性,也可有效抑制不同融合类型ROS1激酶的活性。2021年7月,依鲁奥克片的新药上市申请获得CDE受理,拟用于既往接受过克唑替尼治疗后疾病进展或对克唑替尼不耐受的ALK阳性的局部晚期或转移性NSCLC患者。
伊鲁阿克的 I 期数据此前曾发表于期刊 Signal Transduction and Targeted Therapy 上。自 2017 年 9 月 25 日至 2018 年 10 月 15 日,递增阶段共入组 54 例 ALK/ROS1+ NSCLC 患者,扩展阶段共入组 99 例 ALK/ROS1+ NSCLC 患者,共计 153 例患者接受了伊鲁阿克片治疗。
结果显示,伊鲁阿克在 ALK/ROS1+ NSCLC 患者中具有良好的安全性、耐受性和抗肿瘤活性。具体来说:整体 ORR 分别为 59.3% (32/54) 和 56.6% (56/99)。其中未接受过 ALK 抑制剂治疗的 ALK 阳性 NSCLC 患者中,两阶段的 ORR 分别为 81.0% (17/21) 和 76.3% (29/38);既往接受过克唑替尼治疗的 ALK+NSCLC 患者中,两阶段的 ORR 分别为 38.1% (8/21) 和 45.7% (21/46);ROS1+NSCLC 患者中,两阶段的 ORR 分别为 30.0% (3/10) 和 44.4% (4/9)。
9、正大天晴: TQ-B3101、依奉阿克
而正大天晴布局的 TQ-B3101 和依奉阿克(TQ-B3139)均为 ALK/MET/ROS1 抑制剂 ,正分别针对 ROS1 阳性和 ALK 阳性 NSCLC 推进上市审评进程,预计 2023 年 Q4 获批。
此前正大天晴曾披露 TQ-B3101 一线治疗 ROS1 阳性 NSCLC 的 II 期临床数据(登记号:NCT03972189),结果显示,独立评审委员会(IRC)评估的 ORR 为 78.4%(95%CI,69.6-85.6),mPFS 为 15.6 个月(95%CI,10.2-27.0)。
TQ-B3139 是正大天晴与首药控股联合开发的,由首药控股负责化合物分子的设计与优化,经过验证的临床前候选化合物转交天晴进行临床阶段开发,双方共同享有知识产权。
2022 ESMO 会上曾披露依奉阿克对比克唑替尼一线治疗 ALK 阳性晚期 NSCLC 的 III 期临床 TQ-B3139-III-01 试验数据。该研究的主要终点是独立审查委员会(IRC)评估的无进展生存期(PFS)。
结果显示,依奉阿克组 mPFS(IRC 评估)显著优于克唑替尼组(NR vs 11.89m;HR = 0.46,p<0.0001),合并 TP53 突变的患者同样可以从依奉阿克治疗中获益(mPFS:11.93m vs 7.85m,HR = 0.47)。IRC 评估的 ORR 为 81.68% vs 69.92%,同时依奉阿克组具有更持久的疗效(mDoR:NR vs 12.68m,p= 0.0014)。
10、百时美施贵宝:ozanimod胶囊
作用机制:S1P受体调节剂
适应症:成人复发型多发性硬化和中重度活动性溃疡性结肠炎
Ozanimod是百时美施贵宝(BMS)公司旗下新基(Celgene)研发的一款新型口服选择性鞘氨醇1-磷酸(S1P)受体调节剂,它与S1P1和S1P5这两类受体亚型有选择性的高亲和性。在美国,ozanimod已获FDA批准用于治疗成人复发型多发性硬化和中重度活动性溃疡性结肠炎。2021年7月,ozanimod胶囊的新药上市申请获得CDE受理。
11、翰森制药:培莫沙肽
作用机制:EPO受体激动剂
适应症:CKD贫血患者
培莫沙肽注射液是豪森药业研发的1类新药,是一种长效的新型多肽类促红细胞生成素(EPO)受体激动剂。2021年9月,培莫沙肽注射液的新药上市申请获得CDE受理,拟用于因慢性肾脏病(CKD)引起贫血,且正在接受促红细胞生成素治疗的透析患者,每四周仅需给药一次。这与目前临床治疗中常用的肾性贫血药物多为每周给药一次不同。2022年5月,培莫沙肽注射液拟用于治疗未接受EPO治疗的非透析CKD贫血患者的第二项上市申请也获得CDE受理。
12、罗氏:注射用维博妥珠单抗
作用机制:靶向CD79b的ADC
适应症:弥漫大B细胞淋巴瘤
维博妥珠单抗是罗氏(Roche)在研的一款靶向CD79b的“first-in-class”抗体偶联药物(ADC),它通过与肿瘤细胞上的CD79b特异性结合,递送抗癌药物杀死这些B细胞,并能够减少对正常细胞的伤害。此前,该产品已在全球多个国家和地区获批,用于治疗复发性或难治性弥漫大B细胞淋巴瘤患者(DLBCL)。2021年12月,维博妥珠单抗针对DLBCL的新药上市申请获得CDE受理并被纳入优先审评。
13、杨森:盐酸艾司氯胺酮鼻喷雾剂
作用机制:NMDA受体拮抗剂
适应症:抑郁症
盐酸艾司氯胺酮鼻喷雾剂是杨森(Janssen)公司开发的一种非选择性、非竞争性NMDA受体拮抗剂。它可以特异性调节NMDA受体,从而可能帮助修复抑郁症患者大脑细胞的神经连接。2019年3月,盐酸艾司氯胺酮鼻喷雾剂在美国获批上市,与口服抗抑郁药物联合用于治疗对已有疗法产生抗性的成年严重抑郁症患者。根据杨森公司当时发布的新闻稿,这是30年以来第一款采用新作用机制治疗抑郁症的药物。2022年1月,盐酸艾司氯胺酮鼻喷雾剂的上市申请获得CDE受理。
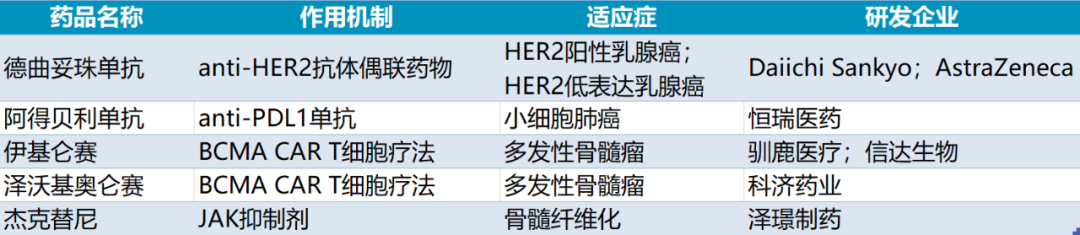
14、阿斯利康/第一三共:注射用德曲妥珠单抗
作用机制:靶向HER2的ADC
适应症:乳腺癌
预计批准时间:2023Q1
注射用德曲妥珠单抗(Enhertu)是阿斯利康(AstraZeneca)和第一三共(Daiichi Sankyo)联合开发的ADC疗法,由靶向HER2的人源化单克隆抗体通过四肽可裂解连接子,与拓扑异构酶1抑制剂有效载荷连接组成。此前,该药已获得FDA批准多个适应症,包括HER2阳性和HER2低表达的乳腺癌、HER2阳性胃癌和胃食管结合部腺癌、携带HER2突变的非小细胞肺癌等。2022年3月,德曲妥珠单抗治疗HER2阳性乳腺癌的上市申请获得CDE受理并被纳入优先审评;2022年8月,该药治疗HER2低表达成人乳腺癌的上市申请又获得CDE受理。
15、恒瑞医药:阿得贝利单抗(adebrelimab)
预计批准时间:2023Q1
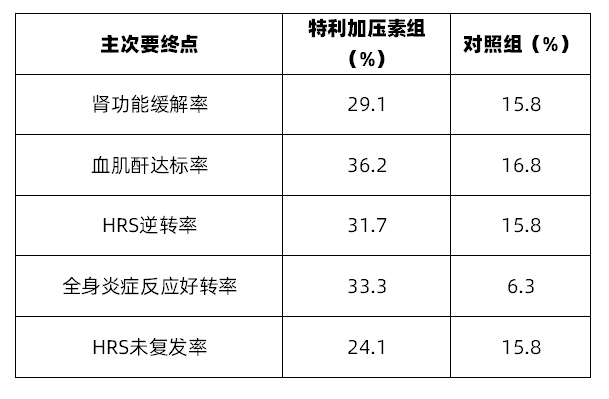
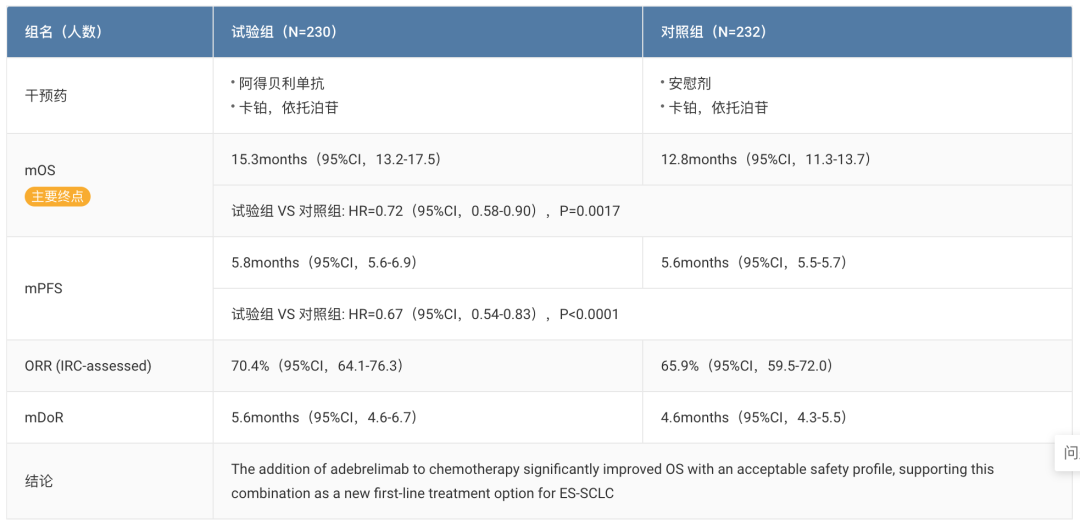
阿得贝利单抗联合化疗一线治疗广泛期小细胞肺癌的随机、双盲、安慰剂对照、多中心的Ⅲ期临床试验(SHR-1316-Ⅲ-301)结果显示,阿得贝利单抗联合化疗对比安慰剂联合化疗可以显著延长患者生存期(mOS: 15.3 vs 12.8 months)。
此前在 2021 年 10 月,恒瑞医药宣布阿得贝利单抗(SHR-1316)联合化疗一线治疗广泛期小细胞肺癌的随机、双盲、安慰剂对照、多中心的 III 期临床研究主要研究终点结果达到方案预设的优效标准。研究结果表明,SHR-1316 联合化疗对比安慰剂联合化疗可以显著延长患者生存(OS)。
而在 2022 AACR 大会上则披露了 CAPSTONE-1 详细研究结果数据,详见下图:
16、李氏大药厂/药明生物:首克注利单抗
首克注利单抗(Socazolimab/ZKAB001)是李氏大药厂自美国 Sorrento Therapeutics 公司引进的一款靶向 PD-L1 单克隆抗体。于 2021 年 10 月申报上市并获受理,适应症为复发/转移性宫颈癌,预计于今年下半年获批。
Socazolimab 为使用 Sorrento 专利 G-MAB™库平台筛选出的全人抗 PD-L1 单克隆抗体。相比竞争对手,具有以下潜在优势:作为全人抗体,免疫原性低;较之其他 PD-L1,疗效所需剂量较小;同时具备免疫检查点抑制及抗体依赖性细胞毒性(ADCC)双重作用机制。
Socazolimab 治疗复发性及转移性宫颈癌单药疗法的临床研究由吴令英主任出任牵头研究者,分两个阶段进行,首先是开放标记 3+3 剂量递增阶段,然后是关键扩展阶段研究。合共 91 名患者参与关键研究部分,结果显示 Socazolimab 疗效良好,肿瘤应答率得到改善,并与患者 PD-L1 表达水平无关;应答持续时间、无进展生存期及总生存期均得到延长。
17、科伦药业:泰特利单抗
18、Newron公司/Zambon公司:沙芬酰胺片
作用机制:抑制MAO-B和阻断钠通道
适应症:帕金森病
沙芬酰胺是由Newron Pharmaceuticals研发的一款帕金森病治疗新药,由Zambon公司、Meiji Seika、卫材(Eisai)等公司负责商业化。该产品具有独特的作用方式,包括选择性和可逆性单胺氧化酶B(MAO-B)抑制和阻断电压依赖性钠通道,从而调节异常的谷氨酸盐释放。在海外,沙芬酰胺已于2017年获得FDA批准,成为十余年来一个在美国获批用于治疗帕金森病的新化学实体。2022年4月,Zambon公司递交的沙芬酰胺新药上市申请获得CDE受理。
19、BMS公司:泊马度胺胶囊
作用机制:免疫调节剂
泊马度胺(pomalidomide)是BMS旗下新基公司开发的一种沙利度胺类似物。它属于免疫调节剂类药物,具有多重作用机制,能够抑制造血肿瘤细胞增生并诱导细胞凋亡。在海外,泊马度胺已获得FDA批准用于治疗多发性骨髓瘤和卡波西肉瘤患者。2022年6月,泊马度胺胶囊的新药上市申请获得CDE受理。
20、石药集团:纳乐舒单抗注射液
作用机制:抗RANKL单抗
适应症:骨巨细胞瘤
纳乐舒单抗注射液(JMT103)是石药集团附属公司上海津曼特生物开发的1类新药,为一款IgG4亚型全人源抗RANKL单克隆抗体。该产品采用皮下注射,通过阻断RANKL与细胞的膜上受体RANK结合,抑制RANKL-RANK信号通路介导的细胞分化成熟与功能活性,从而达到治疗疾病的作用。2022年6月,纳乐舒单抗的新药上市申请获得CDE受理并被纳入优先审评,拟用于治疗不可切除或手术困难的骨巨细胞瘤。
21、恒瑞医药:SHR8554注射液
作用机制:MOR激动剂
适应症:腹部手术后中重度疼痛
SHR8554注射液是恒瑞医药研发的一款偏向性的μ阿片受体(MOR)激动剂。公开资料显示,阿片类药物是治疗中重度急慢性疼痛常用的药物之一,MOR激动剂是阿片类药物中镇痛作用较强的一类。与经典的MOR激动剂相比,SHR8554在产生类似的中枢镇痛作用的同时,还能降低常见的胃肠道不良反应发生率。2022年7月,SHR8554注射液的新药上市申请获得CDE受理,用于治疗腹部手术后中重度疼痛。
22、BMS公司:氘可来昔替尼片
作用机制:TYK2别构抑制剂
预计批准时间:2023Q3
氘可来昔替尼是Bristol-Myers Squibb研发的TYK2抑制剂,作用于TYK2的假激酶结构域,具有高选择性,已开发用于治疗斑块状银屑病、系统性红斑狼疮、溃疡性结肠炎等多种自身免疫疾病。氘可来昔替尼于2022年9月在美国获批用于治疗中重度斑块状银屑病,这是近十年首个获批治疗该适应症的口服疗法,也是全球唯一一款获批的TYK2抑制剂。
两项治疗中重度斑块状银屑病的III期临床试验POETYK PSO-1(NCT03624127)和POETYK PSO-2(NCT03611751)结果显示,治疗16周,氘可来昔替尼 vs 阿普米司特 vs 安慰剂的PASI 75分别达到58% vs 35% vs 13%和53% vs 40% vs 9%。
Bristol-Myers Squibb于2022年7月向NMPA提交氘可来昔替尼用于治疗中重度斑块状银屑病的上市申请(JXHS2200061),预计2023Q3在中国上市。
23、礼来:galcanezumab注射液
作用机制:CGRP单抗
适应症:偏头痛
Galcanezumab是礼来公司(Eli Lilly and Company)在研的一种人源化CGRP单克隆抗体。CGRP(降钙素基因相关肽)是触发偏头痛发作的“开关”,galcanezumab通过与CGRP结合来阻断CGRP与受体相结合,从而有望缓解和改善头痛症状。此前,该药已经获FDA批准用于成人偏头痛的预防性治疗,以及减少成人阵发性丛集性头痛发作频率,可每月一次由患者自我皮下注射。2022年7月,galcanezumab注射液的新药上市申请获得CDE受理。
24、诺华/安进:依瑞奈尤单抗
作用机制:CGRP单抗
适应症:偏头痛
2022 年 4 月 ,诺华与安进合作开发的偏头痛新药依瑞奈尤单抗/Erenumab 在国内提交上市申请并获受理,这也是国内首款申报上市的抗 CGRPR 单抗。
Erenumab(AMG334)最早由安进开发,是一种全人源 IgG2 单抗,通过结合并拮抗 CGRP 受体功能来治疗偏头痛。2015 年 8 月,诺华与安进达成合作,共同开发阿尔茨海默病和偏头痛领域新药,其中就包括了 Erenumab;2017 年 4 月,两家公司扩大了针对 Erenumab 的全球合作,共同在美国开发 Erenumab,安进保留在日本的独家商业化权利,而诺华则在世界其他地区商业化该产品。
2021 年 3 月,诺华宣布 DRAGON III 期研究取得积极结果达到主要终点。这是一项随机双盲、多中心、安慰剂对照的 III 期临床试验,旨在评估 Erenumab 预防性治疗成人慢性偏头痛的有效性和安全性。该研究共入组 557 例患者,以亚洲为中心、中国人群为主。
结果表明,Erenumab 70 mg 组在 12 周双盲治疗期最后 4 周相比基线降低每月偏头痛天数(MMD)疗效终点(主要终点)上显著优于安慰剂组。此外,Erenumab 70 mg 组每月偏头痛天数相比基线减少 50% 以上的应答率显著高于安慰剂组。同时,Erenumab 的安全耐受性特征与安慰剂组相似,未发现新的安全性问题。
25、辉瑞:Rimegepant
作用机制:CGRP单抗
适应症:偏头痛
辉瑞在 2021 年 11 月以总额 12.4 亿美元与 Biohaven 达成合作,获得了两款 CGRP 拮抗剂的权益,包括口服偏头痛药物 Rimegepant(Nurtec® ODT)在美国以外的权益。
Rimegepant 通过可逆地阻断 CGRP 受体来靶向偏头痛的关键成分,从而抑制导致偏头痛发作的生物级联反应。
2020 年 2 月,该药在美国首次获批,2021 年 5 月又获批扩展适应症,是首个同时获批用于成人偏头痛急性和预防性治疗的口服 CGRP 受体拮抗剂。此后,于 2022 年 4 月在欧洲获批上市。
2022 年 2 月,Biohaven 和辉瑞共同宣布 Rimegepant 用于治疗急性偏头痛的 3 期临床试验达到了有效性和安全性的共同主要终点。这是 Rimegepant 用于急性偏头痛治疗的第 4 个积极 3 期临床研究,同时也是首个在亚太地区进行的研究。
该研究是一项随机、多中心 3 期临床研究(登记号:NCT04574362),共纳入 1431 名成人患者,其中近 80% 的受试者入组来自中国,其余约 20% 在韩国。
研究结果显示,在单次口服给药 2 小时后达到了无疼痛 (p<0.0001) 和最烦人的偏头痛相关症状 (MBS,包括恶心、畏声或畏光) 的共同主要终点 (p<0.0001) 。在该研究中,单次口服 75 mg 的 rimegepant 可显著缓解偏头痛症状,并在 2 小时后恢复正常功能,并为许多患者提供持续长达 48 小时的持续疗效。
安全性方面,Rimegepant 在研究参与者中显示出良好的安全性和耐受性,这与美国先前的临床试验结果一致。
26、罗氏:faricimab
作用机制:Ang-2/VEGF-A双抗
Faricimab注射液是罗氏在研的一种双特异性抗体,它可以同时靶向阻断两条关键致病通路——Ang-2和VEGF-A。这两种通路都能破坏血管的稳定性,使血管发生渗漏,增加炎症的发生,从而驱动许多可导致视力丧失的视网膜疾病。此前,faricimab已在全球数十个国家和地区获批上市,用于治疗湿性或新生血管性年龄相关性黄斑变性(AMD)和糖尿病性黄斑水肿(DME)患者。2022年8月,该产品的新药上市申请获得CDE受理。
27、罗氏:珂罗利单抗
作用机制:新一代C5补体抑制剂
适应症:阵发性睡眠性血红蛋白尿症
珂罗利单抗是罗氏在研的一种新一代C5补体抑制剂,可以阻断补体C5裂解为C5a和C5b,抑制补体活化。此前,该药用于治疗阵发性睡眠性血红蛋白尿症(PNH)的适应症已被CDE纳入突破性治疗品种和优先审评。PNH是一种危及生命的综合征,会突然出现血尿、贫血和血栓形成。抑制补体C5是具有显著临床症状的PNH患者的治疗标准。2022年8月,珂罗利单抗治疗PNH的新药上市申请获得CDE受理。
珂罗利单抗(Crovalimab/RO7112689)是罗氏的新一代补体 C5 抑制剂,用于阵发性睡眠性血红蛋白尿(PNH),于 2022 年 8 月在国内申报上市,值得一提的是,珂罗利单抗是罗氏首个以中国为始发地的新药,有望于今年获批。
作为长效补体 C5 抑制剂,Crovalimab 可每月一次给药,同时作为皮下注射剂,患者可以在家自行给药,大大提升了依从性。这款药物针对的 C5 表位与首款上市的同类药物依库珠单抗(Soliris)不同,因此可以覆盖到依库珠单抗所覆盖不到的 C5 多态性的患者。
28、礼来:替尔泊肽注射液
作用机制:GIP/GLP-1受体双重激动剂
替尔泊肽是礼来公司开发的一款可同时激活GIP和GLP-1受体的“first-in-class”药物,它可以通过双重作用机制改善血糖控制。该药通过每周一次皮下注射,可以根据耐受性调节剂量。今年5月,该药刚获得美国FDA批准用于改善成人2型糖尿病患者的血糖控制。根据礼来早前发布的新闻稿,该药代表着近10年来一个新糖尿病药物类型。2022年9月,替尔泊肽注射液的新药上市申请获得CDE受理。
替尔泊肽注射液(Tirzepatide)是首款治疗 2 型糖尿病的 GLP-1R 双靶点降糖药,每周一次给药,曾在大型 III 期临床中头对头击败司美格鲁肽,引发热议。2022 年 5 月,FDA 刚刚批准该药在美国上市。
替尔泊肽的全球 3 期临床开发计划 SURPASS 系列研究启动于 2018 年底,包括 5 个全球注册试验和 2 个日本区域临床试验。2021 年,礼来陆续公布了这些注册性临床试验结果,头对头完胜。
其中,头对头司美格鲁肽的 SURPASS-2 (登记号:NCT03987919) 尤为亮眼,该项研究比较了替尔泊肽 5 mg (N=470)、10 mg (N=469) 和 15 mg (N=469) 与司美格鲁肽 1 mg (N= 468) 的降糖效果。
结果显示,相较于基线 A1C 水平(8.3%),替尔泊肽使受试者 A1C 平均降低了 2.0%、2.2% 和 2.3%,而司美格鲁肽平均降低 1.9%;减重方面,相较于 207 磅的基线体重,替尔泊肽使受试者平均减重 17 磅、21 磅和 25 磅,而司美格鲁肽为 13 磅。挑战司美格鲁肽成功意味着新一轮革命即将掀起,双靶点激动剂类降糖药即将成为后续降糖领域的主要竞争者。
29、泽璟制药:杰克替尼
作用机制:JAK抑制剂
适应症:骨髓纤维化
杰克替尼是泽璟制药研发的一种新型JAK抑制剂。它对Janus激酶家族四种亚型均具有显著的抑制作用,其中对JAK2和TYK2的抑制作用较强。另外,该产品还能通过抑制ACVR1蛋白的活性来降低铁调素转录,从而改善铁代谢失衡,增加血红蛋白,降低骨髓纤维化患者贫血发生率和减少输血依赖。今年10月,杰克替尼治疗中高危骨髓纤维化的新药上市申请获得CDE受理。
30、辉瑞:利特昔替尼
作用机制:JAK3/TEC抑制剂
适应症:斑秃
利特昔替尼是辉瑞(Pfizer)在研新型口服共价双激酶抑制剂,其对JAK3激酶以及在TEC家族中的酪氨酸激酶具高度选择性,共价结合JAK3独有的Cys909残基,从而与其他JAK亚型区分,可借由抑制造成脱发的免疫细胞内信息通路来达到治疗斑秃的效果。此前,利特昔替尼曾获得FDA授予突破性疗法认定用以治疗斑秃。针对溃疡性结肠炎被CDE纳入突破性治疗品种名单
2022年11月,利特昔替尼胶囊的新药上市申请获得CDE受理并被纳入优先审评,拟用于适合接受系统性治疗的12岁及以上青少年和成人斑秃患者,包括全秃和普秃。
利特昔替尼已在全球范围内开展40多项临床试验,治疗斑秃的IIb/III期临床试验ALLEGRO(NCT03732807)。
ALLEGRO 研究共纳入 718 名 12 岁及以上斑秃患者,这些患者有 50% 或更多的头皮脱发,并且斑秃症状至少半年以上。患者被随机分配每天一次接受 ritlecitinib 50 mg 、30 mg、10 mg 或安慰剂。
结果显示,在疗效方面,与安慰剂相比,接受 30 mg 和 50 mg ritlecitinib 治疗的患者(无论是否接受初始治疗),在治疗 6 个月后,头皮毛发脱落 ≤20% 的患者比例显著高于安慰剂组。
安全性方面,Ritlecitinib 在成人和青少年患者中均具有良好的耐受性。在第 48 周期间,分别有 82% 和 2% 的患者发生不良事件(AE)和严重不良事件(SAE)。最常见的 AE 是头痛、鼻咽炎和上呼吸道感染。
ALLEGRO-LT 则是一项正在进行的开放标签、长期 III 期临床研究,旨在研究 Ritlecitinib 对脱发率达 25% 或以上的成人斑秃患者和脱发率达 50% 或以上的 12 岁青少年斑秃患者中的安全性和有效性。
31、吡西替尼(Smyraf)
作用机制:JAK3选择性抑制剂
适应症:类风湿关节炎
预计批准时间:2023Q4
吡西替尼是Astellas Pharma研发的JAK3选择性抑制剂。2016年Astellas Pharma与Maruho公司达成合作,共同开发和商业化吡西替尼外用制剂用于皮肤病治疗,Astellas Pharma保留吡西替尼用于治疗类风湿关节炎的全球权益。吡西替尼于2019年3月在日本获批用于治疗类风湿关节炎。
吡西替尼治疗类风湿关节炎的III期临床试验(NCT02308163)研究结果显示,对DMARDs反应不足的患者治疗12周,吡西替尼vs 依那西普 vs 安慰剂的ACR20为74.5% vs 83.5% vs 30.7%。吡西替尼在国内开展的一项III期临床试验(CTR20181199),共纳入385例患者,评估吡西替尼治疗对甲氨蝶呤反应不足或不耐受的类风湿关节炎患者的安全性和有效性,该试验已于2021年4月达到第24周时ACR20反应率的主要终点。
Astellas Pharma于2022年8月向NMPA提交吡西替尼用于治疗类风湿性关节炎的上市申请(JXHS2200073),目前处在审评阶段,预计2023Q4获批。
32、驯鹿生物/信达生物:伊基仑赛注射液(福可苏)
作用机制:靶向BCMA的CAR-T产品
适应症:多发性骨髓瘤
预计批准时间:2023Q3
伊基仑赛注射液是一款靶向BCMA的CAR-T细胞治疗候选药物,由驯鹿生物和信达生物联合开发。它以慢病毒为基因载体转染自体T细胞,CAR包含全人源scFv、CD8a 铰链和跨膜、4-1BB共刺激和CD3ζ激活结构域。此前,伊基仑赛注射液已获得FDA授予治疗多发性骨髓瘤的突破性疗法认定和孤儿药资格。2022年6月,伊基仑赛注射液治疗复发/难治性多发性骨髓瘤的新药上市申请获得CDE受理并被纳入优先审评。
I/II期注册性临床(NCT05066646)研究结果显示,伊基仑赛在人体内具有优异的安全性和有效性,79例经过至少三线治疗的多发性骨髓瘤患者经治疗后ORR为94.9%,CR/sCR为58.2%。
伊基仑赛用于治疗复发/难治性多发性骨髓瘤被CDE纳入突破性治疗品种名单,也被FDA授予孤儿药称号。驯鹿医疗于2022年6月向NMPA提交伊基仑赛用于治疗多发性骨髓瘤的上市申请(CXSS2200055),并被纳入优先审评审批程序,这是国内首款申请上市的靶向BCMA的自体CAR-T细胞产品。
33、科济药业:泽沃基奥仑赛注射液
作用机制:靶向BCMA的CAR-T产品
适应症:多发性骨髓瘤
泽沃基奥仑赛注射液(CT053)是科济药业开发的一种全人抗自体BCMA CAR-T细胞候选产品。它融合了具有较低免疫原性和较高稳定性的全人抗BCMA特异性单链抗体的CAR结构,在没有肿瘤相关靶点的情况下,可降低CAR-T细胞的自动激活,有望克服T细胞耗竭问题。此前,该产品曾获得FDA再生医学先进疗法(RMAT)和孤儿药资格,及欧洲药品管理局(EMA)优先药物资格和孤儿药资格,并被CDE纳入突破性治疗品种和优先审评。2022年10月,泽沃基奥仑赛注射液治疗复发/难治多发性骨髓瘤的上市申请获得CDE受理。
在ASH 2022上,科济药业公布了II期临床试验(CT053-MM-01)的结果,102例经过至少三线治疗的多发性骨髓瘤患者经治疗ORR为92.8%,CR/sCR为42.2%。
34、合源生物:赫基仑赛注射液
作用机制:靶向CD19的CAR-T产品
适应症:B细胞型急性淋巴细胞白血病
赫基仑赛注射液是合源生物在研的一款靶向CD19的CAR-T细胞治疗产品,它具有独特的CD19 scFv(HI19a)结构和生产制造工艺。此前,该药已被CDE纳入突破性治疗品种,并获得FDA授予孤儿药资格。2022年12月,赫基仑赛注射液的上市申请获得CDE受理并被纳入优先审评,用于治疗成人复发或难治性B细胞型急性淋巴细胞白血病(r/r B-ALL)患者。
35、信达生物:托莱西单抗注射液
作用机制:PCSK9单抗
适应症:原发性高胆固醇血症和混合型血脂异常
托莱西单抗是信达生物开发的一种靶向PCSK9的单克隆抗体。它能特异性结合PCSK9分子,通过减少PCSK9介导的低密度脂蛋白受体(LDLR)内吞来增加LDLR水平,继而增加“坏”胆固醇低密度脂蛋白胆固醇(LDL-C)清除,降低LDL-C水平。2022年6月,托莱西单抗注射液治疗原发性高胆固醇血症(包括杂合子型家族性和非家族性高胆固醇血症)和混合型血脂异常的新药上市申请获得CDE受理。
36、诺华:inclisiran注射液
作用机制:靶向PCSK9的siRNA疗法
Inclisiran注射液是诺华(Novartis)在研的一款“first-in-class”的靶向PCSK9的siRNA疗法。它可直接与编码PCSK9蛋白的mRNA结合,通过RNA干扰作用降低mRNA的水平,从而防止肝脏生成PCSK9蛋白。根据诺华公司公开资料,该药是全球一个降低低密度脂蛋白胆固醇(LDL-C)的siRNA药物,每年进行两次注射即可降低LDL-C。此前,它已在欧盟和美国等地获批上市,并落地中国海南博鳌“乐城先行区”和粤港澳大湾区。2022年11月,inclisiran注射液的新药上市申请获得CDE受理。
相较于目前上市的 PCSK9 靶向抗体药和他汀类降脂药每两周一次或每月一次的给药频率,Inclisiran 在患者依从性方面有着独一无二的治疗优势。
此前诺华披露的 ORION 系列研究显示,对于使用最大耐受剂量的 LDL-C 降低疗法后 LDL-C 水平仍高于目标值的患者。与安慰剂组相比,接受治疗 Inclisiran 治疗的患者 LDL-C 从基线至第 510 天的平均降幅可达 50%~52% 。
而对于伴随脑血管疾病(CeVD)和多血管疾病(PVD)ASCVD 患者,诺华在 2021 年 9 月公布的 ORION-9、ORION-10 和 ORION-11 研究试验的两项汇总事后分析的结果也表明,每年接受两次 Inclisiran 治疗,可有效且持续地降低 ASCVD 亚组患者(CeVD、PVD)的 LDL-C 水平
在 2022 AHA 年会上,诺华还公布了为期 4 年的 II 期开放标签 ORION-3 扩展试验结果:Inclisiran 可在 4 年内持续有效降低 ASCVD 或 ASCVD 等危症患者的 LDL-C 水平。这些患者之前在接受最大耐受他汀类药物治疗后,LDL-C 仍然升高。
在安全性方面,治疗 4 年后,Inclisiran 耐受性良好,安全性特征与既往 18 个月的 III 期研究 LDL-C 降低一致。最常见的药物相关治疗后出现的不良事件为全身性疾病及注射部位各种反应,大多数为轻度至中度。
37、正大天晴/亿帆医药:贝格司亭
作用机制:G-CSF
适应症:预防及治疗肿瘤患者在化疗过程中引起的嗜中性粒细胞减少症
正大天晴/亿帆医药贝格司亭(F-627)是一款长效 G-CSF,目前正处于上市申请阶段,用于预防及治疗肿瘤患者在化疗过程中引起的嗜中性粒细胞减少症,预计于今年将在国内获批。
在 2021 年 8 月,亿一生物已经与正大天晴就 F-627 达成了合作,以 3000 万元首付款 + 最高可达 1.8 亿元里程碑款 + 分级净销售额提成费将 F-627 在中国境内的所有知识产权和商业化权益独家许可给天晴南京顺欣,交易总额超过 2.1 亿元。天晴南京顺欣受让 F-627 药品上市许可后,将委托北京亿一进行生产。
贝格司亭是三代重组长效 G-CSF,通过 Fc 融合蛋白形成二聚体,无需 PEG 修饰,更好避免了 PEG 引起的免疫反应,因此相比于目前市场主流的二代产品在安全性上有一定优势
F-627 是目前市场上唯一一个与短效和长效 G-CSF 同时进行过大样本量头对头研究的 G-CSF 药物,在中美两地完成了临床 III 期研究,并分别在中美递交了上市申请。
38、特宝生物: 拓培非格司亭
作用机制:G-CSF
适应症:预防及治疗肿瘤患者在化疗过程中引起的嗜中性粒细胞减少症
2022 年 4 月,特宝生物拓培非格司亭注射液(Y 型聚乙二醇重组人粒细胞刺激因子)申报上市,预计于今年获批。
特宝生物的拓培非格司亭是 Y 型聚乙二醇重组人粒细胞刺激因子(YPEG-G-CSF), 采用 40kD Y 型分支聚乙二醇(PEG)分子对重组人粒细胞刺激因子(rhG-CSF)进行定点修饰。
除了上述38款新药,还有许多新药也有望于2023年获批。希望这些创新疗法早日在中国获批,为患者带来新的治疗选择!
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言