STTT:中山大学合作发现结肠癌免疫逃逸新机制
2023-09-02 转化医学网 转化医学网 发表于威斯康星
本研究结果揭示了CRC中炎症分子A20和“吃我”信号之间的新串扰,这可能是一种新的预测性生物标志物.
导读:免疫检查点抑制剂(ICIs)在部分结直肠癌(CRC)患者中诱导了持久的临床反应。然而,令人不满意的应答率和缺乏适当的生物标志物来选择合适的患者接受ICIs治疗,对目前的免疫疗法构成了重大挑战。炎症相关分子A20与肿瘤免疫反应密切相关,但A20对“吃我”信号和免疫治疗疗效的影响尚不明确。
近日,中山大学研究人员合作广东省食管癌研究所/肿瘤医学协同创新中心/华南肿瘤学国家重点实验室符立梧及王芳共同在国际权威期刊《Signal Transduction and Targeted Therapy》发表了题为“A20 promotes colorectal cancer immune evasion by upregulating STC1 expression to block ‘eat-me’ signal”的研究论文,在该研究中,研究人员发现A20下调显著提高了CRC的抗肿瘤免疫反应和PD-1抑制剂的体内外疗效。A20表达越高,CRC组织中CD3(+)、CD8 (+) T细胞、巨噬细胞等免疫细胞浸润越少,预后越差。功能研究证明,A20可通过上调STC1,与CRT结合并滞留在线粒体中,从而降低细胞膜易位中的“吃我”信号钙钙蛋白(CRT)。机制上,A20抑制GSK3β在Thr86位点磷酸化STC1,从而减缓STC1蛋白的降解。本研究结果揭示了CRC中炎症分子A20和“吃我”信号之间的新串扰,这可能是一种新的预测性生物标志物,用于选择最有可能从ICI治疗中受益的CRC患者。

https://www.nature.com/articles/s41392-023-01545-x#Sec9
结直肠癌(CRC)是最常见的恶性肿瘤之一。局部原发患者的5年生存率约为90%,淋巴结或外周转移患者的5年生存率为70.4%,远处转移患者的5年生存率为12.5%。免疫检查点抑制剂(ICIs) 已被证明在许多恶性肿瘤中具有很好的治疗前景,包括微卫星不稳定性(MSI)高的结直肠癌(crc)。ICI的工作原理是克服或减轻肿瘤诱导的免疫抑制,从而增强对癌细胞的免疫反应,从而消除肿瘤。众所周知,浸润在肿瘤微环境(TME)中的炎症细胞的丰度与ICIs的疗效密切相关。根据肿瘤突变负荷(tumor mutation burden, TMB)和t细胞炎症基因的表达水平,TME可分为四种亚型。CRCs通常分为两种类型,高卫星稳定和微卫星稳定(MSS)。较高的体细胞TMB更可能表达免疫原性新抗原,使其对ICIs有反应。相反,低TMB和低炎症基因特征通常表现为免疫荒漠或免疫细胞排斥的表型,这与抗原呈递效率低下或不存在相关,因此适应性免疫反应较差。因此,低TMB和低炎症基因标记的患者在接受免疫治疗时通常表现出较差的临床结果。
吞噬作用在癌症监测中很重要。它是由癌细胞细胞表面的几个分子“吃我”信号调节的,这些信号允许识别细胞外货物并随后激活吞噬受体和其他下游信号级联反应。钙网蛋白(CRT)是一种可溶性蛋白,主要定位于内质网(ER),被认为是一个重要的“吃我”信号。CRT的膜易位是ICI成功治疗的关键步骤。斯坦钙素-1(STC1)是一种激素样糖蛋白,已被证明可以调节钙和磷的体内平衡。肿瘤STC1可与CRT相互作用,将CRT困在线粒体区域,从而使膜CRT减少。因此,APC介导的膜性吞噬作用减弱,导致APC抗原呈递和T细胞活化受损。据推测,阻断“吃我”信号或其受体可损害apcs介导的吞噬作用并诱导对ICIs的治疗性耐药性。
炎症与包括结直肠癌在内的许多癌症的发展密切相关,并在调节癌症免疫反应中发挥关键作用。肿瘤坏死因子诱导蛋白3(tumor necrosis factor inducible protein 3, TNFAIP3) A20是一种有效的抗炎酶,可减弱细胞因子和病原体介导的炎症信号。
在本研究中,PD-1抗体在体外和体内对a20缺乏的CRC细胞产生了明显的抗癌作用。免疫细胞浸润是控制PD-1抑制剂应答的关键决定因素。在A20沉默的异种移植小鼠和A20低表达的结直肠癌患者中,肿瘤标本中CD8 (+) T细胞和巨噬细胞显著增加。高A20表达被证明会损害CD8(+) T细胞功能,并导致黑色素瘤患者对PD-1抑制剂的不良反应。靶向A20已被证明可以通过调节PD-L1的表达来激活浸润性CD8(+) T细胞,从而显著提高免疫治疗的疗效。研究表明,巨噬细胞在a20介导的免疫逃避中起关键作用。A20过表达与CRC组织中巨噬细胞浸润不良相关。A20缺乏对肿瘤生长的抑制作用可通过缺失具有CSF1R抗体的巨噬细胞恢复。在本研究中,在A20沉默的CRC细胞中,细胞膜上的CRT表达显著增加,而在A20过表达的CRC细胞中,细胞膜上的CRT表达显著降低,从而明确地证明了A20在调节“吃我”信号中发挥的关键作用。众所周知,肿瘤细胞可以通过上调免疫调节配体的表达来逃避免疫清除。在结直肠癌中,CRT向细胞膜的转移和淋巴细胞的浸润对免疫逃避具有重要意义。在结直肠癌患者的肿瘤标本中,较高的A20表达与较低的CD163(+)巨噬细胞浸润密切相关。更重要的是,在A20沉默的肿瘤小鼠中,用CSF1R抗体消耗巨噬细胞可以减轻肿瘤生长抑制,提示A20通过CRT调节免疫应答,影响巨噬细胞的抗原递呈过程。详细的机制研究数据表明,抑制A20促进了gsk3 β介导的STC1蛋白降解,并伴随着CRT蛋白向细胞膜的易位增加。为此,已知GSK3β和A20可通过NF-κB途径激活。GSK3β可以磷酸化底物蛋白并使其成核,介导SCF-β-trCP1对底物蛋白的降解。重要的是,研究人员进一步发现A20可以以竞争方式与STC1结合,从而抑制GSK3β在STC1 Thr86位点的磷酸化,从而导致STC降解。
在本研究中,研究人员通过RNA测序来探索A20介导的免疫逃避机制。KRT6A是一种介导肿瘤相关巨噬细胞活性的基因,高KRT6A的肿瘤具有热免疫表型,免疫细胞丰度增加,免疫相关途径活性增加。它们如何在A20介导的免疫逃避中起作用还有待进一步研究。此外,A20过表达也使STC1 mRNA水平升高。A20可能与其他转录因子共同促进STC1转录。
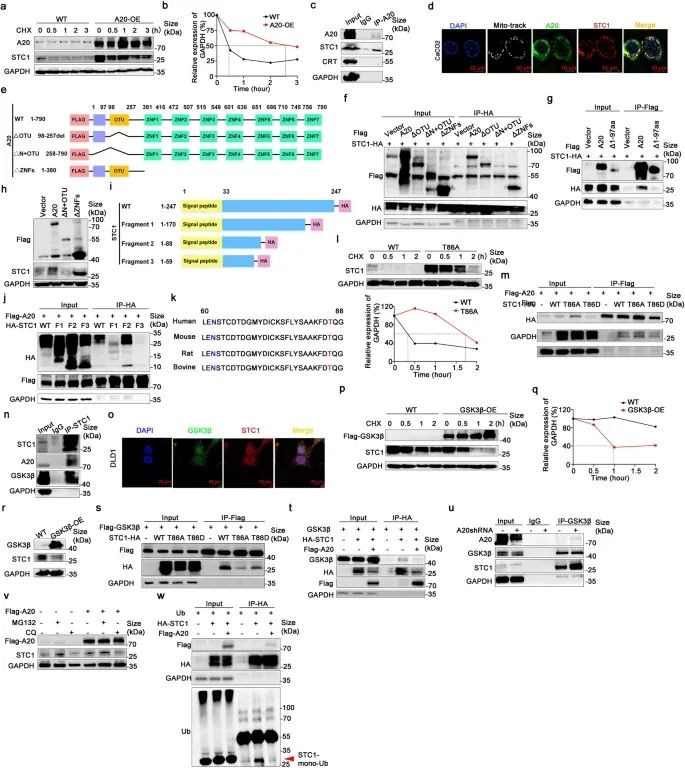
A20通过抑制STC1降解上调STC1
综上所述,本研究结果表明,A20通过上调STC1的表达来阻断“吃我”信号的膜转位,从而促进结直肠癌的免疫逃逸,这可能是一种新的预测生物标志物,用于选择最可能从ICI单独治疗或其联合其他抗癌治疗中获益的结直肠癌患者。
参考资料:
https://www.nature.com/articles/s41392-023-01545-x#Sec9
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言