CD38单克隆抗体导致交叉配血不合及解决办法
2022-08-17 杨蕾芳,邢朋涛,王新华 新乡市中心医院 “检验医学”公众号
在交叉配血过程中,如果主侧凝集,实验者未了解患者是否使用CD38单抗,可能首先想到的是患者体内存在意外抗体,或被CD38单抗掩盖的意外抗体,因此需要去除此药物干扰,正确分析究竟是药物影响还是存在意外。
前 言
交叉配血试验又称输血相容性试验,是确保患者安全输血必不可少的试验,主要是检查受血者与供血者之间有无相应的抗原-抗体反应,包括主侧(受血者血清加供者红细胞)和次侧(受血者红细胞加供血者血清)配血。除非紧急情况,任何一次输注红细胞之前必须进行交叉配血试验。
技术规范规定完整的操作规程应该包括以下几个方面:受血者既往输血史;受血者血型鉴定;抗体筛查;交叉配血等,及其他特殊情况下的相关处理。交叉配血结果包括:配血相合、配血相容及不同型相容性输注,根据不同的情况选择合适的血液进行输注。引起交叉配血不合的原因有多种,包括患者或(和)供者的原因,必须查找原因,才能正确输血,保证患者的输血安全,因此应该了解以下信息:受血者血型(包括以往检测结果),输血史及妊娠史,临床诊断,药物治疗史及其他临床相关检测结果。
随着越来越多的新型药物应用于临床疾病的治疗,在治疗患者疾病的同时,给输血相关检测也带来越来越多的挑战,出现了越来越多的新的问题亟待探索和解决。目前我院血液科针对多发性骨髓瘤患者应用了达雷妥尤单抗(Dara)进行治疗,这类药物会导致患者不同程度的抗体筛查阳性及交叉配血不合[1],对正确判断试验结果带来了干扰,现报告一例近期应用达雷妥尤单抗患者的检测结果及分析。
案例经过
主要病史:患者XX,男性,62岁,汉族,农民;主诉头晕乏力伴纳差3月余,加重2天入院,无咳嗽咳痰,无发热寒战,于当地医院给予药物治疗(具体药物不详),症状未见缓解,入院前症状加重,伴恶心呕吐,呕吐物为胃内容物(量不详),伴上腹部疼痛,活动后乏力较明显,门诊查血常规:白细胞4.28×109/L,红细胞1.98×1012/L,血红蛋白55.0g/L,血小板105×109/L,为求进一步治疗,门诊以“贫血”收治入院。
患者既往史:无高血压病,无糖尿病,无肝炎、结核及其他传染病史,无外伤手术史,无输血史,无食物过敏史,有氨基比林药物过敏史。个人无吸烟、饮酒、药物嗜好,长期外地居住史,无工业毒物、粉尘、放射性物质接触史,无家族遗传倾向疾病,已婚育一子一女。完善实验室检查(见下文所述具体实验室相关检查及结果),诊断为多发性骨髓瘤。
实验室相关检查:患者入院后给予血常规,凝血,生化、免疫、血型及抗体筛查等相关检测,结果报告如下;患者血常规结果显示:白细胞5.32×109/L,红细胞2.17×1012/L、血红蛋白58g/L、嗜酸性粒细胞百分比0.1、血小板98×109/L;
凝血结果显示:PT 11.6s,APTT 24.2s,FIB 2.03g/L,TT 18.4s,INR 1.07,FDP s6.0ug/mL,D-Dimer625ng/mL;血生化结果显示:白蛋白27.1g/L,球蛋白49.2g/L,白球比0.55,尿素21.08mmol/L,尿酸529umol/L、肌酐315.9umol/L,总胆固醇2.15mmol/L,葡萄糖6.81mmol/L。
异常免疫球蛋白(标本为骨髓穿刺、血清、尿)检测结果显示:血清M蛋白含量为37.34g/L,尿M蛋白为643.5mg/24h,M蛋白类型为IgA-λ型;流式细胞免疫荧光结果显示:CD34+CD117+细胞占有核细胞总数约0.3%,为原始/幼稚髓细胞,其免疫表型未见明显异常;粒细胞相对比例正常,其免疫表型CD11b,CD16,CD13,CD15未见明显表达紊乱,另见约4.9%浆细胞,其免疫表型为CD38++,CD138+,CD19-,CD56+,胞内免疫球蛋白Lambda轻链限制性表达,提示为单克隆浆细胞;综合以上检查结果支持多发性骨髓瘤诊断。血型(入院时检测结果)报告:B型RhD阳性,表型为CcEe,不规则抗体筛查阴性。
治疗过程:患者明确诊断后给予治疗方法:达雷妥尤单抗800mg,每周一次,共三次,硼替佐米2.2mg,第1,4,8,11天用,地塞米松20mg,第1,2,4,5,8,9,11,12天使用。
输血相关检测:由于患者红细胞及血红蛋白过低,表现为严重贫血,临床医生申请输血4u,输血科常规进行输血相关检测。患者入院时血型结果已经报告,直接进行交叉配血试验,结果发现主侧凝集(2+),无溶血,次侧无凝集无溶血;盐水法交叉配血主侧凝集±,次侧无凝集;聚凝胺检测主次侧无凝集无溶血。
随后进行不规则抗体筛查检测,检测结果为阳性,查询入院血型及抗筛结果,并查找老标本进行复查,发现旧标本卡式血型结果及卡式不规则抗体筛查结果与所发报告结果一致,但是管式不规则抗体筛查结果发现:Ⅰ:±,Ⅱ:±,Ⅲ:±,呈缗钱状凝集,加入一滴盐水后散开,判为假凝集,同时应用经典抗球蛋白法检测,结果无凝集(阴性)。
新标本(交叉配血标本)复查血型和不规则抗体筛查,发现卡式血型正反定结果与旧标本一致,但是卡式抗筛(IAT)结果显示:Ⅰ:2+,Ⅱ:2+,Ⅲ:2+,直抗(DAT)阴性,自身对照阴性,室温盐水法抗筛:Ⅰ+,Ⅱ:+,Ⅲ:+,4℃与37℃无明显变化,镜下存在缗钱状凝集。
查询患者诊断为多发性骨髓瘤,加入盐水后,凝集未完全散开,使用经典抗球蛋白法检测,仍有凝集。查询患者用药史,患者使用Dara(CD38单抗),可能因药物使用对患者不规则抗体筛查和交叉配血产生了一定的干扰,需去除干扰,才能保证输血检测的正确性。
使用2-ME去除Dara对交叉配血的干扰:在交叉配血过程中,如果主侧凝集,实验者未了解患者是否使用CD38单抗,可能首先想到的是患者体内存在意外抗体,或者被CD38单抗掩盖的意外抗体,因此需要去除此药物干扰,正确分析究竟是药物影响还是存在意外抗体,以保证安全输血。
2-ME能裂解CD38分子胞外区的二硫键,使CD38抗原变性,并阻止其与CD38单抗结合。根据糜坚青等[2]针对CD38单克隆抗体对输血相容性检测干扰及其应对方案的专家共识,按照3%红细胞悬液:0.2mol/L2-ME=1:4的比例(此比例可以根据红细胞浓度适当调节)37℃条件下作用30min,破坏不规则抗体筛查试剂红细胞及供者红细胞上的CD38抗原分子,结果显示不规则抗体筛查及交叉配血结果显示凝集基本完全消失(图3)。
试验过程中发现不同厂家的2-ME对红细胞的破坏程度有很大的区别,某些厂家的试剂可以导致红细胞直接溶解,无法进行下一步试验,更换厂家试剂后,发现红细胞溶解程度大幅度减少,基本可以得到预期结果,但是需要指出的是,由于红细胞浓度的配置以及2-ME试剂的配置及作用比例的掌握问题,对试验结果具有不同程度的影响,这与操作者具有一定的关系,因此严格按照试验步骤并适当调节配比比例进行操作是试验成功与否的关键。
综合患者使用Dara前后试验结果分析提示:Dara对患者不规则抗体筛查及交叉配血在抗球蛋白检测中的结果影响较大,而在盐水检测中影响较小,聚凝胺试验不受影响。患者使用Dara前后抗球蛋白法检测抗筛和交叉配血试验结果详细见下图(1-5),
图1为患者入院时(未使用Dara)检测血型标本,进行交叉配血及直接抗球蛋白试验和自身对照试验,结果显示主次侧无凝集无溶血,直抗阴性,自身对照阴性,提示交叉配血相合,可以输血;
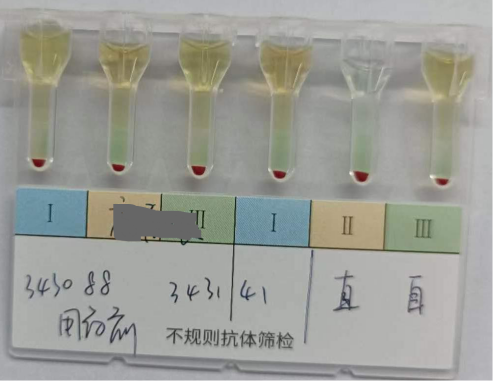
图1 用DARA前交叉配血结果
图2为患者使用Dara后的标本进行交叉配血及直接抗球蛋白试验和自身对照试验,结果显示主侧凝集2+,次侧无凝集无溶血,直抗阴性,自身对照阴性,提示患者血清中存在针对供者红细胞的抗体,此结果可能为药物抗体引起;
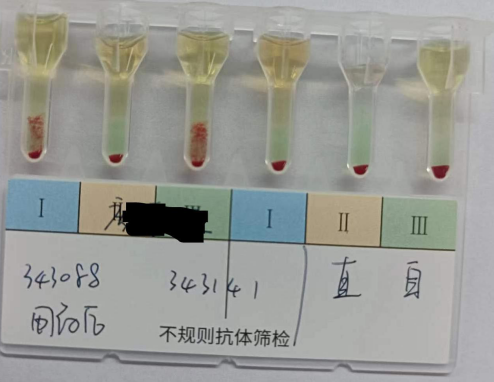
图2 用DARA后交叉配血结果
图3为用Dara前后患者不规则抗体筛查结果,结果显示用Dara前抗筛结果为阴性,用Dara后抗筛结果阳性(Ⅰ、Ⅱ、Ⅲ细胞均2+),提示患者用Dara前无意外抗体存在,用Dara后出现凝集可能与用药有关;
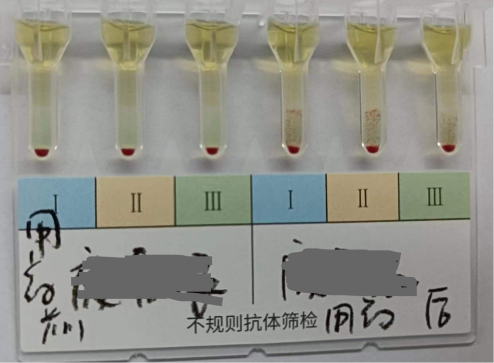
图3 用DARA前后抗筛结果
图4为2-ME处理试剂红细胞及供者红细胞表面CD38分子干扰后使用Dara后的标本不规则抗体筛查结果及交叉配血结果,结果显示抗筛阴性,交叉配血主侧凝集基本消失,仍有少部分凝集颗粒存在可能与红细胞表面CD38分子表达量、试剂敏感性、红细胞悬液浓度与2-ME配比比例不合适导致红细胞表面CD38分子未被完全破坏,使少量存在红细胞表面的CD38分子与患者血清中的CD38单抗结合后出现凝集现象等情况有关系,因此红细胞的浓度与2-me配比浓度在此实验过程中发挥着关键作用;

图4 2-ME处理后抗筛及交叉配血结果
另外患者使用了硼替佐米(26s蛋白酶体糜蛋白样活性的可逆抑制剂)此类药物是否对交叉配血(抗球蛋白法)存在影响现未可知,需要我们进一步探索;对照孔为抗-E抗体与2-ME处理后的2号抗筛细胞(E抗原)发生的凝集反应(阳性对照),由于2-me不能破坏红细胞的E抗原,因此作用后的试剂红细胞仍然保留了完整的E抗原活性,加入抗-E抗体后,仍然出现阳性反应;2-ME处理红细胞后,患者抗筛阴性,交叉配血主侧阴性,抗E对照阳性,提示试验结果有效。
图5为不同厂家抗球蛋白卡检测患者使用CD38单抗后,2-ME破坏试剂红细胞及供者红细胞CD38分子的检测结果,可见凝集强度与图4结果不一致,提示不同厂家试剂敏感度不一致。

图5 2-ME处理后抗筛及交叉配血结果
案例分析
据文献报道[3],CD38是相对分子质量为45000的2型跨膜蛋白,具有黏附分子特征,在研究人淋巴细胞表面抗体时被首次发现,同时CD38也是一种多功能胞外酶,参与烟酰胺腺嘌呤二核苷酸(NAD+)和烟酰胺腺嘌呤二核苷酸磷酸酯(NADP)的分解代谢,在调节细胞内钙储存环节发挥着重要作用。
在正常人体中,约有20%的人骨髓细胞表达CD38,主要分布在浆细胞、髓细胞、红系细胞、前体细胞以及小部分T细胞中;外周血液中,90%的浆细胞为CD38阳性,自然杀伤细胞(NK)和单核细胞中约有60%表达CD38正常T细胞上CD38的表达与细胞的激活状态有关,所以CD38也被认为是T细胞由“中期”向“晚期”转化的一个重要生物标记。
CD38在血液系统恶性肿瘤(如MM浆细胞白血病和髓外浆细胞瘤等)患者浆细胞上大量表达,这使得CD38成为血液系统恶性肿瘤治疗的重要研究靶点之一,其机制主要表现在Fc依赖的免疫效应,Dara通过与免疫效应细胞上的Fcγ受体结合发挥ADCC、ADCP及CDC等效应,从而杀伤肿瘤细胞,除此之外CD38单抗还具有正向免疫调节作用,通过抑制负向免疫调控细胞,介导CD4+、CD8+T细胞活化,提高效应T细胞功能,显着增强机体抗肿瘤免疫应答反应。
综上由于CD38单抗具有多种抗肿瘤优势,目前已被广泛应用于临床,对于输血前相关检测是一个比较棘手的问题,干扰了患者抗体筛查及鉴定和交叉配血结果,需要采用一定的技术手段和方法去除干扰,才能正确判断患者是否真正存在意外抗体及配血是否相合。
在试验过程中,我们发现用CD38单抗前由于患者自身疾病原因(多发性骨髓瘤),盐水法检测患者反定型及抗筛存在缗钱状凝集,可被盐水打开,为假凝集,但是卡式血型和抗筛检测未发现异常(可能与其自身疾病发展程度有关)。
使用CD38单抗后,盐水法检测抗筛及交叉配血主侧都有凝集(±),卡式抗球蛋白法检测抗筛及交叉配血主侧明显凝集(2+),可见CD38单抗干扰了此类检测项目;但聚凝胺检测无凝集无溶血,提示聚凝胺检测不被CD38单抗影响。
凝聚胺是一种小分子量季铵盐,可以和红细胞表面带负电荷的分子结合,但凝聚胺试验对Kell系统抗体的检测敏感性低,与Kell蛋白末端带负电荷的羧基有关,带正电荷的凝聚胺分子,在低离子介质环境中与带负电荷的Kell蛋白分子结合,干扰了Kell系统抗原-抗体反应。
基于相同的机理,可以解释凝聚胺试验对CD38相关的抗原-抗体反应不敏感;在低离子环境下,CD38分子在胞外携带负电荷的羧基,极易与凝聚胺分子结合,进而干扰CD38分子与CD38单抗的结合,所以聚凝胺试验不被影响,但应该注意其漏检问题。
用2-me处理干扰后,抗筛和交叉配血凝集轻度明显变弱甚至消失,提示2-me可以有效去除CD38单抗对此类检测的干扰,值得注意的是2-Me与红细胞的配比浓度很难恰到好处,因此在遇到破坏后仍有凝集时,很难确定究竟是意外抗体还是药物影响作用,由于此类问题解决并不容易,所以要求输血检验工作者与临床医生应该有效沟通,根据患者情况提前检测患者血型及不规则抗体筛查,并告知检验工作者患者用药情况,避免重复繁琐的常规检测,同时告知患者特殊输血风险,保证临床输血时效性和安全。
总 结
由于大多恶性血液病患者需要反复输血,随着诸如CD38单抗类药物不断应用于临床治疗,其在输血相容性检测试验中的干扰现象可能会更加普遍,将使临床输血检验工作面临更大的挑战,需要了解更多的针对不同情况的解决办法,同时需要检测者与临床医生及时沟通,保证输血安全。
本试验采用2-ME代替DTT去除干扰的方法以及应用具有一定程度的缺陷,试验时间较长,操作不够简便,相对于宋婕[4]提出的2-me去除CD38干扰方案具有一定的差别,需要再次经过试验验证,得到更好的解决方案,更简便有效解决临床问题。
参考文献
[1]骆宏,王贞,廖志坚,等.抗-CD38单克隆抗体对输血前检测试验的干扰及其处理措施[J].中国输血杂志,2020,33(3):272-274.
[2]糜坚青,蔡晓红,王少元,等.CD38单克隆抗体对输血相容性检测干扰及其应对方案的专家共识[J].中国输血杂志,2021,34(4):327-334.
[3]王天笑,李群义,施孝金,等.CD38及其单克隆抗体的研究进展[J].中国临床药学杂志,2021,30(3):232-236.
[4]宋婕,孔永奎,王书亚,等.去除CD38单抗对输血相容性检测干扰的简便方法的建立[J].中国输血杂志,2021,34(9):974-977.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#克隆#
113