真实世界数据:NRG1融合阳性实体瘤患者阿法替尼治疗的临床结局
2024-02-27 苏州绘真医学 苏州绘真医学 发表于上海
本研究呈现了关于接受阿法替尼或其他全身疗法的 NRG1 基因融合实体瘤患者的患者特征和临床结局的真实世界数据。
神经调节蛋白1(NRG1)融合可能通过组成型激活 ErbB 信号通路驱动肿瘤发生。因此,NRG1融合驱动的肿瘤可能对ErbB靶向治疗敏感。阿法替尼(不可逆的泛 ErbB 抑制剂)已在 NRG1 融合阳性实体瘤患者中显示出活性。本研究收集了关于该患者群体人口统计学、临床特征和临床结局的真实世界数据。本回顾性、多中心、非比较性队列研究纳入了在任何治疗阶段接受阿法替尼(阿法替尼队列)或其他全身疗法(非阿法替尼队列)的 NRG1 融合阳性实体瘤患者,从病历中收集数据。目的包括人口统计学、临床特征和结局(客观缓解率[ORR]、无进展生存期[PFS]和总生存期[OS])。纳入了多种实体瘤类型的患者(N = 110)。72例接受了阿法替尼治疗,38例接受了其他治疗。在阿法替尼队列中,70.8%的患者接受了阿法替尼作为二线治疗,69.4%的患者基线时东部肿瘤协作组体能状态评分(ECOG PS)为2-4。在非阿法替尼队列中,94.7%的患者接受了全身疗法作为一线治疗,31.6%的患者基线时ECOG PS为2-4。在阿法替尼队列中,总体ORR为37.5%(作为一线治疗时为43.8%),中位PFS和OS分别为5.5个月和7.2个月。在非阿法替尼队列中,ORR为76.3%,中位PFS和OS分别为12.9个月和22.6个月。本研究提供了关于接受阿法替尼或其他疗法的 NRG1 融合阳性实体瘤患者特征的真实世界数据,在两组中均观察到持久缓解。然而,队列之间存在不平衡,本研究并非旨在比较结局。需要进一步的前瞻性/回顾性研究。
研究背景
由DNA结构重排引起的致癌基因融合可导致基因活性失调,驱动肿瘤的发生发展。由这些致癌基因融合驱动的肿瘤可能对酪氨酸激酶抑制剂(TKI)治疗敏感。靶向ALK、ROS1、RET和NTRK融合的TKIs的临床结局令人印象深刻,改变了标准治疗。
已在多种实体瘤中发现神经调节蛋白1 基因(NRG1)融合。NRG1包含一个表皮生长因子样结构域,该结构域与ErbB/人表皮生长因子受体(HER)家族激酶结合,特别是HER3和HER4,导致异二聚化(HER2/HER3、HER3/HER4或HER2/HER4)和下游信号通路激活,从而导致肿瘤发生。NRG1融合在多种肿瘤类型中是罕见事件,包括在非小细胞肺癌(NSCLC)、胰腺导管腺癌(PDAC)、结直肠癌和胆管癌中。NRG1 融合在实体瘤中相对罕见(<1%),但在某些人群中这些事件富集,高达31%的浸润性黏液腺癌(IMA)携带NRG1融合。
NRG1基因融合及其下游信号通路是治疗干预的可行靶点。ErbB靶向治疗已显示出早期前景,包括抗体GSK2849330、zenocutuzumab(MCLA-128)和seribantumab,以及小分子TKI,如阿法替尼。阿法替尼是一种不可逆的泛ErbB抑制剂,在携带NRG1融合的临床前肿瘤模型和NRG1融合阳性肿瘤患者中显示出活性。阿法替尼目前已获批用于携带表皮生长因子受体(EGFR)敏感突变的晚期/转移性NSCLC患者的一线治疗,以及铂类化疗后进展的转移性鳞状NSCLC患者。阿法替尼对NRG1融合阳性肿瘤有效的初步证据来自于NSCLC患者持久缓解的病例报告;此后,在其他一些实体瘤中也观察到了类似的发现。目前,关于NRG1融合驱动肿瘤患者的特征以及阿法替尼或其他全身疗法的结果的数据有限。
本研究呈现了关于接受阿法替尼或其他全身疗法的 NRG1 基因融合实体瘤患者的患者特征和临床结局的真实世界数据。本研究的目的是描述NRG1融合阳性实体瘤患者的人口统计学和临床特征,以及描述接受阿法替尼和其他全身疗法的患者的临床结局。
研究结果
患者
识别了 114 例携带 NRG1 融合的肿瘤患者,最终分析包括 110 例患者(图1)。两个队列中最常用的检测平台是Foundation One(阿法替尼队列为40.3%,非阿法替尼队列为71.1%)。
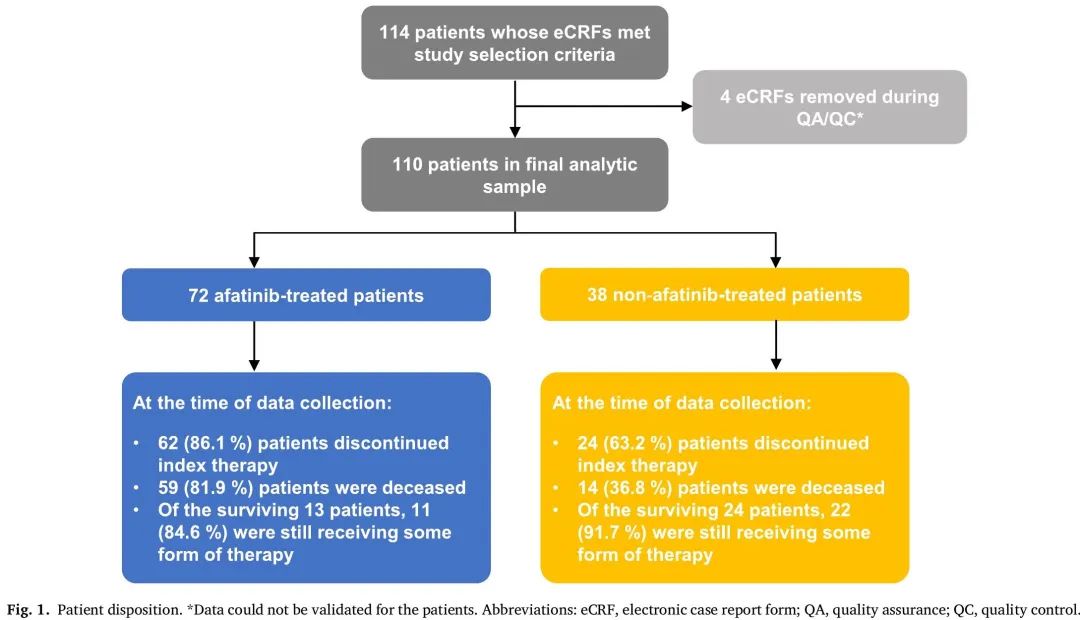
图1
阿法替尼队列包括72例患者:58.3%为男性,癌症诊断时的中位年龄为62岁(范围:37-78),大多数患者接受阿法替尼作为二线治疗(70.8%;表1)。在开始index therapy(定义为 NRG1 检测后接受的治疗 [阿法替尼或非阿法替尼,取决于队列] )(阿法替尼)时,大多数患者(69.4%)东部肿瘤协作组体能状态评分(ECOG PS)为2-4,30.6%的患者为0或1。大多数患者有转移性疾病。NSCLC是最常见的肿瘤类型,占40.3%(n=29),其中86.2%组织学类型为腺癌。2例患者患有IMA。在NSCLC患者中,最常见的NRG1融合伴侣是CD74(34.5%)。该队列中第二常见的肿瘤类型是PDAC,占15.3%,其中最常报告的NRG1融合伴侣是SDC4(18.2%)。在阿法替尼队列中,NSCLC一线治疗最常用的是卡铂、培美曲塞和帕博利珠单抗联合治疗,PDAC一线治疗最常用的是吉西他滨加白蛋白结合型紫杉醇。在接受阿法替尼作为二线或以上治疗的56例患者中,既往治疗的总体客观缓解率(ORR)为37.5%,范围从膀胱癌和神经内分泌癌的0%到一例卵巢癌患者的100%不等。在NSCLC患者中,既往治疗的ORR为40.0%。
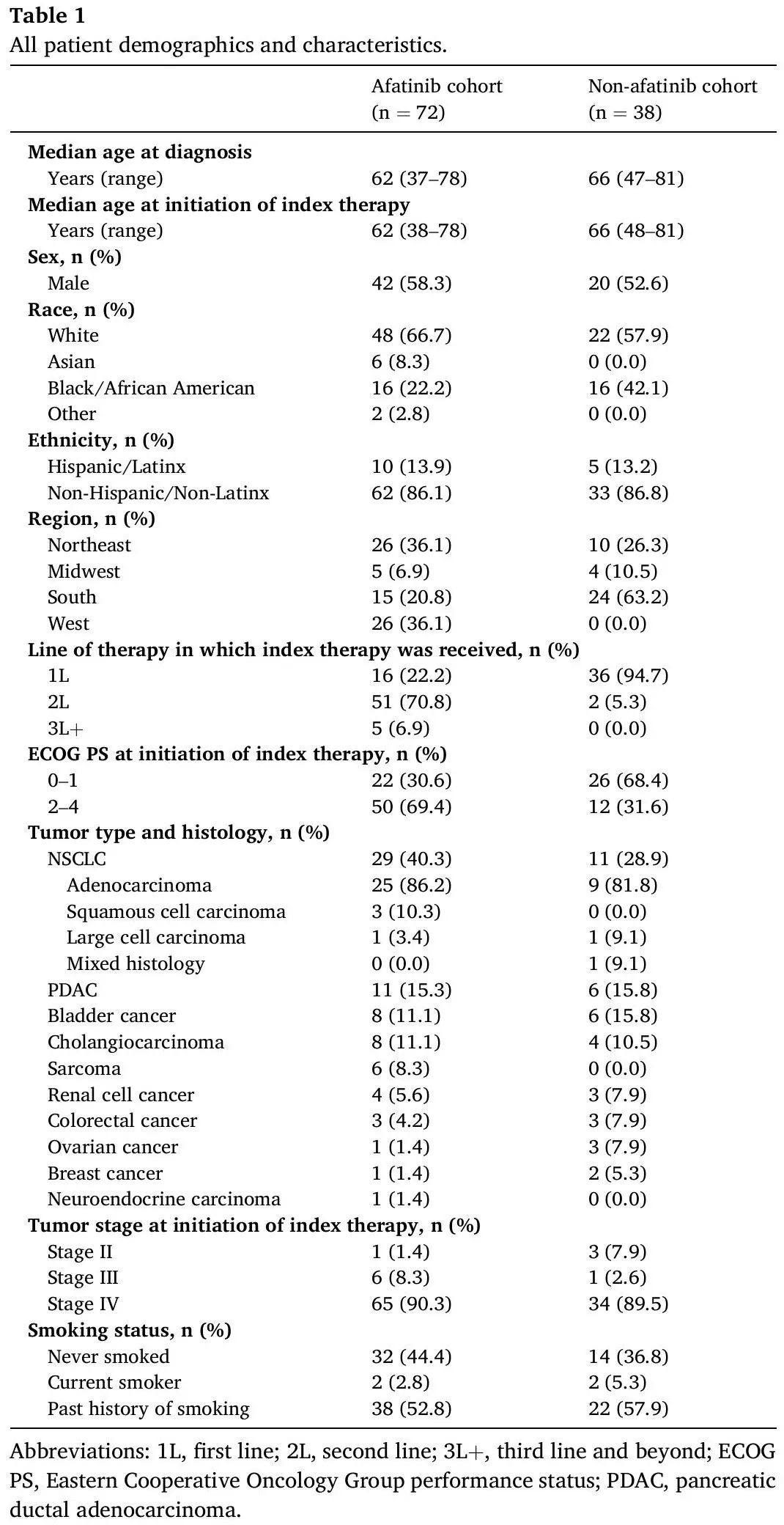
表1
非阿法替尼队列包括38例患者:52.6%为男性,癌症诊断时的中位年龄为66岁(范围:47-81)。非阿法替尼队列中大多数患者接受index therapy作为一线治疗(94.7%;表1)。在开始index therapy时,大多数(68.4%)患者的 ECOG PS 为 0 或 1,31.6% 的患者为 2-4。大多数患者有转移性疾病。NSCLC也是该队列中最常见的肿瘤类型,占28.9%,其中大多数也是腺癌(81.8%),并且均接受index therapy作为一线治疗。在NSCLC患者中,最常见的NRG1融合伴侣是CDH1(27.3%)。该队列中第二常见的肿瘤类型是PDAC,占15.8%,其中最常报告的融合伴侣也是CDH1(33.3%)。与阿法替尼队列类似,NSCLC和PDAC一线治疗最常用的是卡铂、培美曲塞和帕博利珠单抗以及吉西他滨加白蛋白结合型紫杉醇。
在数据收集时,阿法替尼队列中86.1%的患者已经停止index therapy,81.9%的患者死亡,84.6%的存活患者仍在接受某种形式的治疗。在非阿法替尼队列中,63.2%的患者已经停止index therapy,36.8%的患者死亡,91.7%的存活患者仍在接受某种形式的治疗(图1)。
阿法替尼队列的临床结局
根据医生的评估,在整个阿法替尼队列中,ORR为37.5%,包括5例完全缓解(CR)和22例部分缓解(PR)。中位缓解持续时间(DOR)为5.9个月(95% CI:3.4-9.0),中位临床获益持续时间(DOCB)相似,中位治疗时间(TOT)为5.4个月(95% CI:4.2-5.8;表2)。阿法替尼作为一线治疗时的ORR为43.8%,中位DOR和DOCB未达到(NR)。
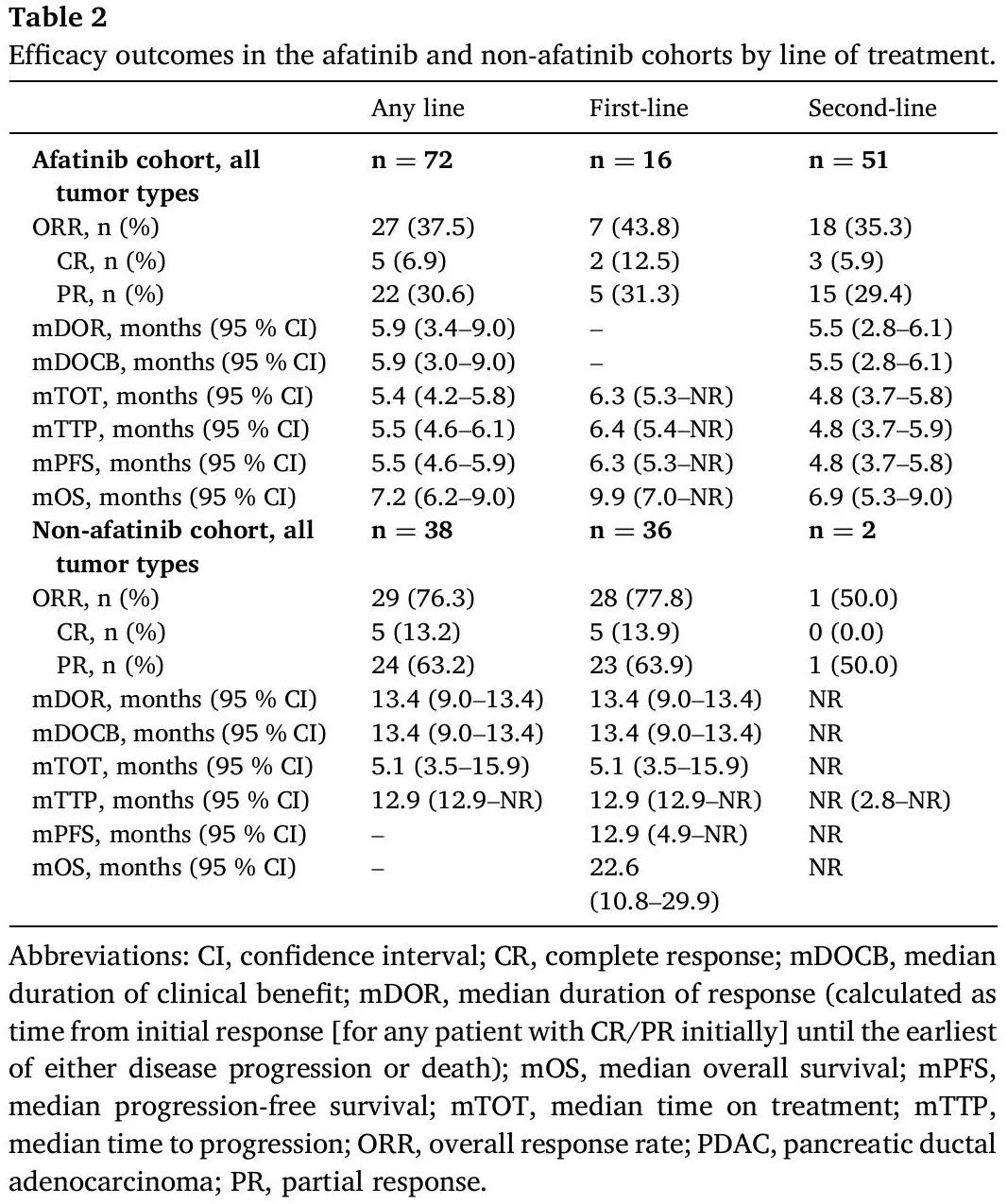
表2
在接受阿法替尼治疗(任何治疗阶段)的NSCLC患者(n=29)中,ORR为48.3%(3例CR,11例PR),中位DOR为6.8个月(95% CI:3.4-10.5;表3)。在接受阿法替尼治疗的PDAC患者(n=11)中,ORR为9.1%(1例PR),中位DOR为NR(表3)。2/3例结直肠癌患者经阿法替尼治疗达到 CR,4/8例胆管癌患者达到 PR。
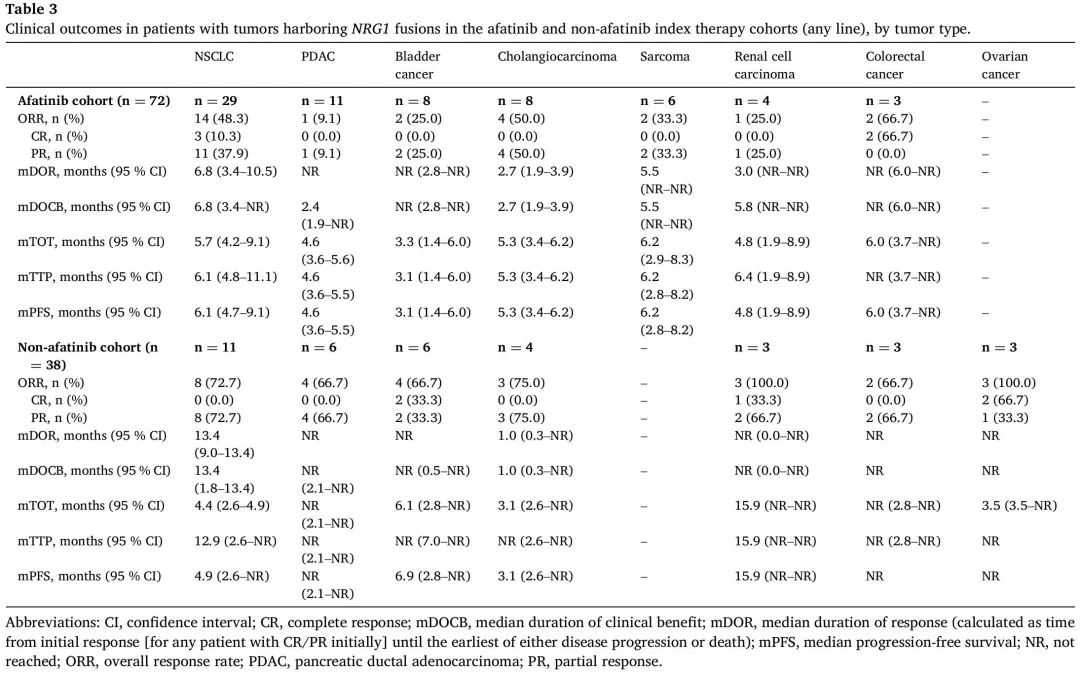
表3
总体中位无进展生存期(PFS)为5.5个月(95% CI:4.6-5.9)(表2;图2A),接受阿法替尼作为一线治疗时为6.3个月(95% CI:5.3-NR)(图2B),接受阿法替尼作为二线治疗时为4.8个月(95% CI:3.7-5.8)(表2)。NSCLC患者(任何治疗阶段)的中位PFS为6.1个月(95% CI:4.7-9.1;表3;图2C),PDAC患者为4.6个月(95% CI:3.6-5.5)(图2D)。
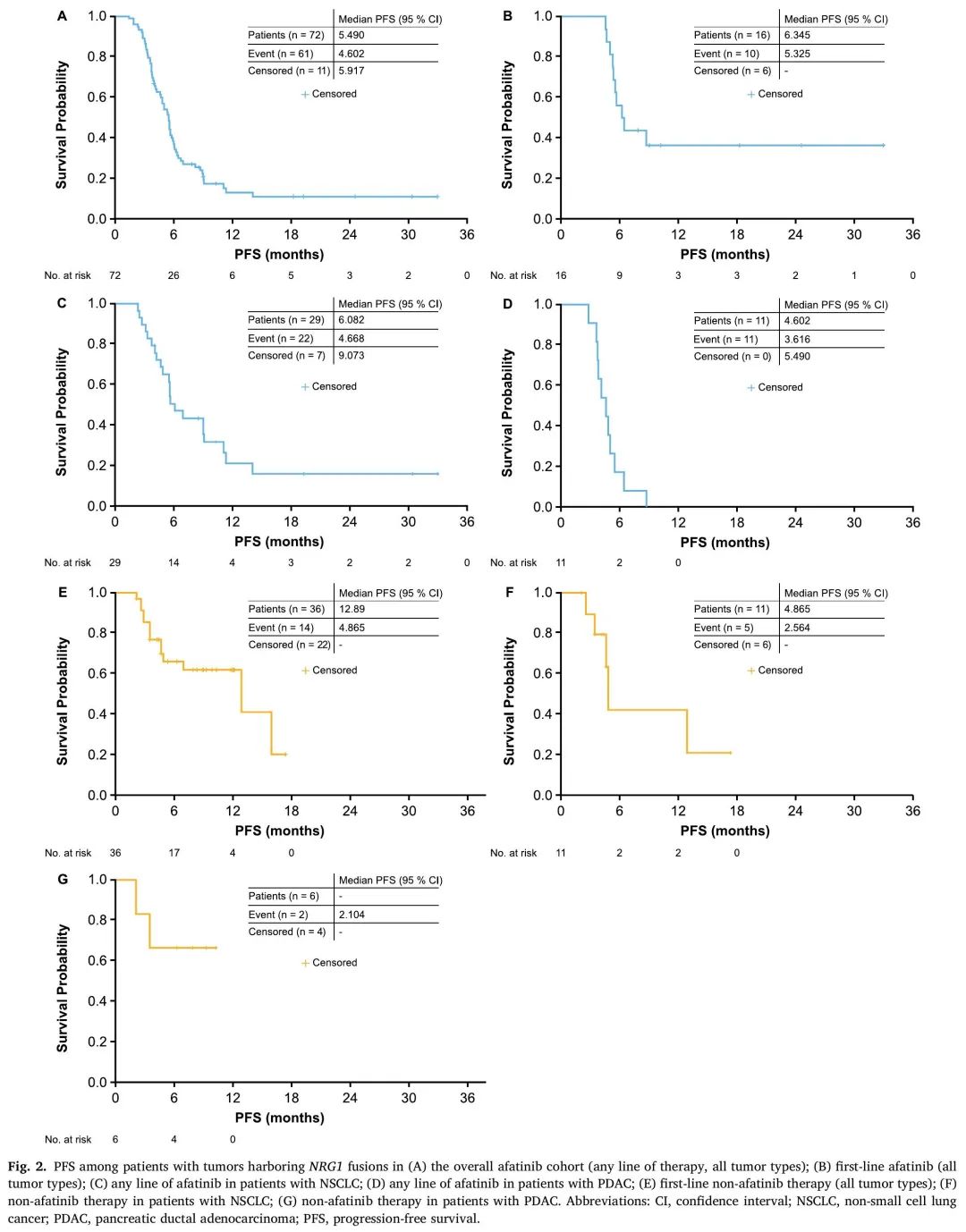
图2
在整个阿法替尼队列中,中位总生存期(OS)为7.2个月(95% CI:6.2-9.0)(表2);接受阿法替尼作为一线治疗的患者为9.9个月(95% CI:7.0-NR),接受阿法替尼作为二线治疗的患者为6.9个月(95% CI:5.3-9.0)(表2)。NSCLC(任何治疗阶段)患者的中位OS为9.9个月(95% CI:5.7-12.4),PDAC患者为6.9个月(95% CI:5.2-7.7)。
非阿法替尼队列的临床结局
38 例 NRG1 融合阳性癌症患者未接受阿法替尼治疗。在11例NSCLC患者中,index therapy的ORR为72.7%(8例PR),中位DOR为13.4个月(95% CI:9.0-13.4;表3),中位PFS为4.9个月(95% CI:2.6-NR;图2F),中位OS为22.6个月(95% CI:7.6-29.9)。在PDAC患者(n=6)中,ORR为66.7%(4例PR;中位DOR:NR;表3)。在膀胱癌(n = 2)、肾细胞癌(n = 1)和卵巢癌(n = 2)患者中观察到 CR。
安全性
总体而言,阿法替尼队列中报告的药物不良反应(ADR)与既往描述的一致。7例(9.7%)患者报告了index therapy期间腹泻(表4),所有这些都被认为与治疗相关。只有一例ADR导致治疗中断。
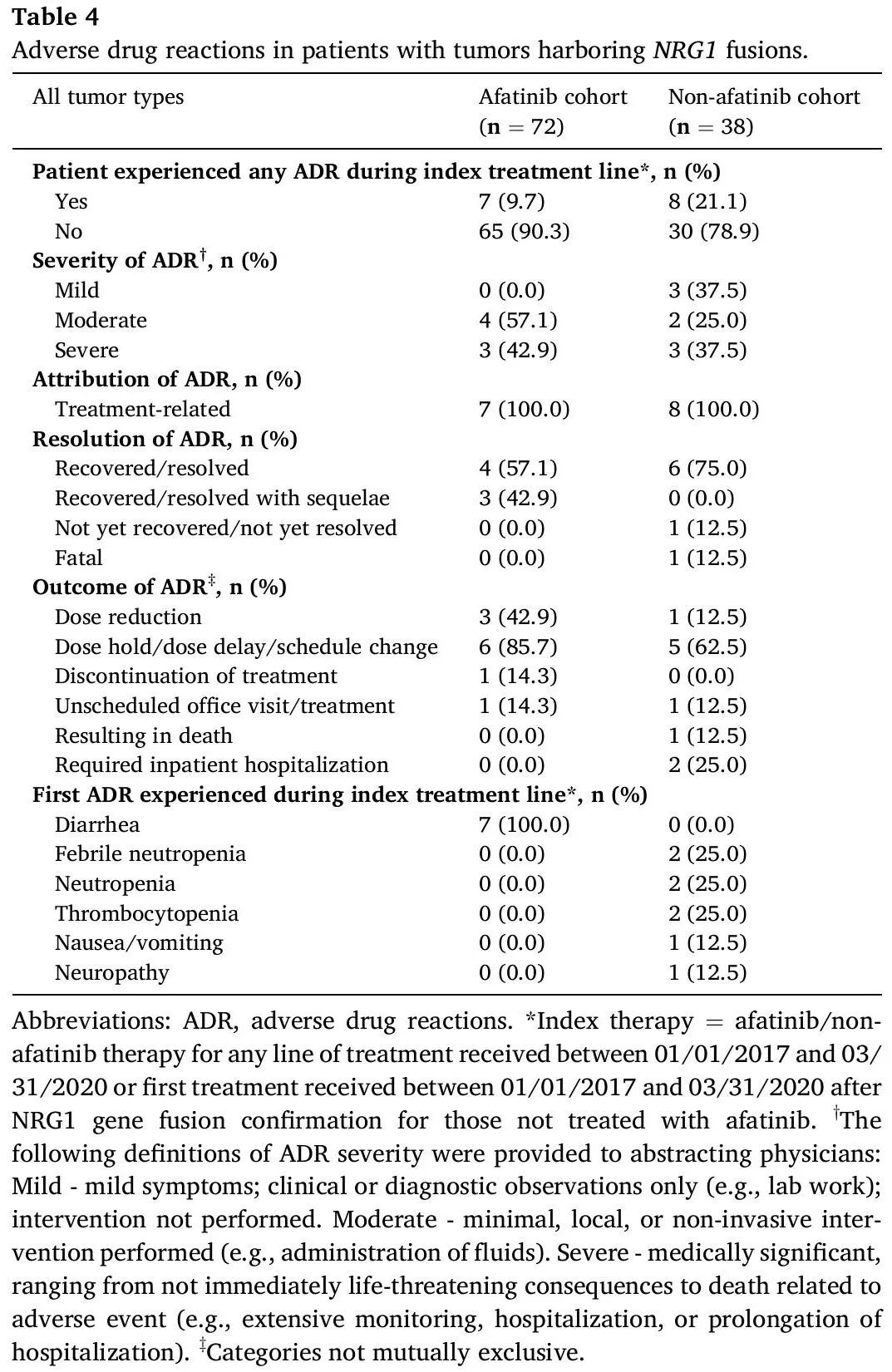
表4
讨 论
本研究提供了关于NRG1融合阳性实体瘤患者阿法替尼相关临床结局的真实世界数据。考虑到这些肿瘤的相对罕见性,本研究纳入的有临床结局的患者的数量较多。在NRG1融合阳性癌症患者中,阿法替尼治疗的ORR为37.5%,中位PFS为5.5个月。大多数患者接受阿法替尼作为二线治疗(70.8%),在index therapy开始时ECOG PS为2-4(69.4%)。目前,尚无已完成的阿法替尼治疗NRG1融合阳性肿瘤患者的前瞻性试验;数据仅限于病例报道和数据库,限制了比较。在eNRGy1全球多中心数据库的20例NRG1融合阳性NSCLC患者中,ORR为25%,中位PFS为2.8个月;显著低于本研究中的数据。有几篇关于阿法替尼治疗NRG1融合多种实体瘤患者的病例报道。本研究中的中位PFS和ORR略低于大多数病例报道。然而,这可能是由于病例报道倾向于报道对治疗反应良好或有趣的病例,而本研究包括所有接受阿法替尼治疗的NRG1融合患者。
本研究观察到,与用作二线治疗相比,阿法替尼用作一线治疗有结局可能较优的趋势。早期治疗的疾病缓解、持续时间和其他结局(如PFS)往往较好。既往的阿法替尼相关研究也发现了这一点,这可能是可以预期的,因为肿瘤获得的耐药途径随着治疗线数的增多而增加。然而,这强调了在开始治疗之前对患者肿瘤进行测序的好处(如果可能的话),以确保接受最佳的个体化治疗。
本研究中的高缓解率,特别是在非阿法替尼队列中,可能是由于肿瘤反应报告的性质。我们不要求根据标准指南,如RECIST v1.1经常用于临床试验,但很少用于临床实践,研究表明,医生倾向于高估反应。
为什么与非阿法替尼队列相比,阿法替尼队列的ECOG PS较差,且更有可能接受阿法替尼作为二线治疗,这值得思考。不幸的是,我们没有关于进行NRG1融合检测日期的信息。接受阿法替尼作为二线治疗的患者比例较高,提示医生可能仅在一线标准治疗失败后才考虑进行测序。我们知道,如果患者病情恶化或有症状,生物标志物检测出结果较晚可能导致医生在收到结果之前开始化疗。此外,与 EGFR 突变检测不同,NRG1 融合检测通常不是常规临床实践的一部分,并且需要NGS,通常使用基于 RNA 的测序方法。如果较虚弱的患者在一线化疗后进展,医生可能考虑测序来看是否可以找到下一轮化疗的替代方案。
本研究的优势在于相对较大的数据集、泛肿瘤性质和真实世界的设计。此外,该数据集中有较高比例的非裔美国患者,这一患者群体在临床试验中通常占比较低。本研究的局限性包括数据可能无法真正代表所有接受阿法替尼或其他全身疗法的NRG1融合患者。提供者自愿参与这项研究并选择符合标准的患者,可能导致偏倚。这对于设计未来旨在将阿法替尼与其他疗法进行比较的真实世界证据研究很重要。ADR可能被发现,但未包含在患者的病历中未报告。重要的是,本研究无法比较接受阿法替尼治疗的患者与接受其他全身疗法的患者之间的特征或结局,后者仅提供参考框架。
总之,这项纳入了接受阿法替尼或其他全身疗法的 NRG1 融合阳性肿瘤患者的大型回顾性队列研究提供了关于两个不同人群患者特征和临床结局的重要真实世界数据。阿法替尼治疗的结局明显良好,还报告了对其他标准疗法的临床反应。需要对NRG1融合驱动的肿瘤患者开展前瞻性临床试验,评估包括阿法替尼在内的不同疗法的疗效。
参考文献:
Liu SV, Frohn C, Minasi L, Fernamberg K, Klink AJ, Gajra A, Savill KMZ, Jonna S. Real-world outcomes associated with afatinib use in patients with solid tumors harboring NRG1 gene fusions. Lung Cancer. 2024 Feb;188:107469. doi: 10.1016/j.lungcan.2024.107469. Epub 2024 Jan 5. PMID: 38219288.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#实体瘤# #阿法替尼# #神经调节蛋白1#
82