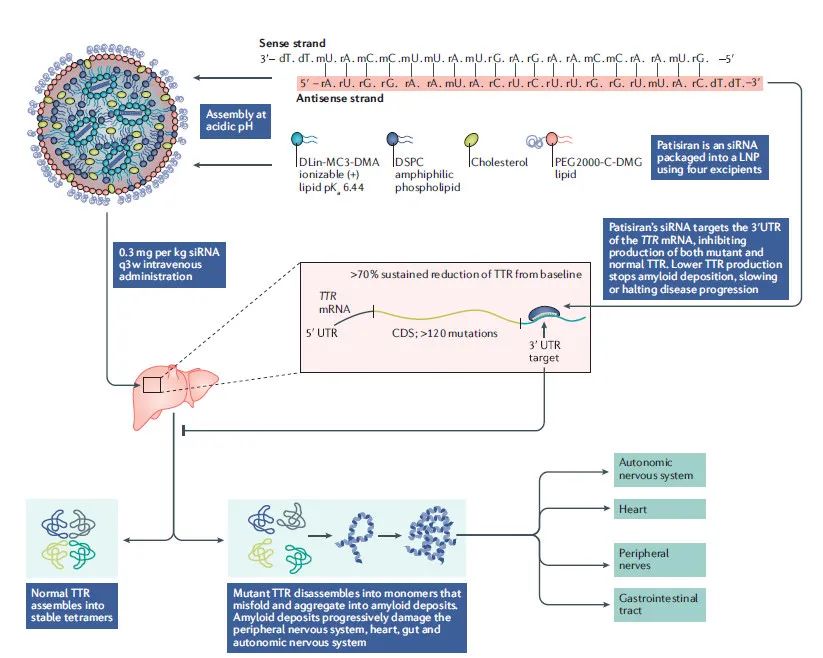
2022年最全汇总|美国FDA批准28款创新疗法,涉及肺癌、乳腺癌、肝癌、食管癌等
2023-01-03 厚朴方舟 厚朴方舟 发表于上海
2022年即将结束,美国FDA已经批准了28款抗癌新疗法,包括靶向,免疫检查点抑制剂,过继性细胞免疫疗法等等,覆盖了常见的十大实体瘤及血液肿瘤类型,为无数癌症患者带来了新的希望。
2022年即将结束,美国FDA已经批准了28款抗癌新疗法,包括靶向,免疫检查点抑制剂,过继性细胞免疫疗法等等,覆盖了常见的十大实体瘤及血液肿瘤类型,为无数癌症患者带来了新的希望。
美国批准28款创新疗法
-
全球首款BRAF V600E泛癌种疗法获批
-
不限癌种!RET抑制剂获批用于实体瘤患者
-
首款非小细胞肺癌新辅助疗法获批
-
首个HER2靶向疗法获FDA加速批准
-
Libtayo进军肺癌一线治疗
-
创新双免疫疗法一线治疗肺癌
-
首款辅助治疗早期乳腺癌靶向疗法
-
Enhertu二线治疗乳腺癌获批
-
首个HER2低表达乳腺癌靶向疗法诞生
-
肝癌首款一线双免疫联合方案获批
-
FGFR突变的胆管癌迎来新药
-
首款胆管癌免疫疗法获批
-
免疫联合疗法获批食管癌一线治疗
-
Keytruda单药方案获批用于子宫内膜癌
-
FRα阳性卵巢癌迎来新药
-
前列腺癌首款靶向放射配体疗法获批上市
-
靶向联合雄激素剥夺疗法获FDA批准
-
全球首个T细胞受体(TCR)疗法获批上市
-
全球首款LAG-3抗体疗法获批上市
-
急性髓细胞白血病靶向疗法获FDA批准
-
阿扎胞苷获批儿童白血病适应症
-
首款CAR-T疗法获批滤泡淋巴瘤
-
大B细胞淋巴瘤全球首款二线CAR-T疗法
-
大B细胞淋巴瘤第二款二线CAR-T疗法获批
-
儿童霍奇金淋巴瘤获批新药
-
Pemazyre获批FGFR1重排血液系统肿瘤
-
四线失败的骨髓瘤患者迎来新药
-
多发性骨髓瘤BCMA CAR-T疗法Carvykti
实体瘤
1.全球首款BRAF V600E泛癌种疗法获批
今年6月,美国FDA加速批准BRAF抑制剂Tafinlar(dabrafenib,达拉非尼)+MEK抑制剂Mekinist(trametinib,曲美替尼)的组合疗法,用于治疗接受前期疗法后疾病出现进展并且没有满意的替代治疗选择的,携带BRAF V600E的无法切除或转移性实体瘤成人和6岁以上儿科患者。
Tafinlar+Mekinist是首款获批不限癌种治疗BRAF V600E实体瘤的BRAF/MEK抑制剂,也是BRAF/MEK抑制剂首次获批用于儿科患者。

▲图源:参考来源[1]
2.不限癌种!RET抑制剂获批用于实体瘤患者
今年9月,美国FDA已加速批准Retevmo(selpercatinib)扩展适应症,不限癌种治疗携带RET基因融合的局部晚期或转移性实体瘤患者,包括肺癌、胰腺癌、结直肠癌等实体瘤。此外,美国FDA还授予Retevmo治疗RET基因融合的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的完全批准。

▲图源:参考来源[2]
非小细胞肺癌
3.首款非小细胞肺癌新辅助疗法获批
今年3月,美国FDA批准重磅PD-1抑制剂Oppo(nivolumab,纳武利尤单抗)与含铂双药化疗联用,作为新辅助疗法,治疗可切除非小细胞肺癌(NSCLC)患者,无论患者PD-L1表达情况如何。Oppo联合化疗是首款获批在手术前治疗非小细胞肺癌的免疫疗法组合。

▲图源:参考来源[3]
4.首个HER2靶向疗法获FDA加速批准
今年8月,美国FDA宣布抗体偶联药物(ADC)Enhertu(DS-8201,T-DXd)扩展适应症,用于治疗此前接受过一种系统性治疗的,携带激活性HER2突变的无法切除或转移性非小细胞肺癌(NSCLC)患者。Enhertu成为用于HER2突变非小细胞肺癌的首款药物。

▲图源:参考来源[4]
5.Libtayo进军肺癌一线治疗
今年11月,美国FDA已批准PD-1抑制剂Libtayo(cemiplimab rwlc)与铂类化疗联合用于晚期非小细胞肺癌(NSCLC)成人患者一线治疗。这些患者患有转移性或局部晚期肿瘤,不能进行手术切除或最终化疗,无ALK、EGFR或ROS1突变,且无论PD-L1表达水平或肿瘤组织学如何。

▲图源:参考来源[5]
6.创新双免疫疗法一线治疗肺癌
今年11月,美国FDA批准抗CTLA-4抗体Tremelimumab(Imjudo)与抗PD-L1单克隆抗体Durvalumab(Imfinzi,度伐利尤单抗)联合化疗构成的三重组合疗法,用于不携带表皮生长因子受体(EGFR)突变或间变性淋巴瘤激酶(ALK)融合的转移性非小细胞肺癌(NSCLC)成年患者。

▲图源:参考来源[6]
乳腺癌
7.首款辅助治疗早期乳腺癌靶向疗法
2022年3月,PARP抑制剂Lynparza(olaparib,奥拉帕利)已经获得美国FDA的批准,作为辅助疗法,治疗携带种系BRCA突变(gBRCAm)的高风险HER2阴性早期乳腺癌患者,成为首款在早期乳腺癌患者中靶向BRCA突变的获批疗法。

▲图源:参考来源[7]
8.Enhertu二线治疗乳腺癌获批
5月4日,美国FDA已经批准抗体偶联药物Enhertu(trastuzumab deruxtecan)用于治疗既往接受过一种抗HER2靶向疗法治疗的,无法切除或转移性HER2阳性乳腺癌患者[2]。
▲图源:参考来源[8]
9.首个HER2低表达乳腺癌靶向疗法诞生
8月5日,美国FDA批准 Enhertu (T-DXd,DS-8201)新适应症,用于治疗无法切除或转移性HER2低表达(HER2-low)乳腺癌患者,这是首个获批用于HER2低表达乳腺癌亚型患者的疗法。
▲图源:参考来源[9]
肝癌
10.肝癌首款一线双免疫联合方案获批
10月21日,抗CTLA-4抗体Imjudo(tremelimumab)已经获得美国FDA批准,与抗PD-L1抗体Imfinzi(durvalumab)联用,治疗不可切除的肝细胞癌患者,成为肝癌治疗领域的重要选择!
▲图源:参考来源[10]
胆管癌
11.FGFR突变的胆管癌迎来新药
今年10月,美国FDA已加速批准Lytgobi(futibatinib)上市,用于治疗携带FGFR2基因融合或其它重排的不可切除、局部晚期或转移性肝内胆管癌经治成人患者。
▲图源:参考来源[11]
12.首款胆管癌免疫疗法获批
美国FDA宣布,批准抗PD-L1抗体Imfinzi(durvalumab,度伐利尤单抗)与化疗联用,一线治疗局部晚期或转移性胆管癌(BTC),这是美国FDA批准的首款用于胆管癌的免疫疗法!

▲图源:参考来源[12]
食管癌
13.免疫联合疗法获批食管癌一线治疗
今年5月,美国FDA批准两种基于PD-1抑制剂Oppo的组合疗法:Oppo与含氟嘧啶和含铂化疗联用;Oppo与抗CTLA-4抗体Yervoy联用,作为一线疗法治疗晚期不可切除或转移性食管鳞状细胞癌。临床数据显示,两种Oppo联合疗法一线治疗食管癌均显著延长了患者的生存期[13]。
子宫内膜癌
14.Keytruda单药方案获批用于子宫内膜癌
2022年3月,美国FDA批准PD-1抑制剂Keytruda(pembrolizumab)单药治疗经FDA批准的检测发现肿瘤具有微卫星不稳定性高(MSI-H)或错配修复缺陷(dMMR)特征的晚期子宫内膜癌患者,为晚期子宫内膜癌患者带来重要选择。

▲图源:参考来源[14]
卵巢癌
15.FRα阳性卵巢癌迎来新药
今年11月,美国FDA已加速批准其靶向叶酸受体α(FRα)的抗体偶联药物(ADC)Elahere(mirvetuximab soravtansine)上市,作为单药疗法,治疗FRα高表达、对含铂疗法耐药的经治晚期卵巢癌患者。

▲图源:参考来源[15]
前列腺癌
16.前列腺癌首款靶向放射配体疗法获批上市
2022年3月,美国FDA已经批准靶向放射性配体疗法Pluvicto(曾用名177Lu-PSMA-617)上市,用于治疗:已经接受过基于紫杉烷的化疗和雄激素受体信号通路抑制剂治疗的前列腺特异性膜抗原(PSMA)阳性转移性去势抵抗性前列腺癌(mCRPC)患者。Pluvicto是首款FDA批准用于治疗这类转移性去势抵抗性前列腺癌患者的靶向放射配体疗法。

▲图源:参考来源[16]
17.靶向联合雄激素剥夺疗法获FDA批准
今年8月,美国FDA已批准口服雄激素受体抑制剂(ARi)Nubeqa (darolutamide,达罗他胺)联合多西他赛的补充新药申请(sNDA),用于转移性激素敏感性前列腺癌(mHSPC)患者的治疗,为前列腺癌患者提供了新的治疗方向。

▲图源:参考来源[17]
黑色素瘤
18.全球首个T细胞受体(TCR)疗法获批上市
2022年1月,美国食品和药物管理局(FDA)已批准Kimmtrak(tebentafusp-tebn,IMCgp100):用于治疗HLA-A*02:01阳性不可切除性或转移性葡萄膜黑色素瘤(mUM)成人患者。
Kimmtrak是一种新型T细胞受体(TCR)双特异性免疫疗法,开创了多个第一:①第一个获得FDA监管批准的TCR疗法;②第一个获得FDA监管批准治疗实体瘤的双特异性T细胞接合器;③第一个也是唯一一个获得FDA批准治疗不可切除性或转移性mUM的疗法。

▲图源:参考来源[18]
19.全球首款LAG-3抗体疗法获批上市
3月,FDA批准由固定剂量的抗LAG-3抗体药物Relatlimab与抗PD-1抗体Oppo(nivolumab)联合组成的 “first-in-class”疗法Opdualag,治疗罹患不可切除或转移性黑色素瘤的成人和儿童(12岁及以上)患者。Relatlimab是FDA批准的首款LAG-3抗体,也是近十年来针对全新免疫检查点获批的首款创新癌症免疫疗法。

▲图源:参考来源[19]
血液系统肿瘤
20.急性髓细胞白血病靶向疗法获FDA批准
今年5月美国FDA已批准IDH1抑制剂Tibsovo(ivosidenib )与阿扎胞苷联用,一线治疗年龄超过75岁,或由于合并症无法接受强力诱导化疗的携带IDH1突变的急性髓细胞白血病(AML)患者。
21.阿扎胞苷获批儿童白血病适应症
今年5月,,美国食品药品监督管理局(FDA)批准阿扎胞苷(注射用阿扎胞苷,维达莎,5-氮杂胞苷,Vidaza,Azacitidine)用于治疗新诊断的幼年型粒单核细胞白血病(JMML)儿科患者。
22.首款CAR-T疗法获批滤泡淋巴瘤
2022年5月,美国食品和药物管理局(FDA)已加速批准CD19 CAR-T细胞疗法Kymriah(tisagenlecleucel):用于治疗先前接受过二线或多线系统治疗的复发或难治性滤泡性淋巴瘤(r/r FL)成人患者。
23.大B细胞淋巴瘤全球首款二线CAR-T疗法
今年4月,FDA批准CAR-T细胞治疗药品Yescarta用于一线化疗免疫疗法难治或一线化疗免疫疗法后12个月内复发的大B细胞淋巴瘤(LBCL)成年患者。这也是全球首款获得FDA批准作为LBCL二线疗法的CAR-T药物。
24.大B细胞淋巴瘤第二款二线CAR-T疗法获批
今年6月,FDA批准了Breyanzi(lisocabtagene maraleucel,liso-cel),用于成人大 B 细胞淋巴瘤患者的二线治疗(包括弥漫性大 B 细胞淋巴瘤、高级别 B 细胞淋巴瘤、原发性纵隔大 B 细胞淋巴瘤和滤泡性淋巴瘤淋巴瘤 3B 级)。
25.儿童霍奇金淋巴瘤获批新药
今年11月,FDA批准 brentuximab vedotin (Adcetris) 联合多柔比星、长春新碱、依托泊苷、泼尼松和环磷酰胺用于 2 岁及以上既往未经治疗的高危经典儿科患者霍奇金淋巴瘤 (cHL)。这是Adcetris首次获批儿童适应症。
26.Pemazyre获批FGFR1重排血液系统肿瘤
今年8月,美国食品药品监督管理局批准 Pemazyre(pemigatinib,Incyte Corporation,培米替尼)用于患有成纤维细胞生长因子受体 1(FGFR1)重排的复发或难治性髓系/淋巴系(MLN)成人血液系统肿瘤。
27.四线失败的骨髓瘤患者迎来新药
今年10月,FDA批准 teclistamab-cqyv(Tecvayli)用于之前至少接受过四种治疗复发性或难治性多发性骨髓瘤,这是首款双特异性 B 细胞成熟抗原 (BCMA) 定向 CD3 T 细胞接合剂。
28.多发性骨髓瘤BCMA CAR-T疗法Carvykti
2022年2月,BCMA CAR-T疗法Carvykti(ciltacabtagene autoleucel,简称Cilta-cel)获得美国FDA批准上市, 用于治疗复发或难治性多发性骨髓瘤患者,这些患者既往接受过四种或四种以上的治疗,包括蛋白酶体抑制剂、免疫调节剂和抗CD38单克隆抗体。
总而言之,多款药物的出现,有望为癌症患者提供新的治疗方向,让更多癌症患者受益。
参考来源:
[1]Novartis Tafinlar + Mekinist receives FDA approval for
https://www.globenewswire.com/news-release/2022/06/22/2467557/0/en/Novartis-Tafinlar-Mekinist-receives-FDA-approval-for-first-tumor-agnostic-indication-for-BRAF-V600E-solid-tumors.html
[2]FDA Approves Lilly's Retevmo:registered: (selpercatinib), the First and Only RET Inhibitor for Adults with Advanced or Metastatic Solid Tumors with a RET Gene Fusion, Regardless of Type
https://www.prnewswire.com/news-releases/fda-approves-lillys-retevmo-selpercatinib-the-first-and-only-ret-inhibitor-for-adults-with-advanced-or-metastatic-solid-tumors-with-a-ret-gene-fusion-regardless-of-type-301630358.html
[3]U.S. Food and Drug Administration Approves Oppo:registered: (nivolumab) with Chemotherapy as Neoadjuvant Treatment for Certain Adult Patients with Resectable Non-Small Cell Lung Cancer | Business Wire https://www.businesswire.com/news/home/20220301006264/en
[4]FDA grants accelerated approval to fam-trastuzumab deruxtecan-nxki for HER2-mutant non-small cell lung cancer | FDA
https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-fam-trastuzumab-deruxtecan-nxki-her2-mutant-non-small-cell-lung?utm_medium=email&utm_source=govdelivery
[5]Libtayo:registered: (cemiplimab-rwlc) in Combination with Chemotherapy Approved by the FDA as First-line Treatment for Advanced Non-small Cell Lung Cancer (NSCLC)
https://www.prnewswire.com/news-releases/libtayo-cemiplimab-rwlc-in-combination-with-chemotherapy-approved-by-the-fda-as-first-line-treatment-for-advanced-non-small-cell-lung-cancer-nsclc-301672231.html
[6]FDA approves tremelimumab in combination with durvalumab and platinum-based chemotherapy for metastatic non-small cell lung cancer | FDA
https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-tremelimumab-combination-durvalumab-and-platinum-based-chemotherapy-metastatic-non
[7] Lynparza approved in the US as adjuvant treatment for patients with germline BRCA-mutated HER2-negative high-risk early breast cancer
https://www.astrazeneca.com/content/astraz/media-centre/press-releases/2022/lynparza-approved-in-the-us-as-adjuvant-treatment-for-patients-with-germline-brca-mutated-her2-negative-high-risk-early-breast-cancer.html
[8]FDA grants regular approval to fam-trastuzumab deruxtecan-nxki for breast cancer | FDA
https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-regular-approval-fam-trastuzumab-deruxtecan-nxki-breast-cancer
[9]FDA Approves First Targeted Therapy for HER2-Low Breast Cancer | FDA
https://www.fda.gov/news-events/press-announcements/fda-approves-first-targeted-therapy-her2-low-breast-cancer
[10]Novel Drug Approvals for 2022 | FDA
https://www.fda.gov/drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products/novel-drug-approvals-2022
[11]FDA Approves Taiho's LYTGOBI:registered: (futibatinib) Tablets for Previously Treated, Unresectable, Locally Advanced or Metastatic Intrahepatic Cholangiocarcinoma
https://www.prnewswire.com/news-releases/fda-approves-taihos-lytgobi-futibatinib-tablets-for-previously-treated-unresectable-locally-advanced-or-metastatic-intrahepatic-cholangiocarcinoma-301638254.html
[12]FDA approves durvalumab for locally advanced or metastatic biliary tract cancer | FDA
https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-durvalumab-locally-advanced-or-metastatic-biliary-tract-cancer?utm_medium=email&utm_source=govdelivery
[13] Bristol Myers Squibb - U.S. Food and Drug Administration Approves Two Oppo:registered: (nivolumab)-Based Regimens as First-Line Treatments for Unresectable Advanced or Metastatic Esophageal Squamous Cell Carcinoma
https://investors.bms.com/iframes/press-releases/press-release-details/2022/U.S.-Food-and-Drug-Administration-Approves-Two-Oppo-nivolumab-Based-Regimens-as-First-Line-Treatments-for-Unresectable-Advanced-or-Metastatic-Esophageal-Squamous-Cell-Carcinoma/default.aspx
[14] FDA approves pembrolizumab for advanced endometrial carcinoma | FDA
https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-pembrolizumab-advanced-endometrial-carcinoma
[15]ImmunoGen Announces FDA Accelerated Approval of ELAHERE:trade_mark: (mirvetuximab soravtansine-gynx) for the Treatment of Platinum-Resistant Ovarian Cancer | Business Wire
https://www.businesswire.com/news/home/20221104005657/en
[16] FDA approves Pluvicto for metastatic castration-resistant prostate cancer | FDA
https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-pluvicto-metastatic-castration-resistant-prostate-cancer
[17]U.S. FDA approves additional indication of darolutamide in combination with docetaxel for the treatment of metastatic hormone-sensitive prostate cancer (mHSPC) - Bayer News
https://media.bayer.de/baynews/baynews.nsf/id/US-FDA-approves-additional-indication-darolutamide-combination-docetaxel-treatment-metastatic?OpenDocument&sessionID=1660012395
[18]Immunocore announces FDA approval of KIMMTRAK:registered:
https://www.globenewswire.com/news-release/2022/01/26/2373344/0/en/Immunocore-announces-FDA-approval-of-KIMMTRAK-tebentafusp-tebn-for-the-treatment-of-unresectable-or-metastatic-uveal-melanoma.html
[19]FDA Approves Relatlimab Plus Nivolumab for Unresectable or Metastatic Melanoma
https://www.onclive.com/view/fda-approves-relatlimab-plus-nivolumab-for-unresectable-or-metastatic-melanoma
[20]Servier Announces FDA Approval of TIBSOVO:registered: (ivosidenib tablets) in Combination with Azacitidine for Patients with Newly Diagnosed IDH1-mutated Acute Myeloid Leukemia
https://www.prnewswire.com/news-releases/servier-announces-fda-approval-of-tibsovo-ivosidenib-tablets-in-combination-with-azacitidine-for-patients-with-newly-diagnosed-idh1-mutated-acute-myeloid-leukemia-301555363.html
[21]FDA Approves Azacitidine for Newly Diagnosed Juvenile Myelomonocytic Leukemia
https://www.targetedonc.com/view/fda-approves-azacitidine-for-newly-diagnosed-juvenile-myelomonocytic-leukemia
[22]FDA approves Novartis Kymriah:registered: CAR-T cell therapy for adult patients with relapsed or refractory follicular lymphoma | Novartis
https://www.novartis.com/news/media-releases/fda-approves-novartis-kymriah-car-t-cell-therapy-adult-patients-relapsed-or-refractory-follicular-lymphoma
[23]FDA approves ciltacabtagene autoleucel for relapsed or refractory multiple myeloma | FDA
https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-ciltacabtagene-autoleucel-relapsed-or-refractory-multiple-myeloma
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言