Trop2 ADC药物戈沙妥珠单抗治疗肺癌III期临床获成功(TROPiCS-02研究)
2023-07-08 找药宝典 找药宝典 发表于上海
TROPiCS-02研究是一项全球、多中心、开放标签的III期研究,543例患者按1:1的比例随机分组,接受SG(第1、8天静脉注射,10mg/kg,周期为21天)或医生选择治疗(TPC,艾立布林、卡
ADC作为一种备受关注的新型抗体药物,其开发数量呈爆发式增长。除了经典热门靶点HER2,Trop 2成为了ADC产品上市的第二个热点。全球范围内,对Trop 2药物的研发正在蓬勃发展。Trodelvy是近年来备受瞩目的产品之一,而阿斯利康/第一三共的DS-1062同样在快速推进。此外,阿斯利康/第一三共公司拥有强大的ADC平台,早已在DS-8201中得到了展示。
正在研发的Trop2 ADC(图片来源于药研网)
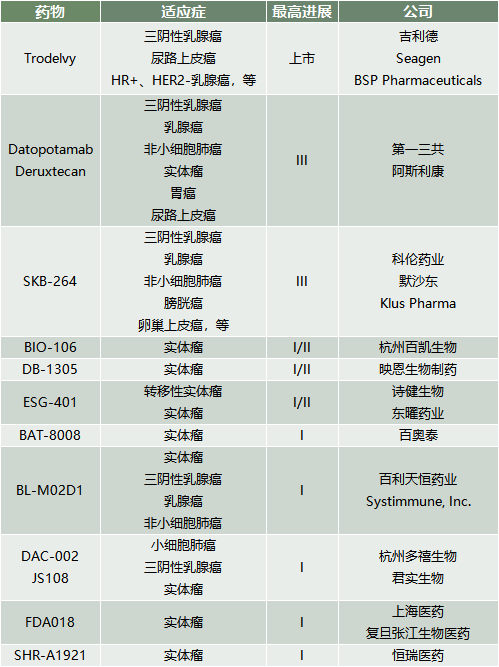
全球首个TROP2 ADC戈沙妥珠单抗(Sacituzumab govitecan,Trodelvy,SG)继ASCENT研究开创了ADC药物治疗三阴性乳腺癌的先河,在今年2月再获FDA批准用于治疗HR+/HER2-的不可切除或转移性乳腺癌,这些患者曾接受过内分泌疗法与额外至少2线系统性治疗。基于在TROPiCS-02研究的亮眼表现,SG此次获批极大地拓展了应用范围。
TROPiCS-02研究是一项全球、多中心、开放标签的III期研究,543例患者按1:1的比例随机分组,接受SG(第1、8天静脉注射,10mg/kg,周期为21天)或医生选择治疗(TPC,艾立布林、卡培他滨、吉西他滨、长春瑞滨),直到疾病进展或出现不可接受的毒性。这些HR+/HER2- mBC患者曾接受内分泌治疗、CDK4/6抑制剂和2-4线化疗的方案。
主要终点是无进展生存期(PFS),次要终点包括总生存期(OS)、客观缓解率(ORR)、临床获益率(CBR)和缓解持续时间(DOR),以及安全性、耐受性等。
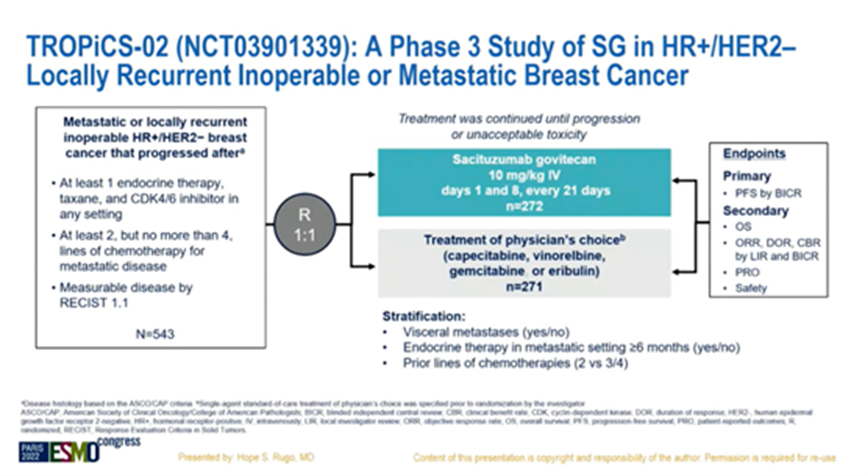
在2022年ASCO会议上公布的PFS结果显示,SG较TPC显著延长PFS,两组中位PFS为5.5 vs 4.0个月(HR=0.66,P=0.0003)。在所有标志性时间点存活且无进展的患者比例均较高,SG治疗组1年无进展的患者比例是TPC治疗组的3倍(21% vs 7%)。
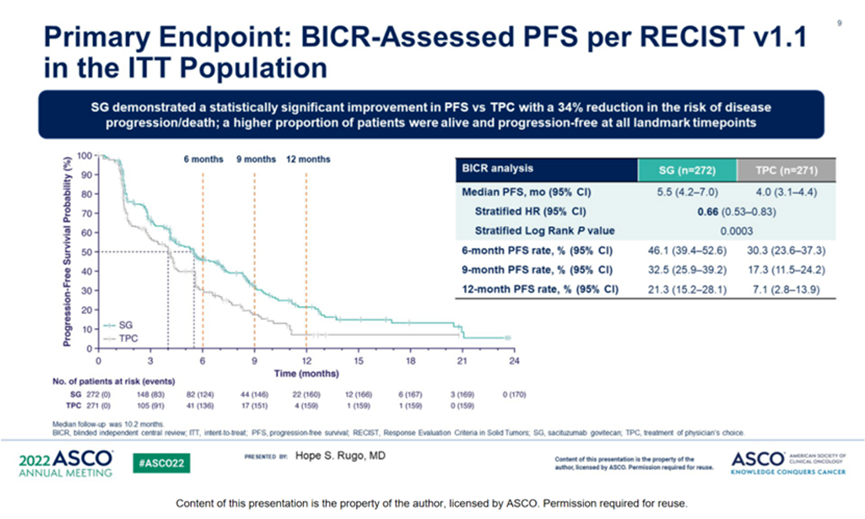
在2023年ASCO会议上公布的最终OS分析也证实了在经过预处理的内分泌耐药 HR+/HER2-mBC 患者中,SG 优于单药 CT 具有临床意义的 OS 益处(中位OS :14.5 vs 11.2 个月;HR=0.79 ;95% CI,0.65-0.95)。
Datopotamab deruxtecan
第一三共和阿斯利康合作开发DS-1062也是一种以Trop2为靶点的ADC,用于治疗转移性乳腺癌和转移性非小细胞肺癌。
2023年7月3日,阿斯利康/第一三共宣布Trop2 ADC新药Datopotamab deruxtecan治疗非小细胞肺癌III期临床中期分析最新结果,TROPION-Lung01设置了PFS、OS两个主要终点,中期分析达到了PFS主要终点,Trop2 ADC相比多西他赛治疗组有改善。但研究OS数据不成熟,OS没有达到统计学显著改善,需要继续观察以评估最终OS数据。安全性方面,与之前的安全性信号一致。具体数据将在即将召开的医学会议上公布。
此外,在 NSCLC 领域 Dato-DXd 也在探索与免疫检查点抑制剂联用的疗效。今年ASCO年会上公布了 Ib 期临床 TROPION-Lung02 研究最新结果,进一步证实了Dato-DXd联合帕博利珠单抗±铂类化疗在初治或经治且无可靶向基因组改变的晚期NSCLC患者中的显著疗效和良好安全性。
研究结果显示,在一线治疗人群中,双联组的ORR为50%,其中15例为经确认的部分缓解(PR),2例为未经确认的PR;三联组的ORR为57%,其中1例为经确认的完全缓解(CR),29例为经确认的PR。此外,双联组和三联组的DCR均为91%,中位DoR均尚未达到。
在总人群中,双联组的ORR为38%,三联组ORR为49%。两组DCR分别为84%和87%;中位PFS分别为8.3个月和7.8个月,但数据尚未成熟。
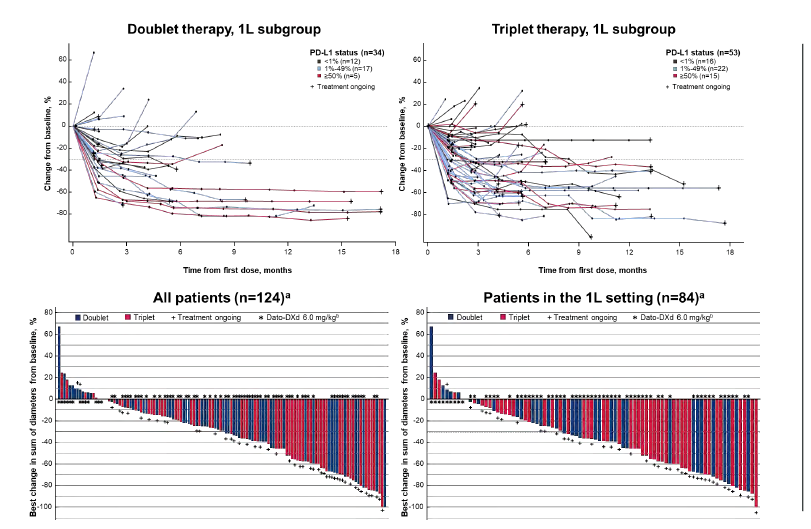
Dato-DXd当前有7 项 III 期临床试验进行中,分布在肺癌和乳腺癌领域。TROPION-Lung01针对2-3线NSCLC,这将是Dato-DXd的首发适应症;TROPION-Lung07和08联用K药,分别用于PD-L1表达低于50%和高于 50% NSCLC患者的一线治疗;AVANZAR则联用 PD-L1 度伐利尤单抗(Imfinzi)头对头 K 药。
SKB264
SKB264是由科伦博泰研发的一款靶向TROP2的创新ADC,由靶向TROP-2的人源化单克隆抗体、可酶促裂解的Linker连接着新型拓扑异构酶I抑制剂组合而成。SKB264是靶向Trop-2进展最快的国产ADC,近期获NMPA药品审评中心(CDE)拟纳入突破性治疗品种公示,用于既往接受过至少二线系统化疗的局部晚期或转移性激素受体阳性(HR+)和人表皮生长因子受体2阴性(HER2-)的乳腺癌患者。此前,SKB264已获得2项突破性疗法认定,分别用于治疗局部晚期或转移性TNBC、EGFR-TKI治疗失败的局部晚期或转移性EGFR突变NSCLC。不到1年,SKB264针对肺癌和乳腺癌两大癌种,即将斩获第3项突破性疗法认定。
2023年ASCO年会上以壁报形式公布了用于经治的局部晚期或转移性非小细胞肺癌(NSCLC)患者的Ⅱ期拓展研究数据。SKB264展示出卓有前景的疗效和可控的安全性。
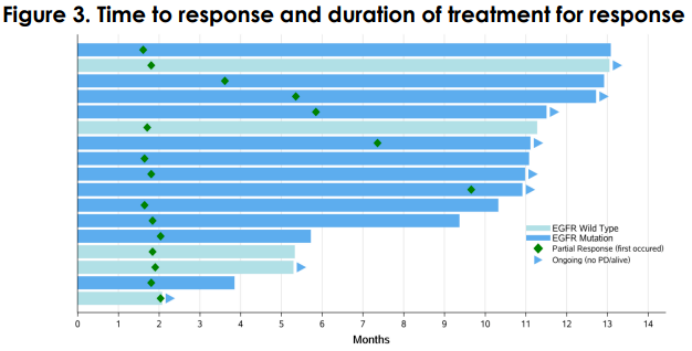
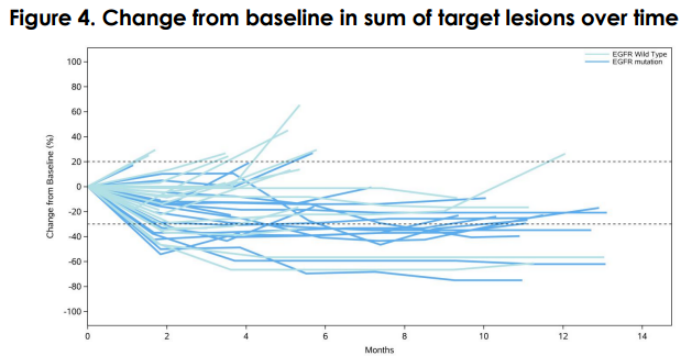
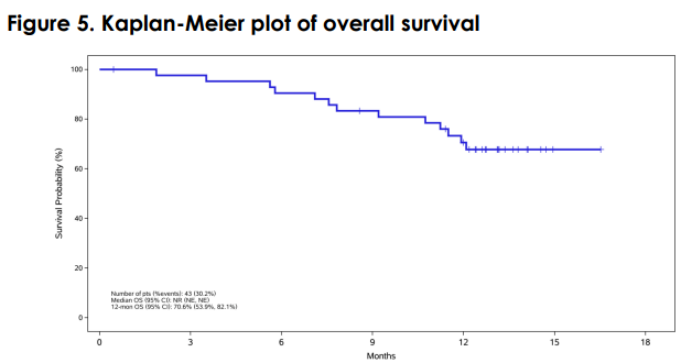
这是一项针对复发或难治性局部晚期/转移性 NSCLC 和其他肿瘤类型患者的 I/II 期多中心剂量递增/扩展研究 (NCT04152499)。所有 NSCLC 患者都接受了 5 mg/kg IV Q2W 剂量的 SKB264。数据截至2023年2月9日,中位随访时间为11.5个月。
在 39 名反应可评估的患者中,ORR 为 44%(17/39),中位 DoR 为 9.3 个月,6 个月 DoR 率为 77%。对于 EGFR 野生型亚组(之前接受过中位 2 线治疗,包括抗 PD-1/L1),ORR 为 26% (5/19),DCR 为 89% (17/19),中位 PFS 为 5.3 个月, 9个月OS率为80.4%。对于 TKI 耐药的 EGFR 突变 NSCLC 亚组(50% 也至少接受了一种化疗失败),ORR 为 60% (12/20),DCR 为 100% (20/20),中位 PFS 为 11.1 个月,9月PFS率为66.7%。
67.4% (29/43) 的患者有 ≥ 3 级的治疗相关不良事件 (TRAE)。最常见的 ≥ 3 级 TRAE(发生在 ≥ 5% 的患者中)是中性粒细胞计数减少 (32.6%)、贫血 (30.2%)、白细胞计数 (WBC) 减少 (23.3%)、口腔炎 (9.3%)、皮疹 (7.0%),淋巴细胞计数减少 (7.0%)。4 级 TRAE 仅发生在中性粒细胞减少和 WBC 减少的情况下。23.3% (10/43) 的患者因 TRAE 而经历剂量减少。没有神经病变或药物相关的间质性肺病/肺炎的报道。没有 TRAE 导致治疗中断或死亡。
BIO-106
百凯医药用其专有的TAMTM有效载荷技术开发了BIO-106,以实现均匀的高载药量,使BIO-106具有更佳的治疗窗口和安全性。百凯医药拥有BIO-106包括Trop-2抗体和Payload的全部国际自主知识产权。
2022年4月, BIO-106 I期临床试验申请(IND)获得了FDA的批准,这项临床研究称为StarBridge-1,是一项I / II期,多中心,开放标签研究,旨在评估BIO-106作为单一疗法以及与帕博利珠单抗联合用于晚期癌症患者的安全性,药代动力学和初步抗肿瘤活性(NCT05320588)。
DB-1305
DB-1305是由映恩生物制药(苏州)有限公司研发的,于2022年6月进入临床I/II期研究(NCT05438329)。
DB-1305是通过酶促切割的四肽接头将抗Trop-2抗体与新型拓扑异构酶I抑制剂P1021偶联而成的靶向ADC。在体外,DB-1305选择性地结合Trop-2阳性细胞并被内吞,呈现浓度依赖性细胞毒性。
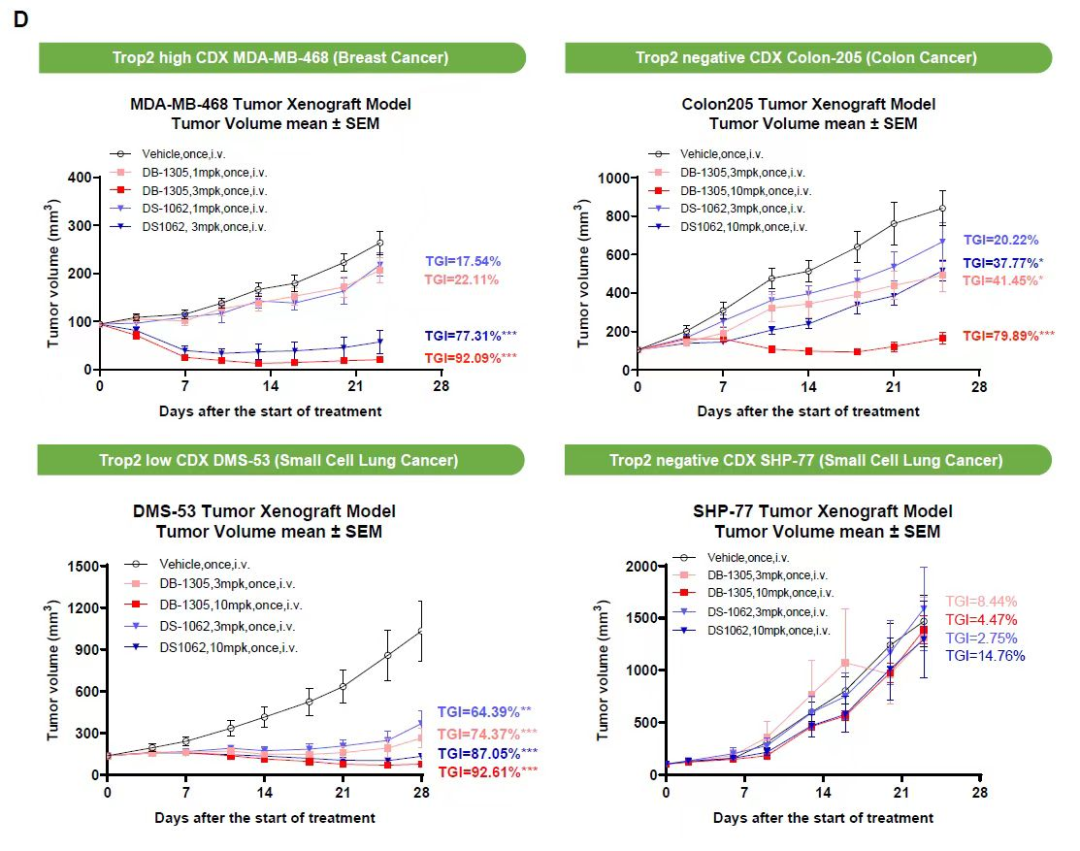
在体内,DB-1305在乳腺癌(MDA-MB-468)、结肠癌(COLO205)和肺癌(DMS-53)的小鼠模型中显示出强大的抗肿瘤活性,相对于DS-1062疗效显著提高。DB-1305和载荷P1021的暴露水平在猴子和大鼠中没有明显的性别差异,也没有明显的蓄积。在食蟹猴GLP毒性研究中具有良好的耐受性,最高非重度毒性剂量(HNSTD)为80 mg/kg,也显著高于DS-1062的30 mg/kg的HNSTD。
ESG-401
ESG401是由诗健生物和联宁生物共同开发一种创新型ADC,由人源化抗 Trop2 IgG1单克隆抗体通过专有的稳定可裂解接头与拓扑异构酶I抑制剂SN-38 偶联组成,于2021年7月21日在国内获批临床。
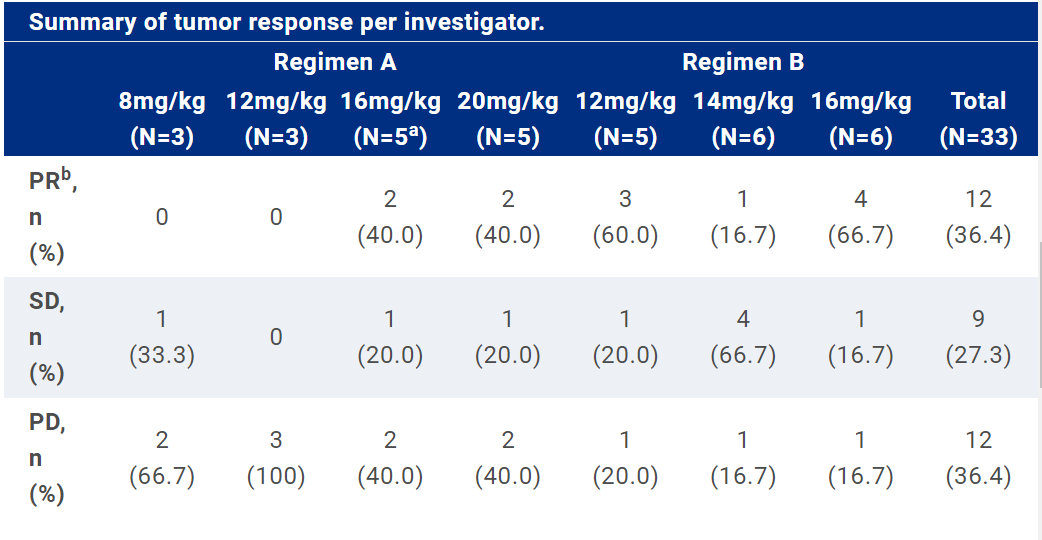
今年ASCO会议上诗健生物报告了ESG-401首次在人体研究中获得的初步研究数据:在33例疗效可评估的受试者中,12例受试者达到PR,ORR为36.4%,9例受试者达到SD(其中4例受试者达到持续≥24周的SD),DCR为63.6%。此外,最高剂量组的ORR为66.7%,DCR为83.3%;有效剂量TNBC患者的 ORR为36.3%,DCR为63.6%;有效剂量HR+/HER2-BC患者的 ORR为61.5%,DCR为76.9%。
与研究药物相关的不良事件(TRAEs)发生率为94.3%(33/35),3级及以上TRAEs发生率为34.3%(12/35)。最常见的≥3级TRAEs(≥10%)是中性粒细胞计数降低、白细胞计数降低。初步研究结果显示ESG401的安全性很好,不良反应谱有优势,受试者可以进行长期治疗。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#戈沙妥珠单抗#治疗#肺癌#
0