礼来的双抗体鸡尾酒疗法三期临床试验获得重要进展
2021-03-10 JACKZHAO MedSci原创
据美国CNBC报道,礼来公司组合抗体药物在3期临床试验中治疗Covid-19产生了更积极的结果。 在对750多例高危患者的研究中,发现该治疗剂可将住院和死亡的风险降低87%。最新研究发现,较低的剂量可

3月10日,礼来公司发布新闻稿称,其治疗新冠组合抗体药物在3期临床试验中治疗Covid-19产生了更积极的结果。 在对750多例高危患者的研究中,发现该治疗剂可将住院和死亡的风险降低87%。最新研究发现,较低的剂量可产生更好的效果。2月份,该组合药物获得了美国FDA的紧急使用授权。

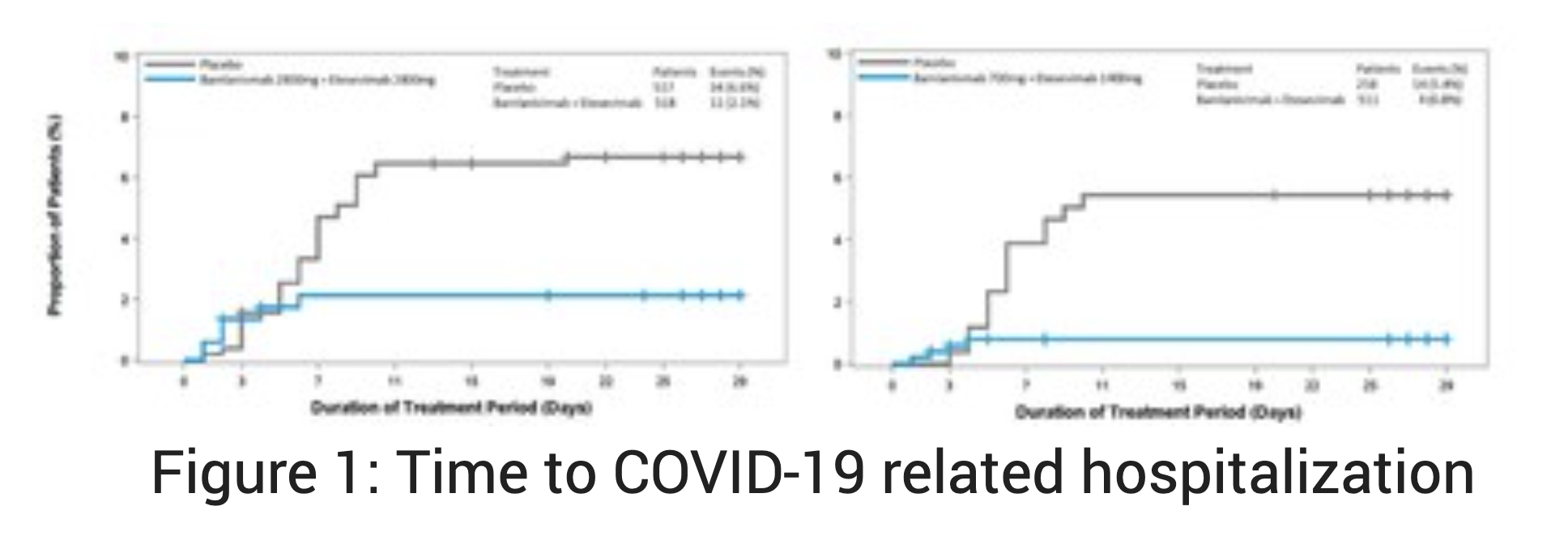
这是一项来自随机,双盲,安慰剂对照的BLAZE-1 3期研究的新数据,证明了700毫克的bamlanivimab(LY-CoV555)和1400毫克的etesevimab(LY-CoV016)在最近被诊断为COVID-19的高危患者中,可显著降低与COVID-19相关的住院和死亡(“事件”)。这些结果提供了额外的功效和安全性数据,这些数据支持美国FDA最近授予的紧急使用授权以及欧洲药品管理局(EMA)的人类用药产品委员会的肯定科学意见的使用使用(CHMP)。
BLAZE-1的这一新的第三阶段队列包括769名12岁及以上的轻度至中度COVID-19的高危患者(治疗:n = 511;安慰剂:n = 258)。服用Bamlanivimab和etesevimab的患者发生了4次事件,而使用安慰剂的患者发生了15次事件,这意味着降低了87%的风险(p <0.0001)。 Bamlanivimab和etesevimab一起还显示出关键的次要终点在统计学上有显着改善。这些结果与从BLAZE-1的其他数据集中看到的结果一致:在先前的第3阶段队列中,bamlanivimab 2800 mg和etesevimab 2800 mg将住院和死亡的风险降低了70%,在第2阶段队列中,仅bamlanivimab减少了住院和急诊就诊的风险大约降低了70%。病毒载量的减少也与先前在该研究的第三阶段队列中观察到的一致。
在这个新的3期研究队列中,共有4例死亡,所有死亡均被认为与COVID-19相关,所有死亡均发生在服用安慰剂的患者中。联合接受bamlanivimab和etesevimab治疗的患者未发生死亡。迄今为止,在研究的两个三期研究队列中,接受bamlanivimab和etesevimab治疗的患者均无死亡,接受安慰剂的患者中有14例死亡,其中13例被认为与COVID-19相关。在该数据集中,bamlanivimab和etesevimab的安全性特征与其他评估这些抗体的1期,2期和3期试验的观察结果一致。
礼来公司首席科学官兼礼来研究实验室总裁Daniel Skovronsky说,“这些积极的结果加强了我们以前的发现,并支持700毫克班兰尼单抗和1400毫克依替昔单抗的授权剂量。这些令人信服的数据–除了FDA最近的EUA,EMA的CHMP决定以及美国国家研究所的治疗建议的《 COVID-19治疗指南》 –为医疗服务提供者提供更多有关将bamlanivimab和etesevimab联合使用作为可能挽救生命的治疗方法的信息,以帮助那些最有可能发生严重COVID-19严重并发症的人。 即使在新的新冠变异毒株出现后的几个月里,该试验在多个队列中观察到的一致结果也表明,bamlanivimab和etesevimab联合使用仍可抵抗多种变异,尤其是在美国流行的变异。
礼来公司将把bamlanivimab和etesevimab在世界范围内销售。在大流行的背景下,在美国和欧盟,Bamlanivimab单独使用和bamlanivimab联合依替昔单抗一起在特殊/紧急情况下得到授权。此外,单独的bamlanivimab获准在加拿大,巴拿马,科威特,阿联酋,以色列,卢旺达,摩洛哥和许多其他国家紧急使用。
严重COVID-19患者的获益和潜在风险的局限性,对于因COVID-19而住院的患者,尚无研究使用bamlanivimab和etesevimab共同治疗。由于COVID-19,在住院的患者中尚未观察到单独使用bamlanivimab的治疗益处。当对住院的COVID-19患者需要高流量氧气或机械通气时,单克隆抗体(如bamlanivimab和etesevimab)可能会导致较差的临床结果。
根据BLAZE-1的第2阶段数据,恶心是最常见的不良事件,在bamlanivimab和etesevimab以及安慰剂组中,有4%的受试者报告了恶心。与安慰剂(分别为1%和0%)相比,接受bamlanivimab和etesevimab(分别为2%和1%)治疗的受试者出现瘙痒和发热的情况更为频繁。
根据BLAZE-1的第3阶段数据,最常见的不良事件是恶心,头晕和皮疹。这些事件各自发生在1%接受bamlanivimab和etesevimab共同治疗的受试者中,以及1%的安慰剂受试者。
单独的bamlanivimab单抗,至少有1%的BLAZE-1临床试验参与者单独使用700 mg班兰尼单抗或安慰剂时报告的不良反应为恶心(3%对4%),腹泻(1%对5%),头晕(3%对2%),头痛(3%对2%),瘙痒(2%对1%)和呕吐(1%对3%)。
在特定人群中使用,孕妇在妊娠期间并用bamlanivimab和etesevimab以及单独使用bamlanivimab的数据不足。只有在潜在的益处大于对母亲和胎儿的潜在风险时,才应在妊娠期间一起使用Bamlanivimab和etesevimab以及单独使用bamlanivimab。
关于哺乳期,目前没有关于人乳或动物乳中存bamlanivimab和etesevimab,对母乳喂养婴儿的影响或对牛奶生产的影响的可用数据。母乳喂养COVID-19的个体应遵循临床指导原则,以免将婴儿暴露于COVID-19。
Bamlanivimab是针对SARS-CoV-2突突蛋白的重组中和人IgG1单克隆抗体(mAb)。它旨在阻止病毒附着和进入人体细胞,从而中和病毒,从而潜在治疗COVID-19。 Bamlanivimab源自礼来公司(Lilly)与AbCellera的合作,以开发用于预防和治疗COVID-19的抗体疗法。礼来公司的科学家在AbCellera和美国国家过敏与传染病研究所(NIAID)疫苗研究中心的科学家们不到三个月的时间内就迅速开发出了该抗体。从采自COVID-19的首批美国患者之一的血液样本中鉴定出了它。
礼来公司已成功完成了对住院的COVID-19患者的bamlanivimab的1期研究(NCT04411628)。一项针对最近在非住院环境中被诊断出患有COVID-19的人群(BLAZE-1,NCT04427501)的2/3期研究正在进行中。还在长期护理机构(BLAZE-2,NCT04497987)的居民和工作人员中单独进行bamlanivimab或bamlanivimab和etesevimab的3期研究。此外,在美国NIH领导的ACTIV-2研究中,正在对非住院COVID-19患者进行bamlanivimab测试。
Etesevimab(LY-CoV016,也称为JS016)则是一种重组的全人类单克隆中和抗体,它以高亲和力特异性结合SARS-CoV-2表面S蛋白受体结合域,并可以阻断病毒与ACE2的结合宿主细胞表面受体。将点突变引入天然人IgG1抗体中以减轻效应子功能。Etesevimab由君实生物和中国科学院微生物研究所(IMCAS)联合开发的,礼来从君实生物获得了Etesevimab的除大中华区外许可。
礼来(Lilly)已成功在健康的美国志愿者中完成了Etesevimab的1期研究(NCT04441931),以评估其安全性,耐受性,药代动力学和免疫原性。一项针对最近在非住院环境中被诊断出患有COVID-19的人群(BLAZE-1,NCT04427501)的2/3期研究正在进行中。君实生物已在中国的健康志愿者中完成了类似的1期研究,并已开始在全球范围内对COVID-19患者进行1b / 2期试验。
关于BLAZE-1
BLAZE-1(NCT04427501)是一项随机,双盲,安慰剂对照的2/3期研究,旨在评估门诊患者中单独使用bamlanivimab或bamlanivimab和etesevimab一起治疗症状性COVID-19的有效性和安全性。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#三期临床#
65
#重要进展#
70
#三期临床试验#
53
#双抗#
60
#鸡尾酒疗法#
72
#鸡尾酒#
78
优秀
90