【指南与共识】| 晚期甲状腺癌靶向药物不良反应管理专家共识(2023年版)
2023-10-10 中国癌症杂志 中国癌症杂志 发表于上海
中国临床肿瘤学会甲状腺癌专家委员会组织专家组进行深入探讨,共同制定了本专家共识,旨在形成相对规范统一的认识,更好地指导临床实践。
[摘要] 近年来,靶向治疗已成为晚期甲状腺癌的标准治疗方法。虽然中国临床肿瘤学会甲状腺癌专家委员会在2018年出版了针对放射性碘难治性分化型甲状腺癌(radioactive iodine-refractory differentiated thyroid cancer,RAIR-DTC)的靶向药物不良反应专家共识,但目前靶向治疗获批的类型已延伸至甲状腺髓样癌(medullary thyroid cancer,MTC)和甲状腺未分化癌(anaplastic thyroid cancer,ATC),靶向药物也从多靶点激酶抑制剂(multikinase inhibitors,MKIs)延伸至BRAF抑制剂、MEK抑制剂、RET抑制剂和TRK抑制剂。随着多种不同作用机制的靶向药物在临床上的广泛应用,并且考虑到众多来自不同科室的医师涉及晚期甲状腺癌的靶向治疗,靶向药物的不良反应管理急需不断规范和完善。因此,中国临床肿瘤学会甲状腺癌专家委员会组织专家组进行深入探讨,共同制定了本专家共识,旨在形成相对规范统一的认识,更好地指导临床实践。
[关键词] 晚期甲状腺癌;靶向药物;不良反应;专家共识
[Abstract] Recently, targeted therapy has become the standard of care for advanced thyroid cancer. Although expert consensus on the management of adverse events in patients receiving targeted agents for radioactive iodine-refractory differentiated thyroid cancer (RAIR-DTC) was formulated by Thyroid Cancer Committee of Chinese Society of Clinical Oncology in 2018, the tumor types which are eligible for targeted therapy have been extended to medullary thyroid cancer (MTC) and anaplastic thyroid cancer (ATC), and targeted agents have been approved from multikinase inhibitors (MKIs) to BRAF inhibitors, MEK inhibitors, RET inhibitors and TRK inhibitors. Along with the widely used targeted agents with different mechanism, the management of adverse events for targeted agents needs to be standardized and improved, especially considering the specialties of the physicians who are involved in the targeted therapy for thyroid cancer are variable. Therefore, Thyroid Cancer Committee of Chinese Society of Clinical Oncology convened an expert task force charged with developing consensus to serves as a guidance to standardize utilization of targeted agents and to optimize clinical practice.
[Key words] Advanced thyroid cancer; Targeted agents; Adverse events; Expert consensus
《晚期甲状腺癌靶向药物不良反应管理专家共识(2023年版)》
专家组
顾 问
-
林岩松 | 中国医学科学院北京协和医学院北京协和医院核医学科
组 长
-
陈立波 | 上海交通大学医学院附属第六人民医院核医学科
-
郭 晔 | 同济大学附属东方医院肿瘤科
执笔人
-
薛丽琼 | 同济大学附属东方医院肿瘤科
组 员
(按姓名笔画排序)
-
王任飞 | 同济大学附属第十人民医院核医学科
-
王卓颖 | 上海交通大学医学院附属仁济医院头颈外科
-
王莎莎 | 青岛大学附属医院肿瘤内科
-
王叙馥 | 青岛大学附属医院核医学科
-
王 峰 | 南京市第一医院核医学科
-
石 峰 | 湖南省肿瘤医院核医学科
-
付 魏 | 桂林医学院附属医院核医学科
-
包建东 | 江苏省原子医学研究所内分泌科
-
吕 静 | 青岛大学附属医院肿瘤内科
-
杨爱民 | 西安交通大学第一附属医院核医学科
-
杨 辉 | 河南省肿瘤医院核医学科
-
李少华 | 南京市第一医院核医学科
-
李 丽 | 北京大学国际医院肿瘤内科
-
李林法 | 浙江省肿瘤医院核医学科
-
李 超 | 四川省肿瘤医院头颈外科
-
李智勇 | 徐州医科大学附属医院核医学科
-
吴 宇 | 福建省肿瘤医院头颈外科
-
闵大六 | 上海交通大学医学院附属第六人民医院肿瘤内科
-
陆克义 | 山西医科大学第一医院核医学科
-
张 青 | 南昌大学第一附属医院核医学科
-
郑向前 | 天津医科大学肿瘤医院头颈外科
-
高再荣 | 华中科技大学同济医学院附属协和医院核医学科
-
黄 蕤 | 四川大学华西医院核医学科
-
章德广 | 浙江大学医学院附属邵逸夫医院甲状腺外科
-
彭小伟 | 湖南省肿瘤医院甲状腺外科
-
温 强 | 吉林大学中日联谊医院核医学科
-
樊友本 | 上海交通大学医学院附属第六人民医院甲状腺外科
近年来,晚期甲状腺癌即复发或转移性甲状腺癌的靶向治疗进展迅速,多种不同作用机制的靶向药物已在国内获批用于治疗不同类型的晚期甲状腺癌[1]。靶向治疗相关不良反应非常普遍,可能导致药物减量、暂停甚至终止,极个别病例甚至发生药物毒性相关性死亡。中国临床肿瘤学会甲状腺癌专家委员会在2018年出版了针对放射性碘难治性分化型甲状腺癌(radioactive iodine-refractory differentiated thyroid cancer,RAIR-DTC)的靶向药物不良反应管理专家共识[2],随着多种多靶点和特异性靶点激酶抑制剂获批用于治疗甲状腺髓样癌(medullary thyroid cancer,MTC)和甲状腺未分化癌(anaplastic thyroid cancer,ATC),中国临床肿瘤学会甲状腺癌专家委员会对上述共识进行了更新,并将靶向药物治疗适应证拓展至全部甲状腺癌。本共识按照靶向药物机制分类介绍其安全性和不良反应,并对常见和特殊不良反应的管理进行针对性的阐述,以期提高医师对不良反应的认知和处置能力。本共识采用的绝大部分不良反应分级标准为常见不良反应术语评定标准(Common Terminology Criteria for Adverse Events,CTCAE)5.0版[3],仅高磷血症采用成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)抑制剂临床研究常用的定量分级标准[4]。
本共识已在国际实践指南注册平台(International Practice Guideline Registry Platform,IPGRP)上注册,注册号为PREPARE-2023CN501。
1 共识的制定方法
1.1 共识专家构成
本共识专家组成员均来自中国临床肿瘤学会甲状腺癌专家委员会,共有31位专家,学科涉及肿瘤内科、头颈/甲状腺外科、核医学科及内分泌科,地域涉及北京、上海、天津、广东、四川、湖北、湖南、山东、江苏、浙江、山西、陕西、河南、广西、吉林和福建共16个省份或直辖市。所有专家均有使用甲状腺癌相关靶向药物的经验,大部分专家发起或参与过针对甲状腺癌的新药临床试验。
1.2 共识文献检索方法
文献检索的外文数据库包括PubM ed、Embase和Cochrane Library,中文数据库包括中国知网(CNKI)和中国生物医学文献服务系统(SinoMed),会议论文摘要主要检索美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)和欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)官网,检索时限均为建库至2023年6月15日。文献纳入标准:不良反应的数据来源于国内外获批甲状腺癌适应证并在国内上市的靶向药物的前瞻性研究并优先选择中国人群数据,不良反应的管理来源于系统评价、meta分析或相关指南、共识与综述。文献的证据分级采用牛津循证医学中心(Oxford Centre for Evidence-Based Medicine,OCEBM)证据分级体系[5]。
1.3 形成共识的方法学
本共识的形成采用共识会议法[6],基本流程包括:① 会议主席和成员遴选;② 会议主要议程和讲者确定;③ 会前所有参会专家熟悉共识初步内容;④ 会议以投票、排序或谈论等非结构化的互动方法,评估共识初步内容,最终整合出指导建议。
1.4 共识的目标人群与使用人群
本共识的目标人群为计划使用靶向药物的晚期甲状腺癌患者,使用人群为从事甲状腺癌诊疗的医务工作者。
1.5 共识的传播、实施及更新
本共识发布后,共识工作组将主要通过以下方式进行传播和推广:① 在学术期刊上公开发表本共识;② 在相关学术会议中对本共识进行解读;③ 通过医学媒体进行推广;④ 有计划地在中国部分省、自治区、直辖市组织本共识的推广专场会议,确保基层的医务工作者充分了解并正确使用靶向药物。共识专家组将综合循证医学证据及临床实践需求的进展,对本共识进行修订和更新。
2 靶向药物的安全性数据
2.1 多靶点激酶抑制剂(multikinase inhibitors,MKIs)
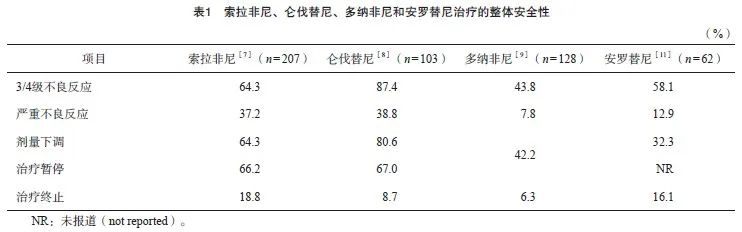
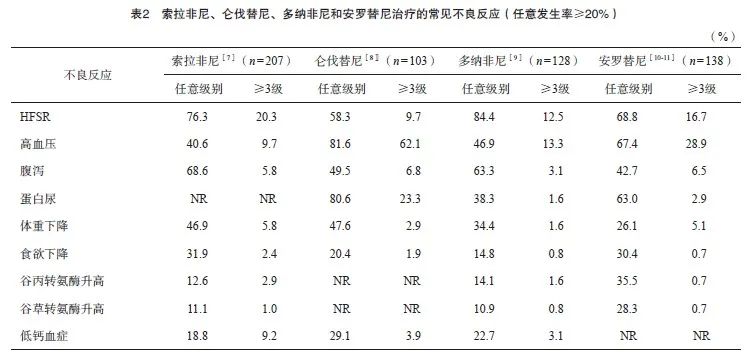
迄今为止,针对RAIR-DTC已经有4种MKIs在国内获批上市,分别是索拉非尼[7]、仑伐替尼[8]、多纳非尼[9]和安罗替尼[10],而后者也被批准用于治疗晚期MTC[11]。除了索拉非尼以外,其他药物均针对中国患者进行了注册或桥接研究,治疗整体安全性见表1,常见不良反应见表2。总体上,多纳非尼和安罗替尼的治疗耐受性优于索拉非尼和仑伐替尼。在具体不良反应方面,仑伐替尼具有较高的高血压和蛋白尿发生率,索拉非尼和多纳非尼具有较高的手足皮肤反应(hand-foot skin reaction,HFSR)和腹泻发生率,而安罗替尼具有相对较高的肝脏毒性。除了上述前瞻性研究以外,两项包括回顾性研究在内的系统性综述[12-13]进一步验证了索拉非尼和仑伐替尼的常见不良反应。
2.2 BRAF抑制剂联合MEK抑制剂
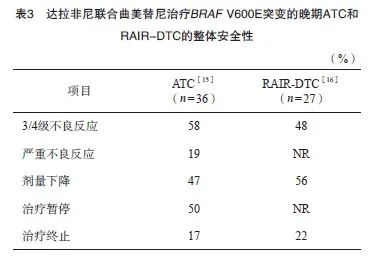
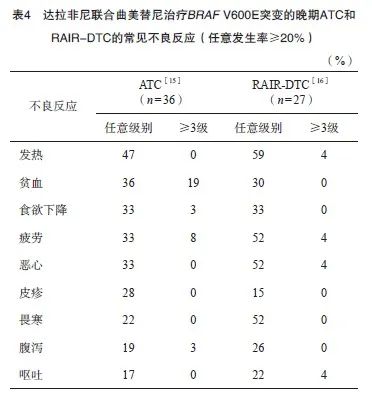
针对BRAF V600E突变的晚期ATC,美国食品药品管理局(Food and Drug Administration,FDA)早在2018年5月就批准达拉非尼(BRAF抑制剂)联合曲美替尼(MEK抑制剂)的适应证,并且在2022年6月将这一适应证扩展到所有BRAF V600E突变的不可切除或转移性实体瘤[14]。因此,理论上经MKIs治疗失败的BRAF V600E突变RAIR-DTC也可以接受达拉非尼和曲美替尼的联合治疗。虽然达拉非尼联合曲美替尼的方案已在国内上市并获批用于治疗晚期黑色素瘤和非小细胞肺癌,但尚未获批用于治疗甲状腺癌。目前,全球有2项前瞻性研究分别针对BRAF V600E突变的晚期ATC[15]和RAIR-DTC[16],治疗的整体安全性见表3,常见不良反应见表4。总体上,这一联合治疗方案的耐受性良好,其中达拉非尼减量的比例多于曲美替尼,除了贫血以外,3/4级不良反应发生率均小于10%。
2.3 RET抑制剂
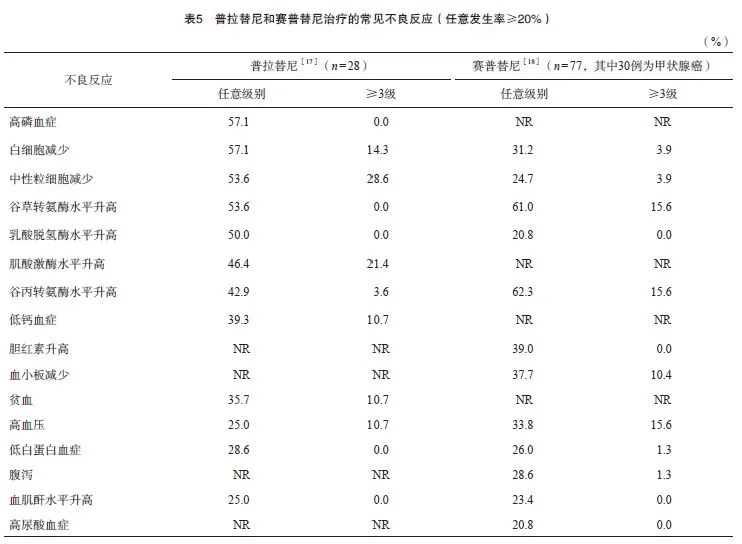
针对RET基因改变(突变或融合)的晚期MTC或RAIR-DTC,普拉替尼和赛普替尼在国内分别于2022年3月和9月获批上述适应证。普拉替尼的获批主要基于一项名为ARROW研究中的中国患者队列[17],而赛普替尼的获批主要基于一项名为LIBRETTO-321的中国人群多队列研究[18],常见不良反应见表5。总体上,这两种药物的治疗耐受性良好,普拉替尼的特征性不良反应包括高磷血症、肌酸激酶升高和低钙血症,而赛普替尼则为腹泻和高尿酸血症。在肝脏毒性方面,赛普替尼可导致较多的3/4级转氨酶升高,并且具有特征性的胆红素升高。在骨髓抑制方面,普拉替尼可导致较严重的中性粒细胞下降和特征性的贫血,而赛普替尼则具有特征性的血小板下降。
2.4 TRK抑制剂
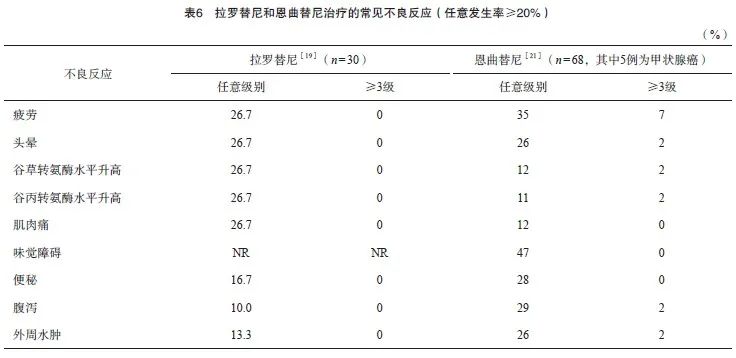
目前,拉罗替尼和恩曲替尼这两种TRK抑制剂在国内分别于2022年4月和7月获批用于治疗具有NTRK基因融合的晚期实体瘤,近期分别有针对甲状腺癌的研究[19-20]报道,但恩曲替尼的研究[21]仅包括16例甲状腺癌患者,因此表6中针对恩曲替尼的不良反应数据来自针对泛瘤种的临床试验。总体上,这两种药物的耐受性良好,3/4级不良反应较为罕见,而恩曲替尼具有特征性的味觉障碍。
3 常见或特殊不良反应的管理原则
3.1 高血压
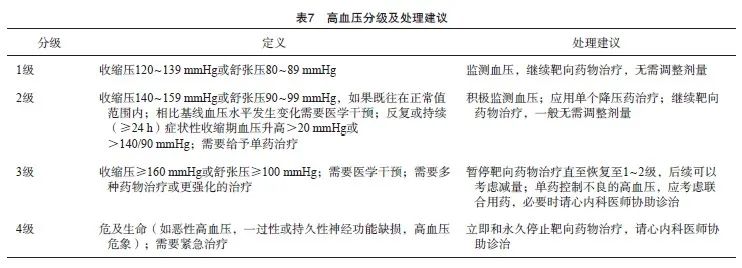
高血压是靶向治疗最常见的不良反应,特别是接受MKIs治疗的患者,也可以发生于接受RET抑制剂治疗的患者中。除了这些药物以外,某些合并药物如激素、非甾体类抗炎药或促红细胞生成素也有可能加重或导致高血压的发生。患者既往合并有心血管疾病是发生高血压最重要的危险因素,其他因素包括疼痛或心理等因素。对于接受仑伐替尼治疗的患者,有共识[22]推荐在治疗前1周开始监测血压,并在发生高血压时注意是否合并蛋白尿或左心功能不全等不良反应。高血压分级及处理建议见表7。
对于收缩压>140 mmHg和(或)舒张压>90 mmHg的患者,应立即开始降压药物治疗,治疗目标是控制在上述血压界值以下。根据欧洲心脏病学会的指南[23],首选的降压药物是血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)或血管紧张素受体拮抗剂(angiotonin receptor blocker,ARB)。对于收缩压>160 mmHg和(或)舒张压>100 mmHg的患者,应考虑上述任意一种药物和二氢吡啶类钙离子拮抗剂(calcium channel blocker,CCB)的联合治疗,相比单药治疗有更快速的降压效果。对于一线ACEI或ARB治疗无效的患者,二线也通常采用二氢吡啶类CCB治疗,其他药物包括β受体阻断剂、安体舒通、硝酸盐或肼苯哒嗪。非二氢吡啶类CCB如地尔硫卓或维拉帕米作为细胞色素氧化酶P450的抑制剂,能够与很多靶向药物发生相互作用,通常情况下不推荐使用。当靶向药物同时导致腹泻或脱水等不良反应时,应避免使用利尿剂作为降压药物。对于收缩压>180 mmHg和(或)舒张压>110 mmHg的患者,应立即中断靶向治疗并寻求专科医师的协助诊治。
3.2 HFSR
HFSR又被称为掌跖感觉丧失性红斑综合征(palmar plantar erythrodysesthesia syndrome,PPES),是很多MKIs治疗的特征性不良反应。对于HFSR而言,预防通常比治疗更为重要,因此需要加强患者宣教[24]。首先,在治疗前应尽可能处理手足基础疾病如角化过度、湿疹或真菌感染。其次,治疗中应避免接触热水和含乙醇的润肤露。再次,应避免重复的手、足部活动如打字或穿过紧的鞋,以防止皮肤过度摩擦,并控制每天的步行距离。最后,可以穿戴厚的棉手套和袜子以避免手足损伤并保持干燥。一旦发生HFSR,应根据相应级别处理。目前缺乏针对HFSR的特异性治疗药物,一项针对原发性肝癌的研究[25]显示,尿素软膏有助于降低索拉非尼的HFSR发生率和严重程度,其他对症处理措施包括局部使用小剂量激素软膏如氯倍他索治疗红斑、利多卡因凝胶止痛和抗生素预防感染等。HFSR分级及处理建议见表8。

3.3 腹泻
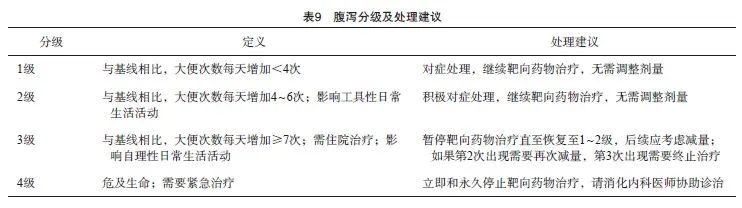
腹泻是MKIs治疗常见的不良反应,在特异性抑制剂治疗的患者中也有一定的发生比例。基于针对RAIR-DTC的DECISION和SELECT研究的数据[26-27],索拉非尼和仑伐替尼引起的腹泻通常在第1个周期出现,并且有可能在整个治疗周期中间断发生。患者教育对于预防或减轻腹泻十分重要,应避免服用容易引起或加重腹泻的食物,并且记录每天的排便次数和性状。洛哌丁胺是首选的止泻药物,如果用药超过48 h而腹泻没有改善则需要停药,可以考虑换用苯乙哌啶。对于严重腹泻(3/4级)的患者,应立即停用靶向治疗药物,并且给予补液防止或治疗脱水,并密切监测电解质平衡的变化,必要时寻求消化内科医师的协助诊治。腹泻分级及处理建议见表9。
3.4 蛋白尿
蛋白尿是MKIs治疗常见的不良反应,特别是接受仑伐替尼治疗的患者。研究表明,亚洲(中国[8]或日本[28])患者的蛋白尿发生率和严重程度明显高于西方人群[29],因此需要引起重视。高血压是患者出现蛋白尿的高危因素,此时首选ACEI或ARB进行治疗,并密切关注肾功能如肌酐和心功能如肌钙蛋白的指标变化[30]。蛋白尿分级及处理建议见表10。

3.5 谷丙/谷草转氨酶升高
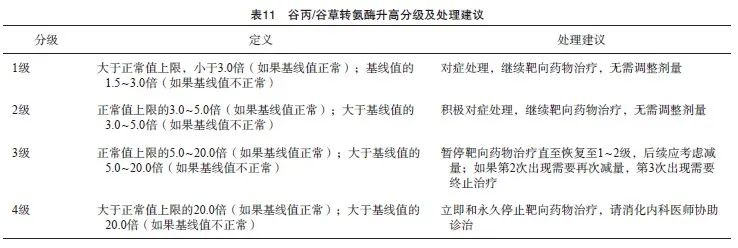
谷丙/谷草转氨酶升高是RET抑制剂治疗的常见不良反应,也可发生于接受MKIs或TRK抑制剂治疗的患者中。通常情况下,大部分的谷丙/谷草转氨酶升高为1/2级并且为自限性,并不会影响靶向治疗的进行。对于合并乙型肝炎病毒(hepatitis B virus,HBV)表面抗原阳性的患者,需要同时合并抗病毒治疗,并且定期检测HBV DNA水平的变化。患者在接受靶向治疗期间,应避免合并使用加重肝功能损伤的药物(包括不必要的中成药),必要时寻求消化内科医师的协助诊治。谷丙/谷草转氨酶升高分级及处理建议见表11。
3.6 发热
发热是BRAF抑制剂联合MEK抑制剂治疗的最常见不良反应,通常会伴有畏寒或寒战的临床表现。在一项针对非小细胞肺癌和恶性黑色素瘤的汇总分析[31]中,61.3%的患者在接受达拉非尼联合曲美替尼的治疗后出现发热的不良反应,但仅有5.7%为3/4级,9.4%的患者因此而终止治疗。一项来自澳大利亚的指南[32]建议,患者出现下列症状之一,包括发热(体温≥38 ℃)、畏寒/寒战/盗汗或感冒样症状时,同时暂停达拉非尼和曲美替尼治疗,并采用对乙酰氨基酚或非甾体抗炎药控制体温,并且在症状完全恢复超过24 h后恢复达拉非尼和曲美替尼的联合治疗。对于反复出现的发热,可以采用小剂量激素(泼尼松)的预防治疗(10~25 mg),并且在症状恢复后的1个月内逐渐减量。对于经过暂停治疗和激素预处理仍无法有效控制体温的患者,需要降低药物剂量甚至终止治疗。对于没有明确感染证据的发热患者,通常不建议使用抗生素,但对于体温升高持续超过24 h、意识混乱、严重呕吐或脱水的患者,建议立即住院治疗。一项针对恶性黑色素瘤的COMBI-APlus研究[33]验证了上述处理建议的有效性,将3/4级发热的发生率和治疗终止率降低为3.8%和2.4%。
3.7 高磷血症和低钙血症
高磷血症是普拉替尼治疗特征性的不良反应,在针对中国晚期MTC患者的研究[17]中,其发生率明显高于西方人群[34]。低钙血症可以与高磷血症同时发生,也可以单独存在,比如接受MKIs治疗的甲状腺癌患者。接受靶向治疗的甲状腺癌患者如果发生高磷血症和低钙血症,首先要排除肿瘤溶解综合征和甲状旁腺功能减退,单纯的低钙血症也要排除治疗骨转移的药物如双膦酸盐或RANKL抑制剂导致的并发症。高磷血症的分级为3.5~5.5 mg/dL或1.1~1.8 mmol/ L (1级)、5.6~6.9 mg/dL或1.8~2.3 mmol/L (2 级)、7.0~9.9 mg/dL或2.3~3.2 mmol/L(3级)和≥10 mg/dL或≥3.2 mmol/L(4级),1/2级通常不需要干预或采用低磷饮食,3级需要暂停靶向治疗并接受降低血磷的药物如司维拉姆, 4级则需要紧急入院,必要时接受透析治疗。普拉替尼导致的高磷血症基本为1/2级和自限性,并不会影响靶向治疗的进行,如果有相关症状可以短期暂停药物治疗。低钙血症的分级需要基于血清白蛋白水平进行矫正,分级为正常值下限~2.00 mmol/L(1级)、2.00~1.75 mmol/ L ( 2 级)、1.75~1.50 mmol/L( 3 级) 和<1.50 mmol/L(4级),1/2级通常不需要干预或采用高钙饮食,3级需要暂停靶向治疗并接受静脉补钙治疗,4级则需要紧急入院治疗并监测严重心律失常的发生。
3.8 其他不良反应
晚期甲状腺癌的靶向药物治疗还会引起其他不良反应,包括RET抑制剂治疗导致的骨髓抑制(白细胞下降、贫血或血小板下降)、常见的消化道反应(恶心、呕吐或便秘)、非特异性的全身症状(疲劳、食欲下降或体重下降)、无需干预的实验室指标异常(乳酸脱氢酶或肌酸激酶升高)等,这些不良反应大多为轻度,通常予以常规监测或相应处理。总体而言,晚期甲状腺癌的靶向药物治疗引起致死性不良反应的概率很低,meta分析显示,即便是毒性较大的MKIs其致死率也不超过2%[12],并未显著高于安慰剂对照组[35]。其他少见但需要引起关注的不良反应包括严重出血、肺栓塞、胃肠道穿孔和急性肾损伤等,一旦发生需要立即寻求相关学科的协助诊治。
4 结语
随着甲状腺癌生物学行为、驱动基因和信号转导通路等基础研究的临床转化,药物研发和可及性不断进步,以激酶抑制剂为代表的分子靶向治疗已经成为晚期甲状腺癌的标准治疗模式,多种作用机制的靶向药物相继获批用于治疗多种类型的晚期甲状腺癌。本专家共识所收集的靶向药物不良反应数据均来源于前瞻性临床研究,管理原则参考了专业协会的指南、特定药物的共识和
相关综述,除了少数不良反应以外,大多缺乏前瞻性研究或高级别证据的支持,不可避免地存在一定局限性,这也是不良反应管理类指南或共识普遍存在的问题。本共识未来还将持续完善并适时更新。中国临床肿瘤学会甲状腺癌专家委员会希望本共识对涉及甲状腺癌靶向治疗的临床医师和甲状腺癌患者有所帮助。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1]MILLER K C, CHINTAKUNTLAWAR A V. Molecular-driven therapy in advanced thyroid cancer[J]. Curr Treat Options Oncol, 2021, 22(3): 24.
[2]中国临床肿瘤学会(CSCO)甲状腺癌专家委员会. 碘难治性分化型甲状腺癌靶向药物不良反应管理专家共识(2018年版)[J]. 中国癌症杂志, 2018, 28(7): 545-553.
Thyroid Cancer Committee of Chinese Society of Clinical Oncology. Expert consensus on adverse drug reactions management of iodine refractory differentiated thyroid cancer (2018 edition)[J]. China Oncol, 2018, 28(7): 545-553.
[3]U.S. Department of Health and Human Services. Common Terminology Criteria for Adverse Events (CTCAE) Version 5.0[EB/OL]. (2017-11-27)[2023-06-30]. https://ctep.cancer.gov/protocoldevelopment/electronic_applications/docs/ctcae_v5_quick_reference_5x7.pdf
[4]KOMMALAPATI A, TELLA S H, BORAD M, et al. FGFR inhibitors in oncology: insight on the management of toxicities in clinical practice[J]. Cancers (Basel), 2021, 13(12): 2968.
[5]Centre for Evidence-Based Medicine. Oxford Centre for Evidence-Based Medicine: Levels of Evidence (March 2009)[EB/OL]. (2009-03-01)[2023-06-30]. https://www.cebm.ox.ac.uk/resources/levels-of-evidence/oxford-centre-for-evidence-based-medicine-levels-of-evidence-march-2009.
[6]FINK A, KOSECOFF J, CHASSIN M, et al. Consensus methods: characteristics and guidelines for use[J]. Am J Public Health, 1984, 74(9): 979-983.
[7]BROSE M S, NUTTING C M, JARZAB B, et al. Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial[J]. Lancet, 2014, 384(9940): 319-328.
[8]ZHENG X Q, XU Z G, JI Q H, et al. A randomized, phase Ⅲ study of lenvatinib in Chinese patients with radioiodine-refractory differentiated thyroid cancer[J]. Clin Cancer Res, 2021, 27(20): 5502-5509.
[9]LIN Y, YANG H, SHI F, et al. Donafenib in locally advanced/metastatic, radioactive iodine-refractory, differentiated thyroid cancer: a randomized, double-blind, placebo-controlled, multi-center phase Ⅲ clinical trial (DIRECTION)[J]. Ann Oncol, 2022, 33(Suppl_7): S1294.
[10] CHI Y, ZHENG X Q, ZHANG Y, et al. Anlotinib in locally advanced or metastatic radioiodine-refractory differentiated thyroid carcinoma: a randomized, double-blind, multicenter phase Ⅱ trial[J]. Clin Cancer Res, 2023: CCR-C22-3406.
[11] LI D P, CHI Y, CHEN X H, et al. Anlotinib in locally advanced or metastatic medullary thyroid carcinoma: a randomized, double-blind phase ⅡB trial[J]. Clin Cancer Res, 2021, 27(13): 3567-3575.
[12] OBA T, CHINO T, SOMA A, et al. Comparative efficacy and safety of tyrosine kinase inhibitors for thyroid cancer: a systematic review and meta-analysis[J]. Endocr J, 2020, 67(12): 1215-1226.
[13] LI L Y, CHENG L, SA R, et al. Real-world insights into the efficacy and safety of tyrosine kinase inhibitors against thyroid cancers[J]. Crit Rev Oncol Hematol, 2022, 172: 103624.
[14] U.S. Food and Drug Administration. FDA grants accelerated approval to dabrafenib in combination with trametinib for unresectable or metastatic solid tumors with BRAF V600E mutation[EB/OL]. (2022-06-23)[2023-06-30]. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-dabrafenib-combinationtrametinib-
unresectable-or-metastatic-solid.
[15] SUBBIAH V, KREITMAN R J, WAINBERG Z A, et al. Dabrafenib plus trametinib in patients with BRAF V600Emutant anaplastic thyroid cancer: updated analysis from the phase Ⅱ ROAR basket study[J]. Ann Oncol, 2022, 33(4): 406-415.
[16] BUSAIDY N L, KONDA B, WEI L, et al. Dabrafenib versus dabrafenib+trametinib in BRAF mutated radioactive iodine refractory differentiated thyroid cancer: results of a randomized, phase 2, open-label multicenter trial[J]. Thyroid, 2022, 32(10): 1184-1192.
[17] GAO M, ZHENG X, WANG Y, et al. Efficacy and safety of pralsetinib, a selective RET inhibitor, in Chinese patients with advanced RET-mutant medullary thyroid cancer[C]. Thyroid, 2021, 31(Suppl_1): abstract LBO 3.
[18] Z H E N G X Q , J I Q H , S U N Y P , e t a l . E f f i c a c y a n d safety of selpercatinib in Chinese patients with advanced RET-altered thyroid cancers: results from the phase Ⅱ LIBRETTO-321 study[J]. Ther Adv Med Oncol, 2022, 14: 17588359221119318.
[19] CABANILLAS M E, LIN J J, BROSE M S, et al. Larotrectinib (laro) long-term efficacy and safety in patients (pts) with tropomyosin receptor kinase (TRK) fusion thyroid carcinoma (TC)[J]. J Clin Oncol, 2023, 41(Suppl_16): 6091.
[20] KRZAKOWSKI M J, LU S, COUSIN S, et al. Updated analysis of the efficacy and safety of entrectinib in patients (pts) with locally advanced/metastatic NTRK fusion-positive (NTRK-fp) solid tumors[J]. J Clin Oncol, 2022, 40(Suppl_16): 3099.
[21] DOEBELE R C, DRILON A, PAZ-ARES L, et al. Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumours: integrated analysis of three phase 1-2 trials[J]. Lancet Oncol, 2020, 21(2): 271-282.
[22] REED N, GLEN H, GERRARD G, et al. Expert consensus on the management of adverse events during treatment withlenvatinib for thyroid cancer[J]. Clin Oncol (R Coll Radiol), 2020, 32(5): e145-e153.
[23] LYON A R, LÓPEZ-FERNÁNDEZ T, COUCH L S, et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS)[J]. Eur Heart J, 2022, 43(41): 4229-4361.
[24] MCLELLAN B, CIARDIELLO F, LACOUTURE M E, et al. Regorafenib-associated hand-foot skin reaction: practical advice on diagnosis, prevention, and management[J]. Ann Oncol, 2015, 26(10): 2017-2026.
[25] REN Z G, ZHU K S, KANG H Y, et al. Randomized controlled trial of the prophylactic effect of urea-based cream on sorafenib-associated hand-foot skin reactions in patients with advanced hepatocellular carcinoma[J]. J Clin Oncol, 2015, 33(8): 894-900.
[26] WORDEN F, FASSNACHT M, SHI Y K, et al. Safety and tolerability of sorafenib in patients with radioiodine-refractory thyroid cancer[J]. Endocr Relat Cancer, 2015, 22(6): 877-887.
[27] HADDAD R I, SCHLUMBERGER M, WIRTH L J, et al. Incidence and timing of common adverse events in lenvatinibtreated patients from the SELECT trial and their association with survival outcomes[J]. Endocrine, 2017, 56(1): 121-128.
[28] KIYOTA N, SCHLUMBERGER M, MURO K, et al. Subgroup analysis of Japanese patients in a phase 3 study of lenvatinib in radioiodine-refractory differentiated thyroid cancer[J]. Cancer Sci, 2015, 106(12): 1714-1721.
[29] SCHLUMBERGER M, TAHARA M, WIRTH L J, et al. Lenvatinib versus placebo in radioiodine-refractory thyroid cancer[J]. N Engl J Med, 2015, 372(7): 621-630.
[30] NERVO A, RETTA F, RAGNI A, et al. Nephrotoxicity in advanced thyroid cancer treated with tyrosine kinase inhibitors: An update[J]. Crit Rev Oncol Hematol, 2021, 168: 103533.
[31] SCHADENDORF D, ROBERT C, DUMMER R, et al. Pyrexia in patients treated with dabrafenib plus trametinib across clinical trials in BRAF-mutant cancers[J]. Eur J Cancer, 2021, 153: 234-241.
[32] ATKINSON V, LONG G V, MENZIES A M, et al. Optimizing combination dabrafenib and trametinib therapy in BRAF mutation-positive advanced melanoma patients: guidelines from Australian melanoma medical oncologists[J]. Asia Pac J Clin Oncol, 2016, 12(Suppl 7): 5-12.
[33] ATKINSON V, ROBERT C, GROB J J, et al. Improved pyrexiarelated outcomes associated with an adapted pyrexia adverse event management algorithm in patients treated with adjuvant
dabrafenib plus trametinib: primary results of COMBI-APlus[J]. Eur J Cancer, 2022, 163: 79-87.
[34]SUBBIAH V, HU M I, WIRTH L J, et al. Pralsetinib for patients with advanced or metastatic RET-altered thyroid cancer (ARROW): a multi-cohort, open-label, registrational, phase 1/2 study[J]. Lancet Diabetes Endocrinol, 2021, 9(8): 491-501.
[35]YIMAER W, ABUDOUYIMU A, TIAN Y, et al. Efficacy and safety of vascular endothelial growth factor receptor tyrosine kinase inhibitors in the treatment of advanced thyroid cancer: a meta-analysis of randomized controlled trials[J]. Onco Targets Ther, 2016, 9: 1167-1173.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言