Neuron: 前额皮层抑制性神经元的双面人生—编码奖赏和恐惧相关价值信息
2022-08-19 周科 神经周K
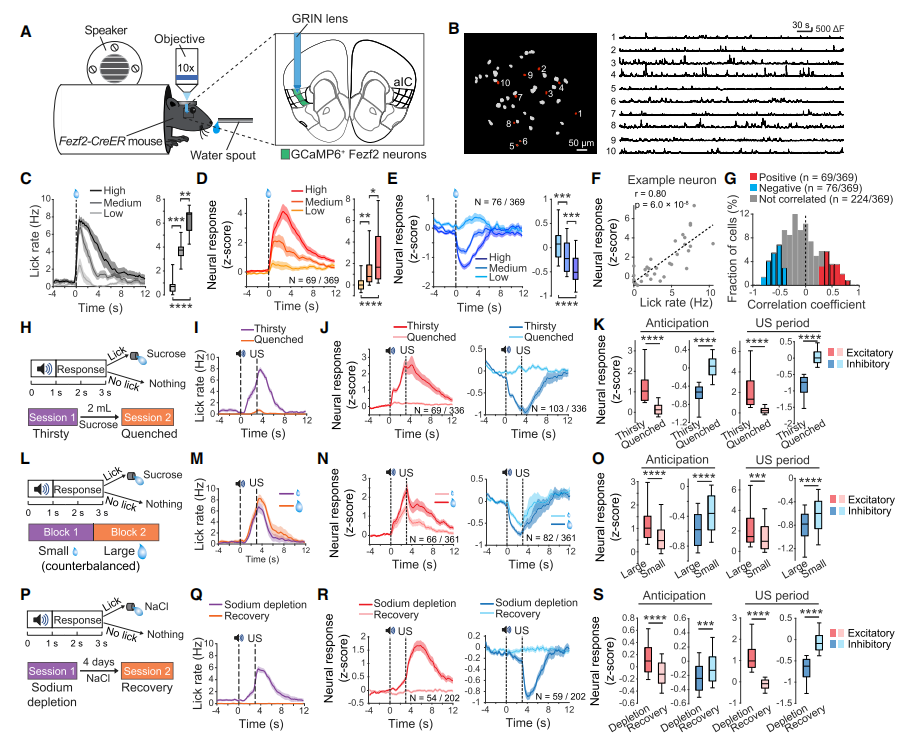
使用条件位置偏好模型研究PL的两类SST-INs是否编码相反的价值信息。研究发现,光遗传学激活吗啡相关的SST-INs能促进小鼠的条件位置偏好。
在人类的学习过程中会优先激活特定的活性神经元,这些神经元能保留细胞的学习痕迹,当重新激活这些类型的神经元,会唤醒相关的记忆信息,被称为记忆痕迹细胞。联想恐惧记忆是一类自我保护的学习过程,,目前研究认为联想恐惧记忆的形成依赖于前额皮层的谷氨酸投射神经元(PNs)的活性的增加。
在前额皮层中,GABA能中间神经元(INs)呈离散型分布,在调节PNs的活性中发挥重要作用。小清蛋白阳性的INs(PV-INs)、血管活性肽阳性的INs(VIP-INs)和生长抑素阳性的INs(SST-INs)在调节PNs介导联想记忆中发挥重要作用,但是对于INs是否直接参与联想记忆,目前仍知之甚少。
2022年8月8日,来自纽约大学西奈山医学院的Roger L. Clem团队在Neuron上发表题为“Control of fear by discrete prefrontal GABAergic populations encoding valence-specific information”的研究论文,该文章揭示了在联想关键记忆中,前额皮层PL亚区的浅层(L1-3)SST-INs编码负性恐惧相关价值信息,而前额皮层PL亚区的深层(L5-6)SST-INs编码正性奖赏相关价值信息。

1
PL亚区的L1-3层的SST-INs编码
恐惧相关价值信息
前额皮层的PL亚区是听觉相关恐惧记忆的条件信息(CS)处理的重要亚区。使用雌激素受体依赖的Cre重组酶(ERCreER)结合即早基因Arc启动子序列增强突触活动响应元件(E-SARE)标记在听觉条件恐惧记忆中的活性神经元,发现在PL亚区的L1-3层存在大量的活性神经元。通过免疫荧光标记研究INs的响应情况,发现在听觉恐惧记忆提取过程中,仅有SST-INs的活性增加。
通过C-fos和SST依赖的重组蛋白标记技术,发现PL亚区的L1-3层的SST-INs在恐惧记忆提取过程中被优先激活,说明听觉恐惧记忆的形成和提取均依赖于PL亚区的L1-3层的SST-INs。类似的使用光遗传学激活PL亚区的L1-3层的SST-INs能唤醒小鼠的恐惧记忆,而光遗传学抑制PL亚区的L1-3层的SST-INs能促小鼠的恐惧消散。
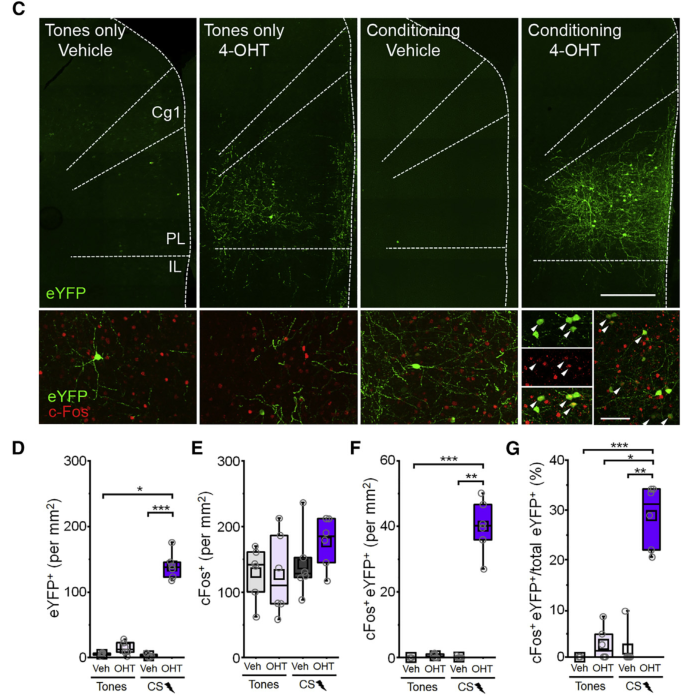
图1:前额皮层PL亚区L1-3层的SST-INs在恐惧记忆的提取过程中优先激活
2
PL亚区的L5-6层的SST-INs编码奖赏相关价值信息
先前研究发现PL的SST-INs在在吗啡处理后活性增加,与上述现象存在矛盾。因此研究人员在吗啡相关条件位置偏好模型中标记PL亚区的SST活性神经元,发现活性神经元主要分布在PL亚区的L5-6层。使用光遗传学激活吗啡相关的SST-INs,发现光激活吗啡相关的SST-INs能抑制L1-3层的恐惧相关的SST-INs的活性。
使用条件位置偏好模型研究PL的两类SST-INs是否编码相反的价值信息。研究发现,光遗传学激活吗啡相关的SST-INs能促进小鼠的条件位置偏好,而光遗传学激活恐惧相关的SST-INs能促进小鼠的条件位置厌恶,说明两类SST-INs编码完全相反的价值信息。
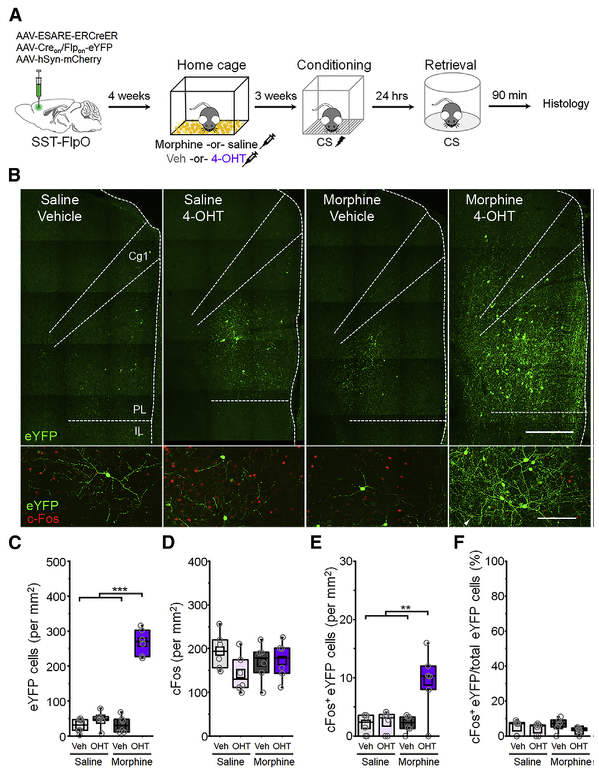
图2:前额皮层PL亚区L5-6层的SST-INs编码奖赏相关价值信息
3
恐惧相关SST-INs和吗啡相关SST-INs
效应脑区不相同
使用光遗传学激活恐惧相关SST-INs,对全脑进行C-fos检测,发现激活恐惧相关SST-INs能激活威胁与防御反应相关的脑区,包括基地外侧杏仁核(BLA)、腹外侧导水管周围灰质(vlPAG)、丘脑室旁核(PVT)、外侧僵核(LHb)、背内侧下丘脑(DMH)。
光遗传学激活吗啡相关SST-INs,发现吗啡相关SST-INs能激活奖赏中枢相关脑区,包括伏隔核(NAc)、腹侧背盖区(VTA)、丘脑室旁核(PVT)、背外侧导水管周围灰质(dlPAG)。
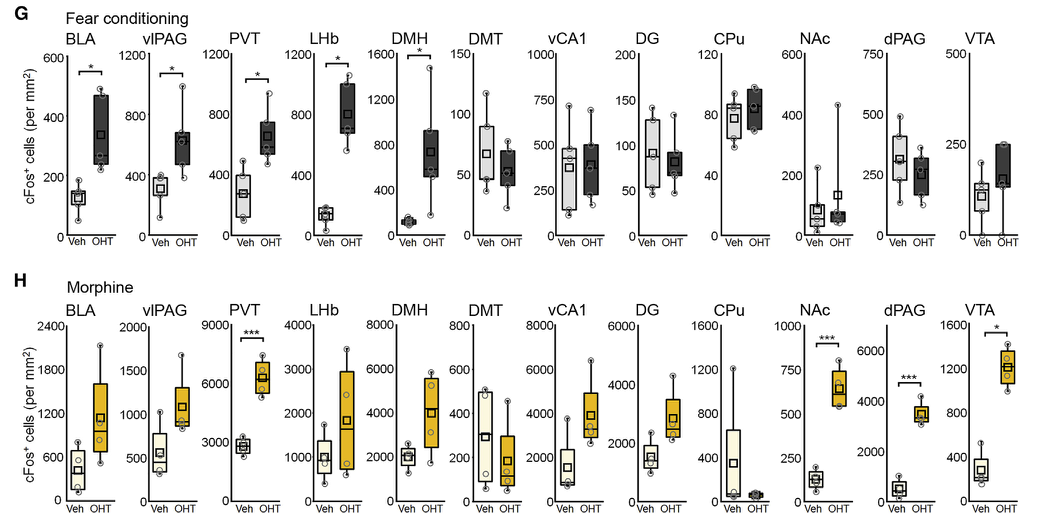
图3:恐惧相关SST-INs和吗啡相关SST-INs效应脑区不相同
总结
本文通过活性神经元标记技术、免疫荧光标记技术、光遗传学技术和脑片膜片钳技术,发现前额皮层PL亚区两类SST-INs活性神经元在编码正性价值信息和负性价值信息中具有完全相反的作用,揭示了易被忽略的GABA能中间神经元,在编码情绪学习中具有重要作用。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#Neuron#
71
#编码#
92