Neuron:杨奔博士等揭示恐惧抑制饮食的神经学机制,为病理性厌食症提供了新靶点
2021-01-21 生物世界 生物世界
众所周知,压力会影响饮食。压力促进饮食的机制或许跟大脑的奖赏机制——多巴胺系统有关。但压力抑制饮食的机制,我们知之甚少。
众所周知,压力会影响饮食。压力促进饮食的机制或许跟大脑的奖赏机制——多巴胺系统有关。但压力抑制饮食的机制,我们知之甚少。
2021年1月20日,美国西北大学生理系系主任 D. James Surmeier 团队在 Cell 子刊Neuron杂志上发表了题为:Locus coeruleus anchors a trisynaptic circuit controlling fear-induced suppression of feeding 的研究论文。
该文章通过研究压力的一种——恐惧对饮食的影响,揭示了蓝斑核(locus coeruleus,LC)神经元通过神经递质共释放诱导恐惧抑制饮食的神经学机制。
D. James Surmeier博士为论文通讯作者,杨奔博士为第一作者兼共同通讯作者。
已有报道三个脑区与恐惧和饮食相关。这三个脑区分别是中央杏仁核(central nucleus of amygdala, CeA),臂旁核(parabrachial nucleus, PBN)和蓝斑核(locus coeruleus,LC)。例如在多个物种上已证实中央杏仁核的移除能够消除恐惧反应。臂旁核传递恐惧等有害刺激到脑中枢;激活臂旁核也可以抑制饮食。蓝斑核是大脑的去甲肾上腺素中心,去甲肾上腺素的释放引起大脑的唤起,和恐惧,饮食都相关。但这三个脑区之间怎么联系,他们和恐惧引起的饮食抑制是否相关目前未知。
针对这些疑问,研究人员在小鼠身上进行了“条件恐惧”实验。研究人员发现“条件恐惧”实验本身并不会影响饮食,但恐惧记忆的再现可以持久抑制饮食。
为进一步研究其机制,研究人员结合了电生理,光遗传学,化学遗传学,交叉遗传学等方法揭示了恐惧抑制饮食的神经学机制。
研究人员首先用电生理的方法发现蓝斑核神经元可能共释放去甲肾上腺素和谷氨酸。为证实该发现,研究人员进一步用交叉遗传学的方法证实蓝斑核神经元共表达络氨酸羟化酶(tyrosine hydroxylase, 蓝斑核神经元的一个常用标示)和2型囊泡谷氨酸转运蛋白(vesicular glutamate transporter 2, vGluT2),符合去甲肾上腺素和谷氨酸共释放的条件。最后,光遗传学的方法证实蓝斑核神经元确实共释放去甲肾上腺素和谷氨酸。
进一步研究还发现了蓝斑核投射到臂旁核的新的神经通路。用化学遗传学的方法激活蓝斑核神经元能抑制饮食,提示恐惧可能通过激活蓝斑核神经元,引起神经递质共释放来激活臂旁核神经元,从而瞬间抑制饮食。
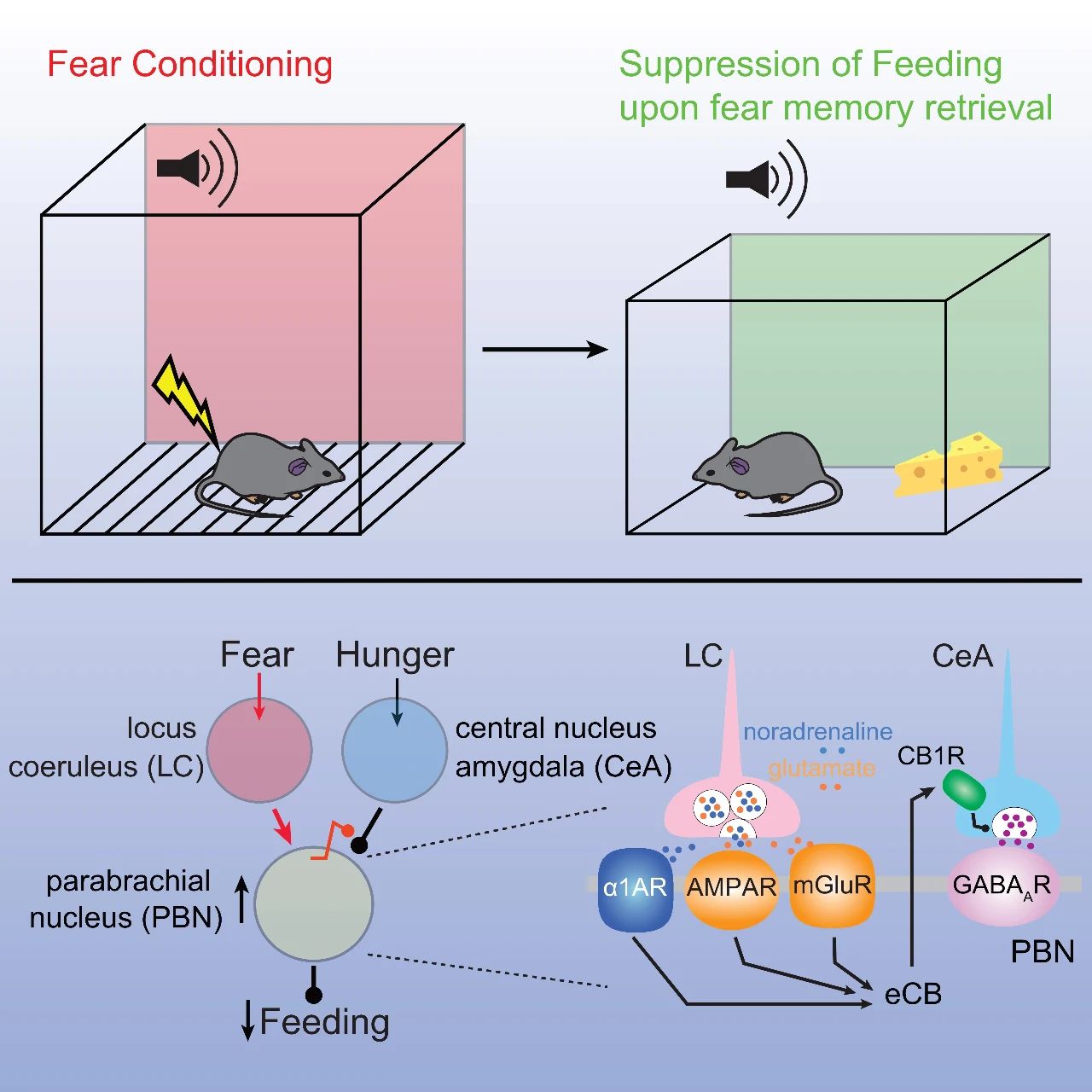
在理清了蓝斑核到臂旁核的通路后,研究人员将目光投向中央杏仁核到蓝斑核的投射。之前有研究提示中央杏仁核神经元直接投射到蓝斑核,通过释放促肾上腺皮质激素释放激素来激活蓝斑核神经元。但研究人员结合电生理和光遗传学的方法发现中央杏仁核并不直接投射到蓝斑核,而是投射到臂旁核, 通过释放γ-氨基丁酸来抑制臂旁核神经元。而“条件恐惧”能抑制中央杏仁核到臂旁核的投射。
进一步研究发现该抑制的机制是内源性大麻素诱导的长期抑制。该突触的长期抑制或许和恐惧记忆对饮食的持久抑制有关。
内源性大麻素的合成一般是由兴奋性突触输入引导的,但中央杏仁核到臂旁核的投射是抑制性,提示该长期抑制可能属于异源性突触可塑性。而上面的研究显示蓝斑核对臂旁核有兴奋性神经递质共释放,提示来自蓝斑核的投射或许是该异源性突触长期抑制的诱因。
通过一系列的药理学和突触生理学实验,研究人员最终证实蓝斑核的神经递质共释放确实能引导中央杏仁核到臂旁核投射的内源性大麻素诱导的长期抑制。不仅如此,蓝斑核的神经递质共释放对调控中央杏仁核到臂旁核投射的长期抑制的持久性和牢固性至关重要,从而首次揭示了神经递质共释放的生理学功能。
最后,抑制蓝斑核神经元神经递质共释放或抑制内源性大麻素通路均可阻断“条件恐惧”引起的饮食抑制。“条件恐惧”是一个经典的创伤后应激障碍症动物模型,因此在临床上,该研究为创伤后应激障碍症引起的饮食抑制提供了潜在的新靶点。
综上所述,该研究首次报道了蓝斑核神经元的去甲肾上腺素和谷氨酸共释放,不仅挑战了神经科学领域的戴尔法则(Dale’s law,即一种神经元释放一种神经递质),并揭示了神经递质共释放的生理学功能和生物学逻辑。
恐惧,作为正常生理学功能,瞬间抑制饮食等其他生理需求,对物种生存至关重要。但在病理条件下,如创伤后应激障碍症,恐惧则可引起对饮食的长期抑制。
该研究不仅揭示了恐惧抑制饮食的机制,并为创伤后应激障碍症引起的饮食抑制和病理性厌食症的治疗提供了新的靶点。
原始出处:
Ben Yang,Eric Delpire,D. James Surmeier,et al.Locus coeruleus anchors a trisynaptic circuit controlling fear-induced suppression of feeding.neuron.Published:January 20, 2021.DOI:https://doi.org/10.1016/j.neuron.2020.12.023
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#Neuron#
69
#新靶点#
71
#厌食症#
65
好吧我信了
103
机制研究离临床仍然有距离,不过与临床结合思考,仍然有帮助的,不能仅仅是纯临床思维,转化思维同样重要
106