Biomaterials:当光遗传学遇上肠道菌群,光控工程菌助力帕金森氏病治疗
2023-03-02 周科 “神经周K”公众号 发表于上海
肠道微生物可通过肠-脑轴参与神经发育、神经炎症和神经传递等多种脑功能的调节,基于微生物的疾病治疗方法如粪菌移植已用于临床实践中,在此基础上也衍生出基因工程改造的肠道细菌用于疾病的机制研究和治疗。最近以
肠道微生物可通过肠-脑轴参与神经发育、神经炎症和神经传递等多种脑功能的调节,基于微生物的疾病治疗方法如粪菌移植已用于临床实践中,在此基础上也衍生出基因工程改造的肠道细菌用于疾病的机制研究和治疗。最近以大肠杆菌Nissle 1917(EcN)为代表的的工程益生菌作为新型的药物递送系统已用于治疗癌症、肠道炎症以及代谢性疾病,具有原位、高效、持续给药和设计灵活等优点。
光遗传学益生菌(optogenetic probiotics)因其时间和空间上的特异性和操作的灵活性而具有独特的潜力。其中光遗传学可提供精准灵活的工程菌原位控制策略,但目前的光遗传工具受限于波长较短而组织穿透性较差,限制了光遗传益生菌在肠道中的应用。
2023年1月20日天津大学生命科学学院刘夺团队在Biomaterials上发表题为“A red light-controlled probiotic bio-system for in-situ gut-brain axis regulation”的研究论文,该团队构建了一种新的红光介导的光遗传益生菌,并将该工程菌应用于药物递送和对宿主行为的调控,并证明光控益生菌可改善小鼠的帕金森氏病。

1
ROEN光遗传益生菌的构建
研究人员首先将E. coli DH5α菌株和由红光控制的细胞裂解酶基因X174E以及一种长效的胰高血糖素样肽-1受体激动剂—Exendin-4(Ex-4)进行融合,构建出能响应红光照射的大肠杆菌工程菌—ROEN(Red-light Optogenetic E. coli Nissle 1917)。ROEN可被635 nm波长的红光激活,通过细胞裂解酶基因X174E的表达促进细胞裂解并释放功能性蛋白(GFP或Ex-4),红光具有较少的光散射和吸收,将其与光感受器蛋白Cph8结合可使ROEN在深达3 cm的组织中仍被激活。
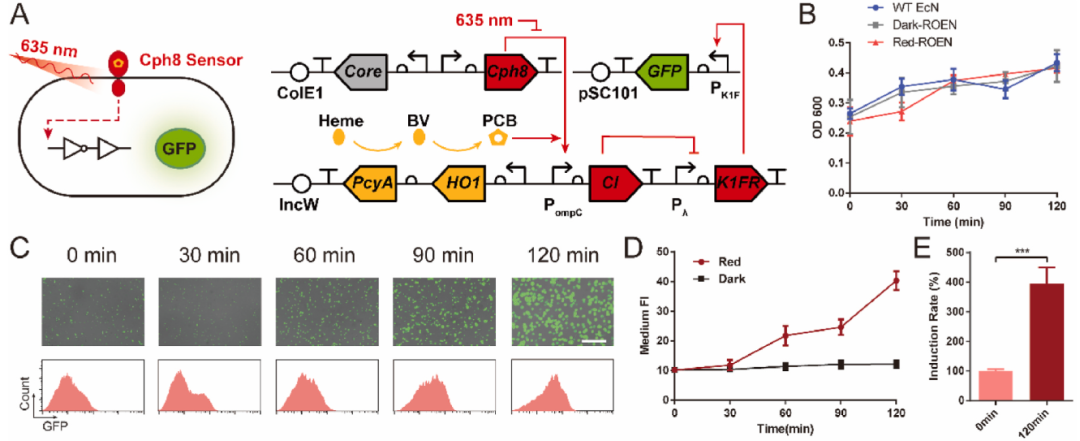
图1:ROEN光遗传益生菌的构建
2
ROEN光遗传益生菌高效释放生物活性的Ex-4
研究人员使用PC-12细胞进行体外培养,将红光照射的ROEN工程菌培养物离心过滤后的悬浮液加入PC-12细胞中。通过酶联免疫吸附(ELISA)实验发现ROEN工程菌悬浮液中的Ex-4蛋白表达水平显着升高,细胞cAMP浓度分析显示红光诱导表达的Ex-4可激活PC-12细胞并促进其生长。
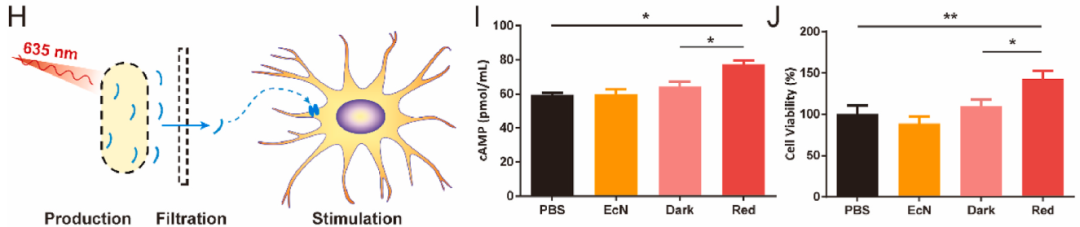
图2:ROEN光遗传益生菌释放的Ex-4激活神经元细胞
3
ROEN光遗传益生菌通过生物活性的Ex-4
改善小鼠帕金森病症状
将ROEN封装到海藻酸微胶囊中以克服胃酸环境,并通过灌胃将ROEN递送到小鼠肠道后在红光诱导下释放的Ex-4可通过肠屏障和血脑屏障进入循环系统和大脑。帕金森病(PD)小鼠模型中,经红光控制的ROEN给药后1个月,ELISA检测发现PD小鼠血清和大脑中表达有较高浓度的Ex-4,生化实验结果显示PD小鼠大脑中的α-突触核蛋白积累减少、炎症因子水平降低、多巴胺浓度升高。行为学检测发现PD小鼠的运动障碍、记忆衰退和焦虑症状均得到改善。
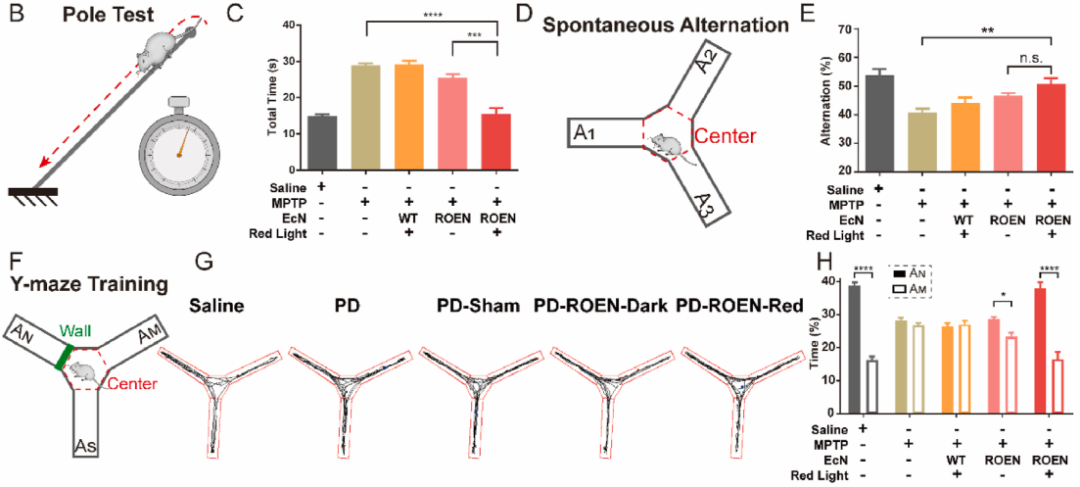
图3:ROEN光遗传益生菌通过生物活性的Ex-4改善小鼠帕金森病症状
总结
本文成功搭建了红光光遗传益生菌系统和基于该系统的新的药物递送平台,通过口服ROEN光遗传益生菌可在小鼠肠道中实现裂解和药物释放及对肠-脑轴的调节,并对帕金森病小鼠具有神经保护效应和行为改善作用。
原始出处:
Zhang XinYu, et al. A red light-controlled probiotic bio-system for in-situ gut-brain axis regulation. Biomaterials, 2023.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言