Front. Aging Neurosci:外源性α-syn诱导parkin下调导致神经细胞线粒体功能障碍
2022-09-16 brainnew神内神外 brainnew神内神外
帕金森病是一种广泛存在的神经退行性疾病,其主要病理改变是黑质致密部多巴胺能神经元进行性丢失、α-syn沉积在路易小体以及线粒体功能障碍。
帕金森病是一种广泛存在的神经退行性疾病,其主要病理改变是黑质致密部多巴胺能神经元进行性丢失、α-syn沉积在路易小体以及线粒体功能障碍。关于PD的发病机制,认为可能与氧化应激、钙稳态的破坏、泛素-蛋白酶体系统受损等生物学过程相关。大量研究表明,α-syn的错误折叠以及编码α-syn的SNCA基因突变与PD的发生发展密切相关,同时发现α-syn能以类似朊病毒的方式在细胞间进行传递,这可能促进了脑内神经变性过程。
另一方面,研究发现parkin突变或功能失活会导致错误折叠的蛋白聚集,这是因为在线粒体去极化时,parkin可以通过线粒体自噬过程介导有缺陷的线粒体降解。基于以上背景,值得深入研究α-syn与parkin之间的关系。因此来自德国的研究人员深入探讨了外源性α-syn是否可能是导致parkin相关线粒体损伤的触发因素。

1. α-syn通过下调parkin对线粒体生物能量学的影响
研究人员在PC-12细胞系上进行了下述研究,该细胞系能合成、储存和释放儿茶酚胺能,此外在使用神经生长因子(NGF)处理后,该细胞系能够表现出神经元特有的表型变化,因此PC-12细胞系常使用于神经生物学研究。
通过将人parkin基因转染进PC-12细胞系,并使用外源性α-syn处理,发现与转染空载体的对照细胞相比,转染了人parkin基因的PC-12细胞系的parkin合成量、膜电位以及ATP水平都显著升高;而使用α-syn处理在两种转染情况下均可以一定程度降低parkin合成量、膜电位去极化水平和ATP水平。另一方面,敲除parkin后进行上述指标的测量,发现与对照组相比,parkin敲除组的parkin合成量、膜电位以及ATP水平也有所降低。
随后,研究人员评估了线粒体活性氧水平,与转染空载体的对照细胞相比,转染了人parkin基因的PC-12细胞系的线粒体活性氧水平明显降低;而使用α-syn处理可使线粒体活性氧水平升高,同时敲除parkin基因也能够达到类似的效果。
上述结果提示在外源性α-syn处理后,神经细胞线粒体活性的各种功能缺陷和线粒体氧化还原稳态的破坏与parkin水平的降低直接相关。

图1:α-syn介导的parkin耗竭是PC-12细胞线粒体功能障碍的原因
2. parkin在α-syn破坏线粒体网络调控中的作用
线粒体是高度移动、动态的细胞器,根据细胞的能量需求经历连续的融合、分裂周期,因此线粒体网络的形成过程能够反映细胞应激的过程。研究人员通过观察线粒体形态,发现与对照组相比,α-syn处理诱导了明显的线粒体断裂;而在转染人parkin基因的PC-12细胞中,则观察到了线粒体网络“中间”形状的形成——混合了管状和球形线粒体。进一步量化线粒体形态的结果,发现α-syn处理可导致线粒体明显变短和分支减少,而parkin的稳定过表达显著恢复了线粒体的分支。

图2:α-syn介导的parkin耗竭是PC-12细胞线粒体形态改变的原因
3. parkin在α-syn诱导的线粒体自噬和线粒体生物发生丧失中的作用
已有的文献表明,parkin在线粒体自噬过程中发挥着关键作用。通过检测自噬体和溶酶体含量,发现α-syn处理影响线粒体自噬水平,同时parkin过表达诱导α-syn处理的PC-12细胞系线粒体p62明显增加。总的来说,α-syn处理可损害线粒体自噬功能。
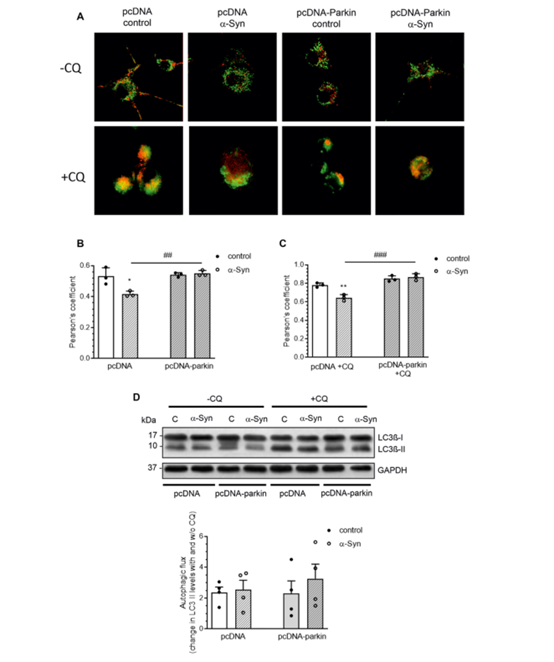
图3:α-syn影响parkin介导的线粒体自噬
4. 总结
综上所述,研究人员证明了α-syn导致的parkin功能丧失是破坏线粒体自噬生物学过程的原因,该过程的破坏进一步导致了功能障碍线粒体的积累而放大α-syn的毒性。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#外源性#
76
#线粒体功能#
75
#ROS#
75
#功能障碍#
66
#神经细胞#
0
#线粒体功能障碍#
78