人类基因组计划(HGP)揭示了人类基因组的大量信息,并大大增强了其在生物医学研究发展中的作用。由于下一代测序技术的进步,研究人员已经能够揭示一些遗传因素在许多疾病中的作用,如癌症、类风湿性关节炎、帕金森病和阿尔茨海默病。
此外,许多研究的成果已经揭示了编码和非编码RNA(ncRNAs)的重要作用,如miRNA、长ncRNAs(lncRNA)、circRNA和siRNAs。这为通过将核酸引入细胞以永久或瞬时控制改变基因的表达来开发各种疾病的可能治疗方法奠定了基础。此外,通过各种递送系统的开发可以将RNA运送到目标位点,解决了RNA固有的不稳定性带来的问题。因此,许多涉及siRNA、ASO、核酶、mRNA、适配体和CRISPR/Cas的基于RNA的疗法已经开发出来,并正在各种疾病中进行临床试验。基于RNA的药物展现出卓越的应用潜力。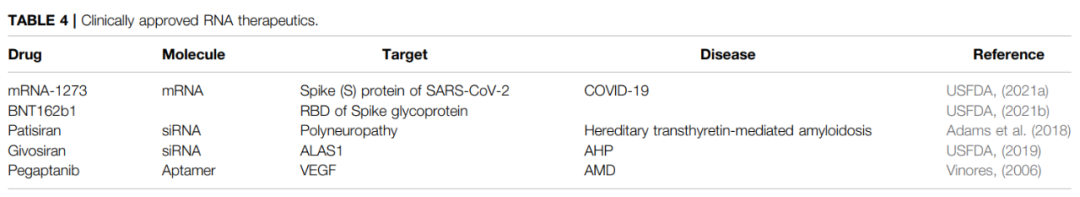
siRNA是由核糖核酸酶Dicer通过内切过程产生的,这是一种属于RNase III家族的内切酶,可以产生21-25核苷酸双链RNA。一旦产生,Dicer将siRNA转移到RNA诱导沉默复合物(RISC),该复合物包含降解靶mRNA分子的Argonaute 2。由于siRNA的这种能力,它们被作为一种可能的治疗方法。
SiRNA疗法正在多种癌症治疗中进行测试。siG12D-LODER是一种可生物降解的聚合物基质,含有针对KRASG12D的siRNA,临床研究(NCT01188785)表明,该聚合物能够靶向肿瘤并抑制肿瘤进展。目前,正在进行进一步的研究(NCT01676259),以测试siG12D-LODER与化疗药物(如吉西他滨和nab紫杉醇)联合治疗局部晚期胰腺癌患者的疗效。
Polo样激酶(PLK)参与细胞周期调节和细胞增殖并通常在癌细胞中过表达,抑制Plk可减少癌细胞增殖。TKM-080301是一种脂质纳米颗粒(LNP)制剂,由四种脂质和一种针对人类PLK1 mRNA的合成双链siRNA组成。静脉输注TKM-080301显示出良好的耐受性,但在晚期肝细胞癌患者中仅显示出有限的抗肿瘤作用,且没有总体生存效应。然而,TKM-080301在肾上腺皮质癌(ACC)中显示出一定的肿瘤抑制作用。
蛋白激酶N3(PKN3)是磷酸肌醇-3-激酶(PI3K)途径的下游效应器,阻断PKN3可以抑制肿瘤进展和淋巴结转移。Atu027,一种脂质体PKN3 siRNA制剂,在晚期实体瘤患者中安全性良好,在治疗结束时,41%的受试者病情稳定。在随后的研究中,Atu027和吉西他滨联合治疗局部晚期或转移性胰腺癌显示出良好的安全性和耐受性。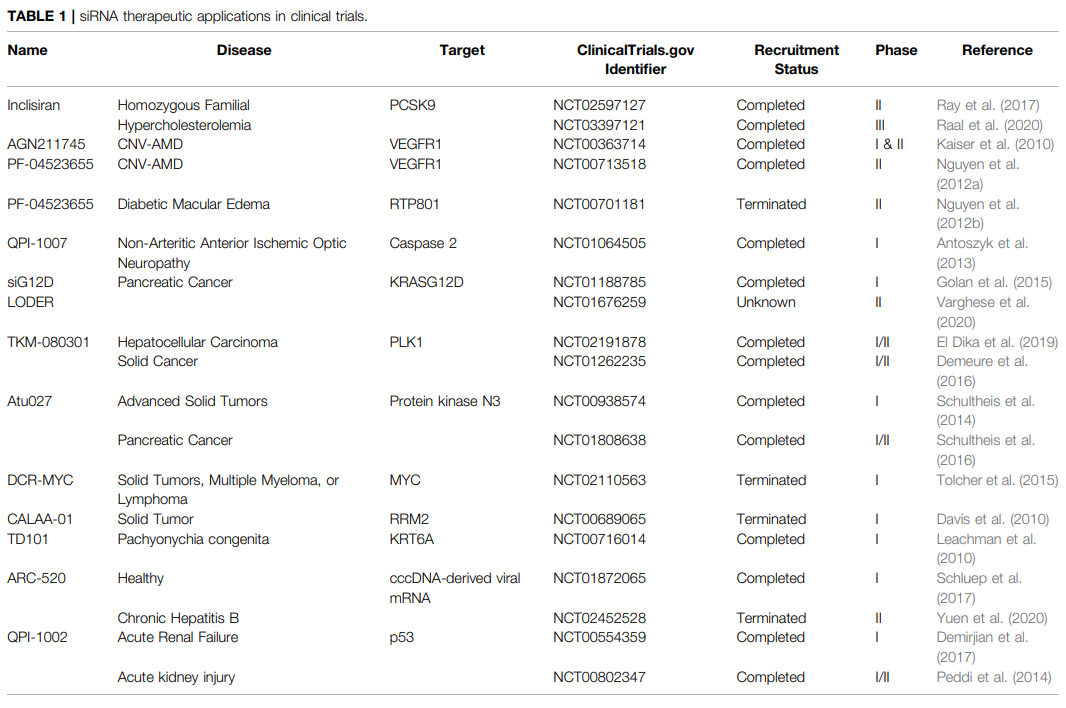
除了癌症领域,SiRNA在其它疾病领域的应用也在积极开发。Inclisiran,是一种硫代磷酸酯、2′-O-甲基核苷酸和2′-氟核苷酸修饰的siRNA,靶向PCSK9,皮下注射已证明可降低高心血管风险患者的PCSK9水平和LDL胆固醇水平。并且仅半年注射一次,显示出极佳的患者依从性。2020年12月11日,Inclisiran获欧盟批准上市。
许多siRNA研究针对年龄相关性黄斑变性(CNV-AMD)引起的脉络膜新生血管,以血管内皮生长因子受体-1(VEGFR1)或RTP801为靶点的研究,在临床试验的各个阶段都显示了有希望的结果,如AGN211745和PF-04523655。此外,QPI-1007,一种抑制caspase 2表达的siRNA,在视神经萎缩患者中显示出良好的耐受性和视力的改善。
此外,包括常染色体隐性遗传原发性高草酸尿症(PHs)、乙型肝炎病毒(HBV)和肝脏和特发性肺纤维化中,SiRNA疗法均展现出良好的应用前景。
反义核酸(ASO)是18-30个碱基对的单链RNA/DNA分子,设计用于特异性抑制mRNA功能。它们与特定mRNA互补结合,通过RNase H阻碍mRNA翻译或降解mRNA。
ASO在眼部疾病的治疗,许多临床前和临床试验都显示了有希望的结果。Leber先天性黑矇(LCA)由于包括中心体蛋白290(CEP290)在内的各种基因的内含子突变,导致视网膜营养不良,引起青少年失明或严重视力损害。QR-110是一种单链、硫代磷酸化、2′O-甲基修饰的剪接调节RNA寡核苷酸,用于靶向CEP290。临床研究(NCT03140969和NCT03913143)显示,玻璃体内注射QR-110可以重建LCA患者成纤维细胞中的CEP290水平,并具有良好的耐受性和安全性。
适配体是结合和抑制蛋白质的单链核酸(DNA或RNA)分子。适配体形成形状的能力提供了对目标的高亲和力和极好的特异性,由于其作用模式与抗体相似,适配子也被称为化学抗体。目前,多种适配体已进入各种疾病的临床试验,如黄斑变性、糖尿病性黄斑水肿和慢性炎症性疾病。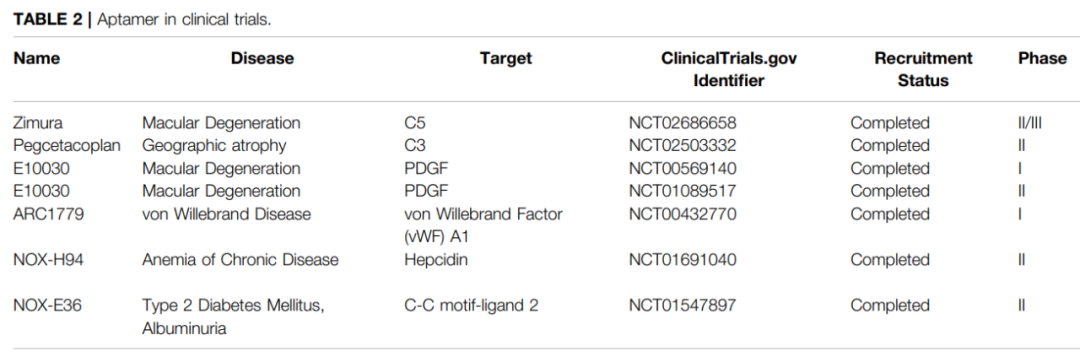
EYE001是VEGF的聚乙二醇化适配体,在体外模型中显示出完全减少VEGF介导的血管渗漏、抑制视网膜新生血管的能力,从而改善视力。在CNV-AMD患者中进行的EYE001单用或联合光动力疗法的研究中显示出明显的视力稳定或改善。
除了VEGF外,补体途径在AMD中也起着重要作用。Zimura,一种聚乙二醇化的单链核酸适配体靶向补体因子C5以及pegcetacoplan靶向C3和C3b,它们的临床研究表明,皮下注射能够减少继发于AMD的地图样萎缩(GA),而不会发生不良事件。
此外,ARC1779是一种靶向vWF A1结构域的适配体,在临床试验(NCT00632242)中,ARC1779显示出良好的耐受性以及抑制血栓性血小板减少性紫癜患者vWF依赖性血小板功能的能力。Emapticap-pegol(NOX-E36)是一种靶向CCL2的适配体,在伴有蛋白尿的2型糖尿病患者中,皮下注射Emapticap显示出良好的耐受性和抑制CCL2/CCL2受体轴的能力。
核酶是催化RNA的分子,与靶RNA杂交并导致RNA降解,从而抑制特定蛋白质的产生。重要的是,核酶可以在没有细胞蛋白的情况下发挥作用。
RPI.4610(Angiozyme)是一种化学稳定的抗VEGFR-1核酶,与卡铂和紫杉醇联合用于晚期实体瘤患者,已证明具有良好的安全性、生物利用度和肿瘤定位能力。然而,它未能在转移性乳腺癌患者中证明临床疗效。
OZ1是tat-vpr特异性抗HIV核酶,通过自体CD34+细胞递送,在临床试验(NCT00074997)中显示CD4+淋巴细胞显著增加,表明细胞递送的基因转移在维持核酶的安全性和活性方面同样可靠。
尽管在许多临床试验中取得了成功,但也有一些研究报告表明缺乏有效性和安全性,例如胃肠道癌患者中靶向人类端粒酶逆转录酶(hTERT)编码RNA的Ad5CRT、转移性乳腺癌患者中的血管酶或嵌合核酶。因此,核酶在稳定性、体内活性、共定位、输送到特定细胞以及持续稳定和长期表达方面仍需改进。
以mRNA为基础的治疗代表了一个相对新颖和高效的药物类别。最近发表的几项研究强调了mRNA疫苗在治疗不同类型的恶性肿瘤和传染病方面的潜在疗效,这些疾病中传统的疫苗策略不能引起保护性免疫反应。
传染病疫苗是目前mRNA疗法中最领先的应用。Moderma和辉瑞的新冠疫苗已经在数十亿人群中证明了安全性和有效性,展现出未来强大的应用前景,这里不多赘述。(参阅<mRNA疫苗在感染性疾病的研究进展>)
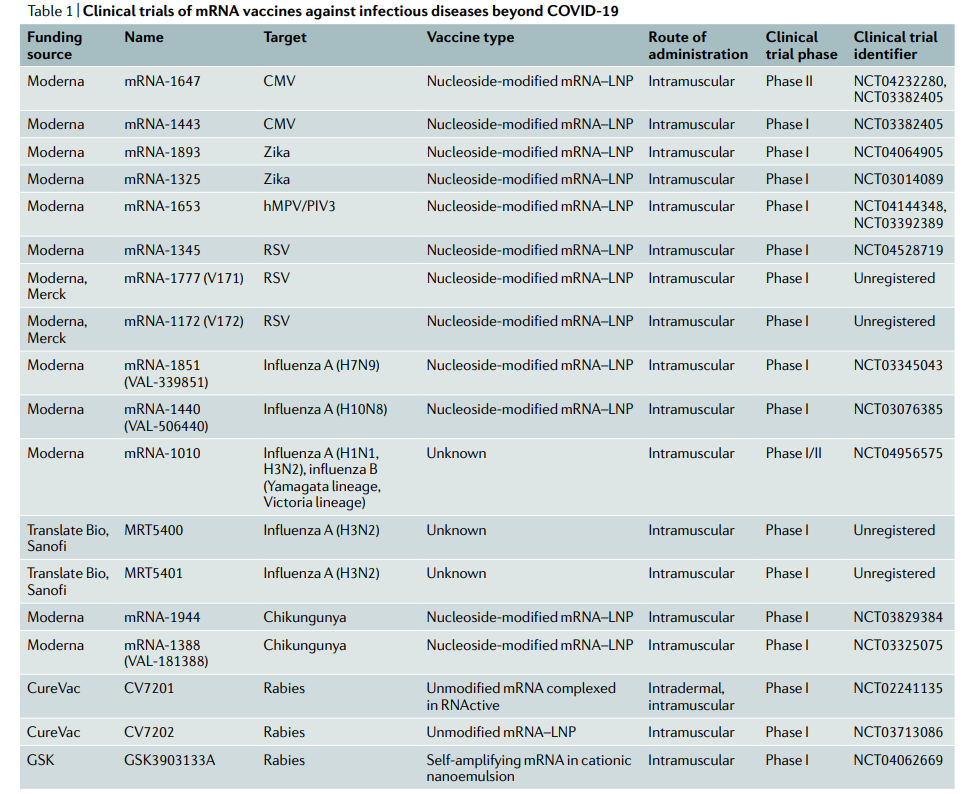
目前,针对肿瘤的mRNA疫苗有2种方式:i)使用体外负载或电穿孔的DC,ii)通过直接注射带有或不带有载体的mRNA。
在癌症患者中应用了几项基于DC的mRNA疫苗的临床试验,用编码黑色素瘤相关抗原的mRNA与TriMix联合接种导致晚期黑色素瘤令人印象深刻的肿瘤消退。目前mRNA疫苗正在向联合治疗方法发展,包括化疗、放疗和检查点抑制剂。其中一些研究产生了持久的肿瘤生长抑制。尽管这些基于DC的方法是有效的,但是它们也受限于繁琐的程序和高昂的成本。
相比之下,直接注射裸mRNA或复合mRNA被认为是一种快速有效的可行方法。例如,一项I/II期试验在30例转移性肾细胞癌患者皮内反复应用编码6种不同TAA(MUC1、CEA、Her2/neu、telomerase、survivin、MAGE-A1)的mRNA疫苗。10年后的长期结果表明,mRNA疫苗是安全有效的。它延缓了肿瘤生长并提高了生存率,这与检测到的针对TAAs的免疫反应密切相关。
另一项研究中,7名局部晚期患者和39名转移性NSCLC患者接受了5次皮内注射CV9201,这是一种编码5种NSCLC抗原(NY-ESO-1、MAGE-C1/2、survivin、5T4)的活性疫苗。63%的患者产生了针对至少一种抗原的抗原特异性免疫应答,60%的患者表现出激活的IgD+CD38high B细胞增多。31%的患者疾病稳定(SD),另外三分之二的患者病情进展。一项旨在提高抗肿瘤免疫力的类似研究检测了晚期NSCLC患者接种CV9202联合局部放疗的情况。
CV9202是一种基于RNA的活性疫苗,编码6种NSCLC TAA(NY-ESO-1、MAGE-C1、MAGE-C2、5T4、survivin和MUC-1)。与基线相比,大多数患者的抗原特异性细胞免疫和体液免疫增强。一名接受疫苗、放疗和化疗的患者出现部分缓解(PR),46.2%的患者获得SD。
mRNA-4157疫苗是美国Moderna公司研发的一款mRNA疫苗,它是一种针对每位肿瘤患者量身定制的个体化肿瘤疫苗,目前mRNA-4157癌症疫苗能够容纳高达34个编码新抗原的mRNA序列。在mRNA-4157联合Keytruda的I期临床试验中,13例接受单药治疗的患者中有11名患者保持疾病稳定。在联合治疗组中,20例患者中有6例获得响应,其中包括1例完全缓解和5例部分缓解。6名患者疾病稳定,8名病情恶化。与mRNA-4157相关的所有不良事件都是可逆的,并且是轻微的。没有观察到与治疗有关的≥3级不良事件,证明了疫苗的安全性和耐受性。目前,有多项肿瘤mRNA疫苗处于临床招募阶段。
CRISPR- Cas9系统是一种细菌防御机制,利用引导RNA(gRNA)介导DNA内切酶Cas9在靶DNA中引入位点特异性断裂。这种DNA编辑能力使得CRISPR-Cas9通过合成sgRNA在基因组修饰中用作RNA治疗剂,用于生物和治疗应用。
许多研究表明CRISPR/Cas9可用于治疗遗传性疾病,如囊性纤维化(CF)、杜氏肌营养不良症(DMD)、血红蛋白病以及HIV和β-地中海贫血。在一项研究中,CRISPR/Cas9能够增加肌管中的utrophin数量并去除重复的DMD外显子18–30,从而在DMD中产生全长dystrophin。
在β-地中海贫血中,人类血红蛋白β(HBB)基因的突变可以通过CRISPR/Cas9纠正。通过piggyBac转座子,患者来源的IPSC中的CRISPR/Cas9有效地纠正了HBB突变,而不影响IPSC的多能性,并在分化为红细胞时恢复了HBB的表达。此外,CRISPR-Cas9的类似应用也已在艾滋病等免疫疾病中得到证实。
尽管这些研究为未来的CRISPR-Cas9临床试验提供了基础,但在CRISPR/Cas9进一步应用于临床试验和随后的治疗之前,仍有一些挑战有待解决。包括向靶细胞递送基因编辑工具可能的靶外效应。此外,在将CRISPR-Cas9转化为治疗应用之前,还需要考虑CRISPR-Cas9的伦理问题和种系应用。
近年来,以RNA为基础的疗法逐渐成为各种疾病的潜在干预策略。一般来说,RNA疗法根据其作用方式和使用的分子分为不同的类别。许多RNA疗法已被开发用于各种疾病,并且在许多临床前和临床研究中获得非常有希望的结果,尤其是mRNA疫苗成为目前最火热的研究领域之一。目前,基于RNA的疗法依然存在许多障碍,包括递送系统在内的许多方面仍需要得到进一步的研究和开发,然而不可否认,未来十年属于RNA治疗的时代终将到来。
参考文献:
1.RNA Therapeutics - Research and Clinical Advancements. Front Mol Biosci. 2021; 8: 710738.
2. mRNA vaccines for infectious diseases: principles, delivery and clinical translation. Nat RevDrugDiscov. 2021 Aug 25 : 1–22.
3. Clinical and immunological effects of mRNA vaccines inmalignant diseases. Mol Cancer. 2021 Mar 15;20(1):52.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言