Cell:瞬时受体电位通道5(TRPC5)的缺失导致肥胖和产后抑郁
2024-08-15 Hanson临床科研 Hanson临床科研 发表于上海
研究结果表明,TRPC5基因的缺失在人类和小鼠中引起肥胖、焦虑、自闭症和产后抑郁。
下丘脑是大脑中一个关键的区域,它负责调节多种本能行为和生理功能,如食物摄入、能量平衡、应激反应、社交行为以及母性行为等。这些行为和功能对于生物体适应环境、保证生存和繁衍后代至关重要。然而,尽管下丘脑的功能至关重要,科学家们对于其具体的工作机制,尤其是如何将内部状态和外部环境的变化转化为具体行为的神经机制,仍然缺乏深入的理解。
近年来,随着分子生物学和遗传学的发展,研究者们开始识别和研究那些可能参与下丘脑功能调控的关键基因和蛋白质。其中,瞬时受体电位通道5(TRPC5)作为一种在大脑中表达的阳离子通道,因其在感知感觉刺激并将其转化为大脑可解释的电信号中的作用而受到关注。TRPC5通道的异常表达或功能丧失与多种行为和情绪障碍相关,包括肥胖、焦虑、自闭症和产后抑郁等。
在人类和小鼠中,TRPC5基因的缺失或突变被发现与上述行为和情绪问题有关。这些发现提示TRPC5可能在调节本能行为和情绪反应中发挥着关键作用。因此,深入研究TRPC5的功能及其在下丘脑中的作用机制,不仅有助于我们理解本能行为的神经基础,也为开发治疗相关疾病的新策略提供了可能。
2024年7月2日,贝勒医学院 徐勇 教授团队联合剑桥大学代谢研究实验室 I. Sadaf Farooqi 在国际著名期刊 Cell 上发表了题为 Loss of Transient Receptor Potential Channel 5 Causes Obesity and Postpartum Depression 的研究论文【1】。
-
研究结果表明,TRPC5基因的缺失在人类和小鼠中引起肥胖、焦虑、自闭症和产后抑郁。
-
TRPC5通过作用于下丘脑的Pomc和催产素神经元,调节本能行为,如进食、唤醒、社交互动和母性关怀,这些行为对生存至关重要。

主要结果
TRPC5缺失的影响:
-
与肥胖相关:研究发现,在人类中,TRPC5基因的缺失与肥胖、焦虑、自闭症和产后抑郁有关。在小鼠模型中,携带人类TRPC5基因失功能(LoF)突变的雄性小鼠表现出了类似的体重增加和肥胖表型。
-
行为异常:TRPC5基因缺失的男性人群和雄性小鼠表现出食物寻求、焦虑和自闭症样行为。此外,TRPC5缺失的女性小鼠在产后表现出抑郁样行为和对后代照顾能力受损。
-
与社会行为和母性行为的关系:TRPC5在OXT神经元中的缺失导致小鼠的社会行为和母性行为受损,包括焦虑样行为增加、社交性降低和母性关怀能力下降。
TRPC5的作用:
-
在下丘脑中的作用:研究表明TRPC5在下丘脑的促肾上腺皮质激素原(Pomc)神经元和催产素(OXT)神经元中发挥作用,这些神经元群体对于调节食物摄入、唤醒、社交互动和母性关怀等本能行为至关重要。
-
对食物摄入的调节:使用药理学激活剂BTD(一种TRPC5激动剂)在小鼠中显示出降低食物摄入和体重的作用,这表明TRPC5通过Pomc神经元调节食欲。
-
在催产素神经元中的特定作用:从PVH(视上核)OXT神经元中删除Trpc5的小鼠表现出严重的肥胖和产后抑郁行为,而Trpc5在这些神经元中的过度表达则逆转了这些表型。
TRPC5的恢复改善了行为和代谢表型:
在Trpc5K34del小鼠模型中,通过病毒介导的TRPC5在PVH OXT神经元中的过度表达,可以显著改善肥胖、焦虑和产后抑郁样行为。
研究结果提示,TRPC5可能是治疗肥胖、焦虑、自闭症和产后抑郁等复杂疾病的潜在靶点。为理解相关疾病的神经生物学机制提供了新的视角,并可能有助于开发新的治疗策略
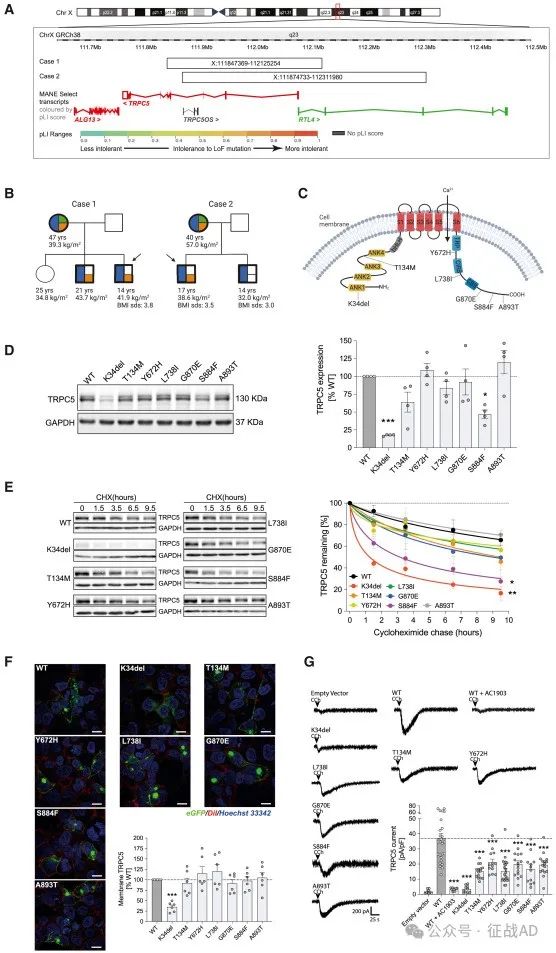
图1. TRPC5变异在严重肥胖人群中的鉴定
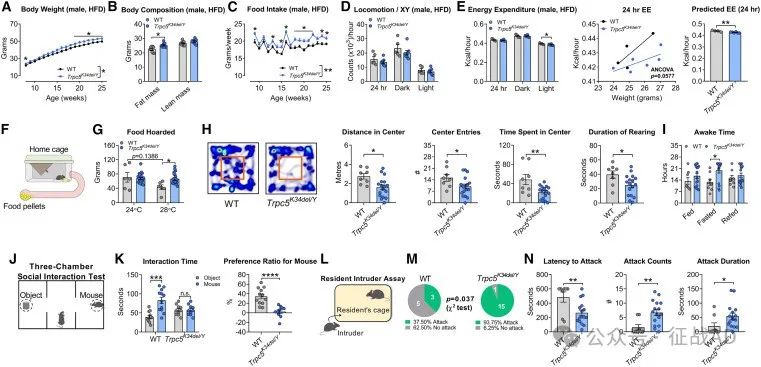
图2. 雄性Trpc5K34del/Y杂合小鼠的代谢和行为表型
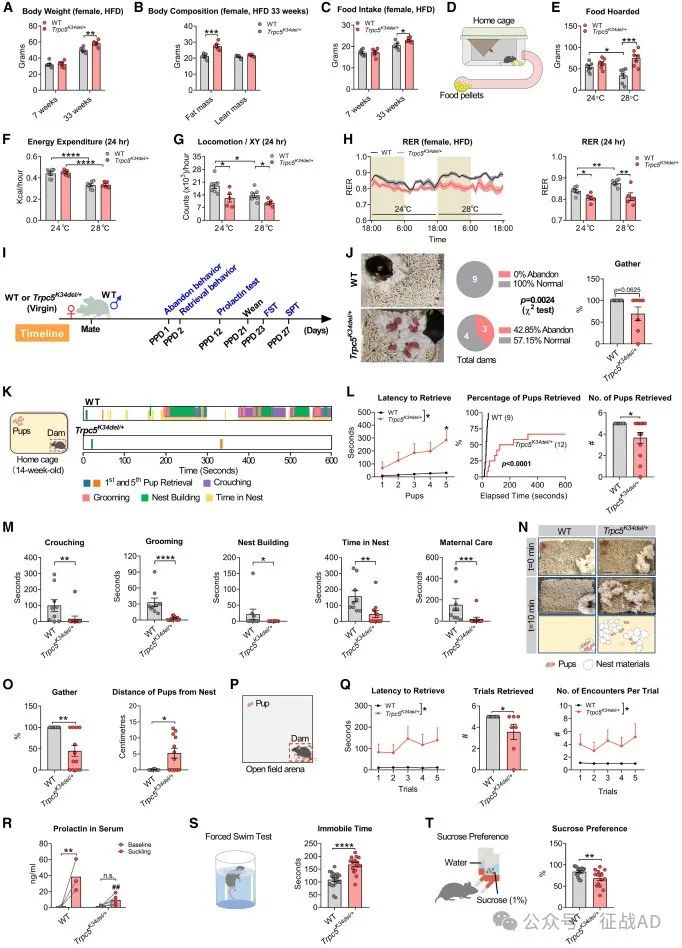
图3. 雌性Trpc5K34del/+杂合小鼠的代谢和行为表型
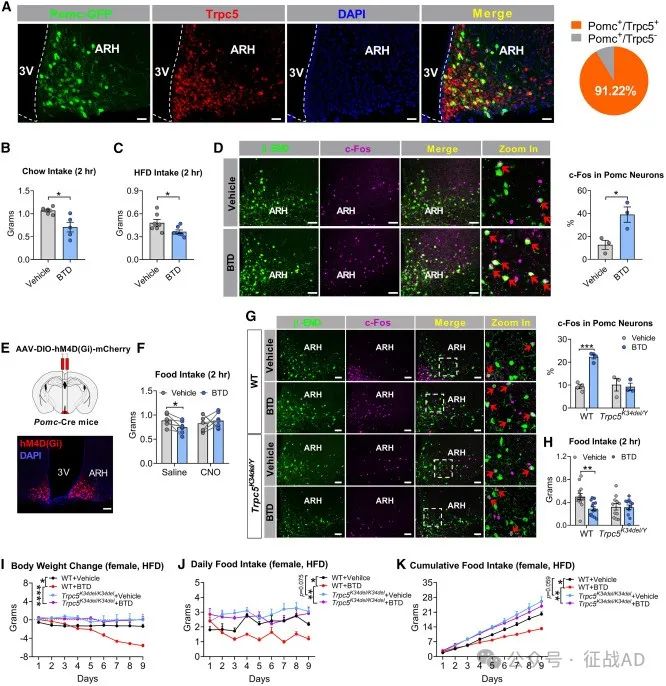
图4. Trpc5缺乏损害了由Pomc神经元介导的厌食效应
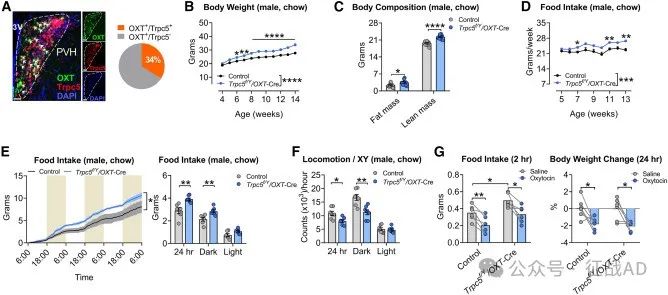
图5. OXT神经元中Trpc5的缺失对代谢的影响
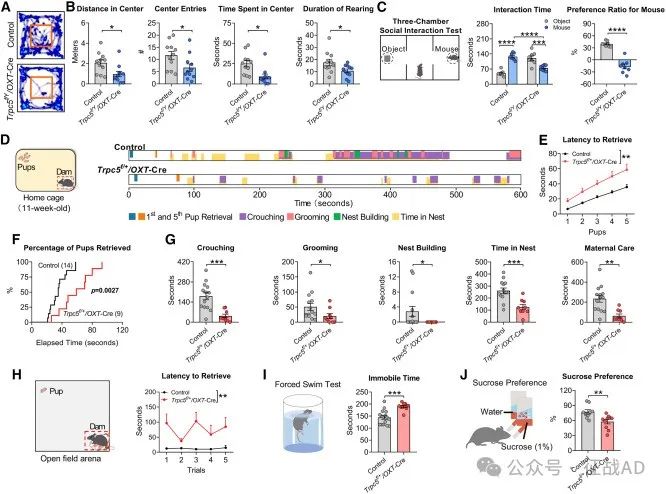
图6. OXT神经元中Trpc5的缺失对行为的影响
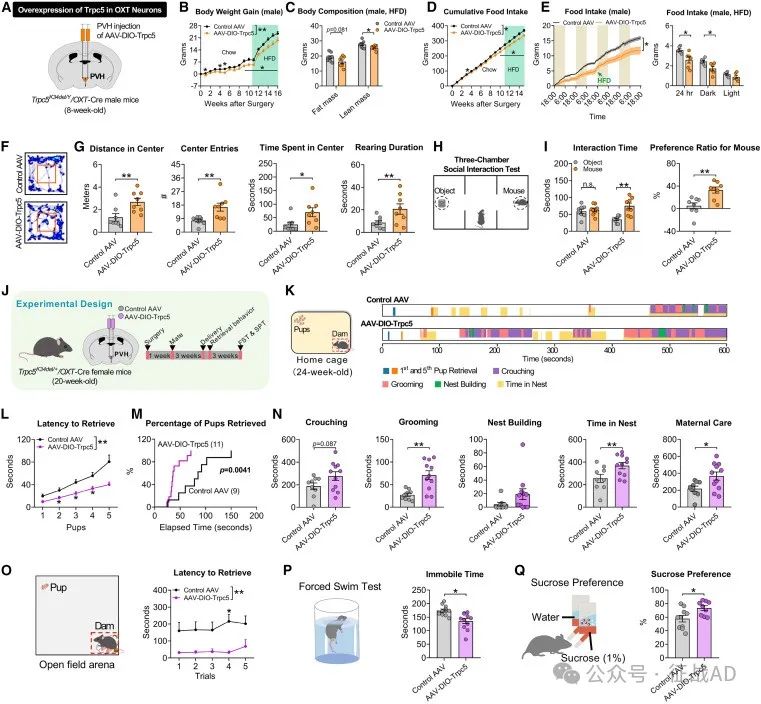
图7. 在PVH OXT神经元中恢复Trpc5逆转了Trpc5缺乏的特征
编者按:
临床意义和科研启发:
本文的研究揭示了TRPC5基因在调节人类和小鼠的本能行为及情绪反应中的关键作用,其缺失或功能异常与肥胖、焦虑、自闭症以及产后抑郁等临床症状紧密相关。
这些发现不仅为医生和科学家提供了新的生物标志物,有助于更准确地诊断这些疾病,而且为开发针对性的治疗方法,如MC4R激动剂治疗肥胖、OXT受体激动剂或基因疗法恢复下丘脑特定区域的TRPC5表达,提供了潜在的新策略。
此外,研究结果还强调了个性化医疗的重要性,提示通过了解TRPC5在不同个体中的作用,可以为患者定制更加个性化的治疗方案。
同时,本文启示未来需要开展对TRPC5分子机制的进一步研究、探索基因与行为的关联、开发调节TRPC5活性的新药物、研究TRPC5在特定神经回路中的功能、进行跨物种比较研究、以及研究环境因素如何影响遗传疾病的表达等,为未来的医学研究和临床实践提供了广泛而深入的洞见。
期待更多类似高质量研究,给患者带来更优的临床诊疗策略。
原文链接:
https://doi.org/10.1016/j.cell.2024.06.001
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#下丘脑# #产后抑郁# #TRPC5#
35