Nature子刊:中山大学高旻/黎小妍合作揭示肥胖及相关代谢疾病治疗新靶点
2023-02-08 生物世界 生物世界 发表于上海
这项研究表明,靶向脂肪组织TRPM7的治疗方法可能是治疗肥胖、胰岛素抵抗及其相关代谢性并发症的有潜力的新策略。
肥胖(Obesity)是以脂肪组织扩张并贮存过量甘油三酯为特征的慢性代谢性疾病,现已于全球流行并严重威胁人类健康,而肥胖及超重伴发多种代谢相关并发症,包括2型糖尿病、动脉粥样硬化、高血压、非酒精性脂肪肝等,相当程度的降低生活质量。
2023年1月30日,中山大学附属第六医院高旻副主任药师、黎小妍主任药师合作,在 Nature 子刊 Nature Communications 发表了题为:Adipose-specific deletion of the cation channel TRPM7 inhibits TAK1 kinase-dependent inflammation and obesity in male mice 的研究论文。
该研究揭示了TRPM7-Ca2+-TAK1信号紊乱在肥胖过程中脂肪组织炎症中的重要作用,证实了脂肪细胞TRPM7通过介导Ca2+内流调控TAK1-NFκB炎症通路,有效启动炎症因子转录,从而促进脂肪组织炎症,并诱导系统性胰岛素抵抗和其他肥胖并发症的发生。
这项研究表明,靶向脂肪组织TRPM7的治疗方法可能是治疗肥胖、胰岛素抵抗及其相关代谢性并发症的有潜力的新策略。

越来越多证明表明,肥胖诱导机体的慢性、低水平炎症状态,与胰岛素抵抗程度密切相关,脂肪组织炎症是此过程的关键起始环节。TRPM7为非选择性阳离子通道,对多种生理及病理过程具有调控作用,包括炎症信号调控,但大多数TRPM7参与的炎症反应调控研究多集中于免疫细胞。
在这项研究中,研究团队发现,肥胖小鼠脂肪细胞TRPM7表达及活性均上调,继而构建TRPM7脂肪细胞特异性敲除小鼠,发现TRPM7脂肪敲除具有改善糖耐量及胰岛素抵抗的作用,并抵抗高脂诱导的肥胖,与抑制脂肪组织炎症反应相关。该研究进一步证实,TAK1作为TRPM7-Ca2+信号的下游调控TRPM7介导的脂肪细胞炎症反应。于此基础上,研究团队在体给予TRPM7抑制剂,证实了药理学阻断TRPM7具有缓解脂肪组织炎症及胰岛素抵抗的作用。
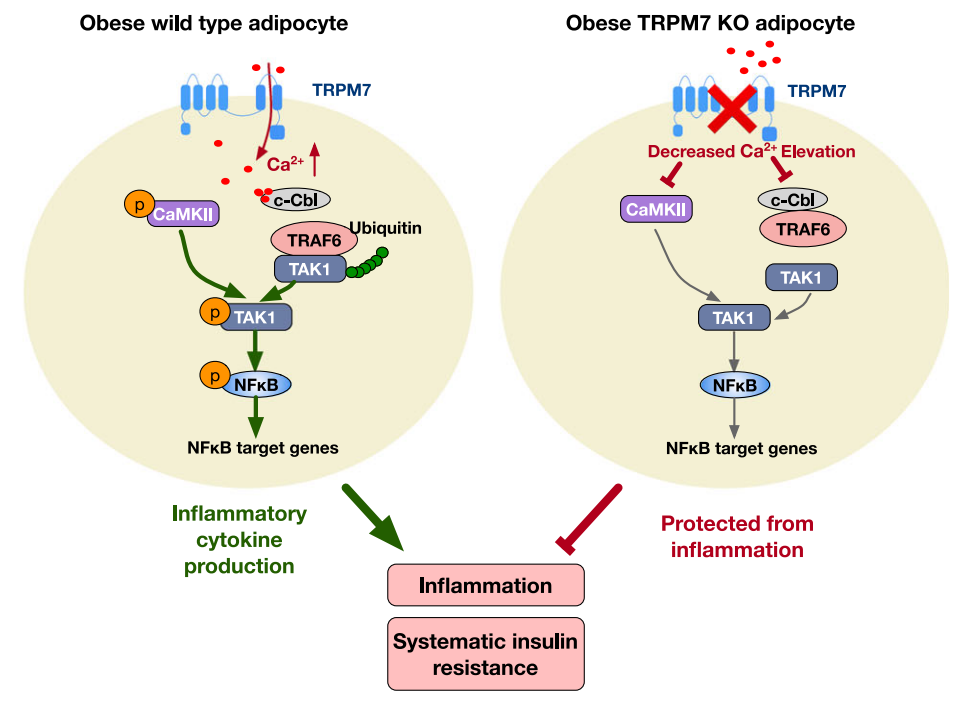
综上所述,该研究揭示了TRPM7-Ca2+-TAK1信号在肥胖过程中脂肪组织炎症的作用,靶向脂肪组织TRPM7的治疗方法可能是治疗肥胖、胰岛素抵抗及其相关代谢性并发症的具有潜力的新策略。
论文链接:
https://www.nature.com/articles/s41467-023-36154-3
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













好文章,谢谢分享。
83