AMERICAN JOURNAL OF SURGICAL PATHOLOGY:对实体瘤异质性错配修复表达的全面研究揭示了不同的免疫组化模式和不同的遗传机制
2023-12-04 Jenny Ou MedSci原创 发表于上海
本文发现强调了准确解释异质MMR蛋白染色模式对于制定更有效的个性化遗传调查策略的重要性。
DNA不匹配修复(MMR)在确保DNA复制保真度和维持基因组稳定性方面发挥着关键作用。由于生殖系突变、体细胞突变或表观遗传沉默导致MMR基因(MLH1、MSH2、MSH6、PMS2、EPCAM)失活可能导致MMR系统(dMMR)缺陷,并导致高级微卫星不稳定的表型。测试dMMR/高级微卫星不稳定性是预先筛查林奇综合征相关癌症易感性的主要策略,已建议所有新诊断的结直肠癌和子宫内膜癌患者使用。
MMR表达的免疫组织化学(IHC)分析是一种易于执行且具有成本效益的方法,在临床实践中广泛采用。传统上,当4种MMR蛋白(MLH1、MSH2、MSH6、PMS2)中的任何一种在肿瘤细胞中表现出核染色完全丧失时,就表明dMMR状态。虽然在大多数情况下对染色结果的解释很简单,但随着MMR IHC测试的广泛应用,各种MMR IHC表型已经出现,可能会遇到挑战。一个独特的是异质MMR表达(MMR-het),其特征是肿瘤区域完整染色,相邻的尖锐划分区域突然失去染色。
MMR-het肿瘤在以前的研究中偶尔被描述,如具有异质损失MSH6的结直肠癌(CRCs)和异质损失MLH1/PMS2.7的子宫内膜癌(EC)除了与技术问题或新辅助治疗相关的伪影物外,还提出了几种可能的解释,主要包括异质性二次命中突变和肿瘤区域不同水平的MLH1启动子甲基化。然而,不同的MMR-het模式和各自的遗传机制可能对后续测试策略和免疫治疗具有重要意义,尚未得到充分探索。
之前的研究揭示了dMMR结直肠癌亚群之间的遗传特征不同,并强调dMMR肿瘤代表了一个具有高分子异质性的群体。2023年11月24日发表在AMERICAN JOURNAL OF SURGICAL PATHOLOGY的文章,进一步关注了一小部分表现出异质MMR表达的dMMR肿瘤,描绘了各种MMR染色模式,并通过全面的基因组分析(CGP)分析了潜在的遗传改变以及肿瘤突变负担(TMB)。本文目标是发现这个罕见但独特的dMMR肿瘤子集的MMR表达模式和分子机制的多样性和异质性,这可能会指导MMR IHC的解释,并对个性化临床决策产生重要影响。

在这项研究中,描述了不同解剖部位的40个肿瘤的MMR-het模式,并通过全面的基因组分析分析了MMR遗传改变和肿瘤突变负担(TMB)。研究结果显示,MMR-het模式分为4个子组:“单损失”(3例)、“MLH1/PMS2双损失”(16例)、“MSH2/MSH6双损失”(8例)和“三重/四损失”(13例)。17例MMR-het病例表现出组织学异质性,其中MMR蛋白损失通常仅限于分化差或分化良好的肿瘤区域。所有“单损”肿瘤都有MMR体细胞突变和共存的POLE外切酶结构域突变。
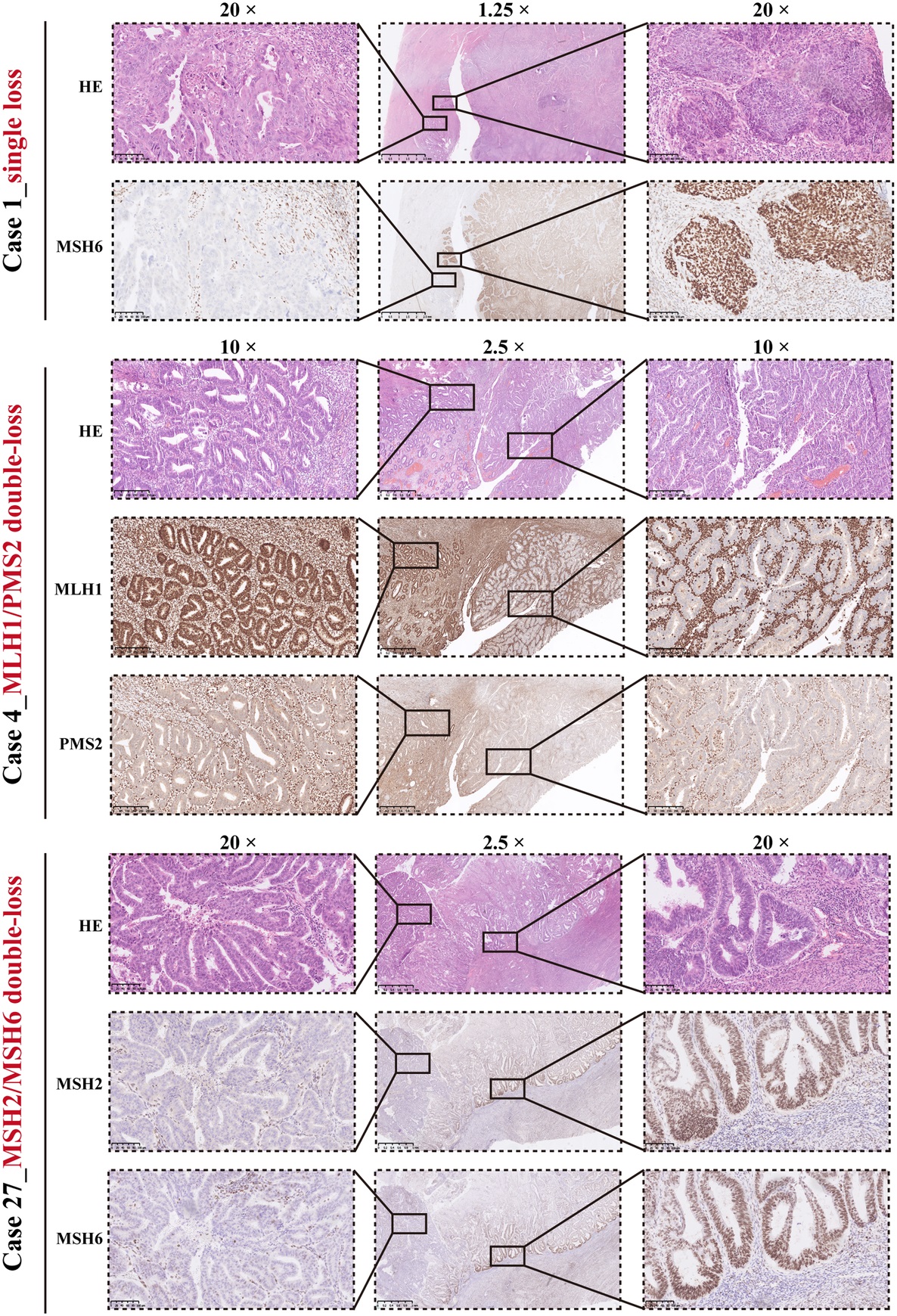
单损和双损子组
“MLH1/PMS2双损失”肿瘤毫无例外地隐藏着MLH1高甲基化,没有MMR生殖系突变。在“MSH2/MSH6双损失”亚组中,4例有MSH2/MSH6生殖系突变,另有4例有多个MSH2/MSH6体细胞突变。在2例中发现了额外的POLE外切酶结构域突变。
“三重/四体丧失”亚组的肿瘤通常具有MLH1异常(8MLH1高甲基化、4MLH1生殖系突变、1 MLH1双体细胞突变)和MSH2/MSH6上的共存体细胞突变。31例(83.8%)是TMB-H,所有POLE突变病例都表现出超高TMB(111.4至524.2mut/Mb)。
综上所述,本文系统地将不同的MMRhet表型分为4个亚组,这些亚组的特点是不同的遗传机制和解剖部位偏好。对异质MMR蛋白染色模式的准确解释可以指导更有效的分子测试。
原始出处
Wang, Jing MD; Zhang, Zijuan MM; Cai, Yumeng MM; Lu, Junliang MD, PhD; Zhang, Hui MD, PhD; Pang, Junyi MM; Wu, Huanwen MD, PhD; Liang, Zhiyong MD, PhD. A Comprehensive Study of Heterogeneous Mismatch Repair Expression in Solid Tumors Reveals Different Immunohistochemical Patterns and Distinct Genetic Mechanisms. The American Journal of Surgical Pathology ():10.1097/PAS.0000000000002158, November 24, 2023. | DOI: 10.1097/PAS.0000000000002158
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#遗传机制# #免疫组织化学# #固体肿瘤#
64