VEGF-B: to be or not to be?
2023-08-24 论道心血管 论道心血管 发表于上海
本研究显示,VEGF-B结合FGFR1,诱导FGFR1/VEGFR1复合物的形成,从而抑制FGF2/FGFR1介导的Erk激活、血管生成以及肿瘤生长,发现了一个新生血管调控的崭新机制。
现有抗新生血管治疗对许多癌症无效,在眼新生血管疾病中也只对部分患者有效,目前机制不明1-5。FGF2/FGFR1在许多肿瘤中高表达,是肿瘤逃逸抗VEGF治疗的机制之一。2023年8月18日,中山大学中山眼科中心李旭日及瑞典卡罗林斯卡研究院曹义海教授团队在Signal Transduction and Targeted Therapy杂志发表文章,揭示了VEGF-B令人意想不到的限制血管生成的功能,并阐明了其分子机制,为上述现象提供了至少一种可能的解释。
本研究显示,VEGF-B结合FGFR1,诱导FGFR1/VEGFR1复合物的形成,从而抑制FGF2/FGFR1介导的Erk激活、血管生成以及肿瘤生长,发现了一个新生血管调控的崭新机制。

VEGF-B于1996年被发现,但迄今为止,其在血管系统中的作用仍不甚明了,不同实验室报道了不同的发现。VEGF-B的促血管生成/存活作用主要报道于组织退化/死亡的条件下,如心肌梗死、心力衰竭或神经退行性病变中(生长因子缺乏)6-10。同时,多个实验室也报道了VEGF-B的抗新生血管和抗肿瘤作用11-14。诸多文献显示,在癌症病人中,高VEGF-B水平与肿瘤患者高生存率和低肿瘤血管生成相关11,12,15,而低VEGF-B水平与低肿瘤患者生存率和高肿瘤血管生成相关11,16。特别是在乳腺癌病人中,低VEGF-B水平与高乳腺癌风险相关,而高VEGF-B水平与低乳腺癌风险相关12。的确,VEGF-B的已知受体VEGFR117也同样被发现具有抑制新生血管的作用18-20,而且,在乳腺癌患者中,与VEGF-B相似,高VEGFR1表达与高乳腺癌患者生存率相关,而低VEGFR1表达与低生存率相关21,22。尽管这些研究都提示了VEGF-B的抗血管生成和抗肿瘤作用,但由于机制不明,这些发现很大程度上都被忽视了。抑制VEGF-B和其他VEGF家族成员的药物被用于治疗癌症和其他新生血管疾病,然而,这些治疗在许多患者中缺乏疗效3-5。
既然VEGF-B可以促进7,10,23,24也可以限制血管生成11,13,14(以及本研究),那么VEGF-B在什么条件下促进以及什么条件下限制血管生成?什么因素造成这个转换?本研究显示,至少一个因素是FGF2/FGFR1的表达水平。也就是说,当FGF2/FGFR1高表达时,VEGF-B通过抑制FGF2/FGFR1来限制血管生成(图1a)。反之,当FGF2/FGFR1不(低)表达时,VEGF-B没有FGF2/FGFR1可以抑制,转而通过已知的促血管存活作用来提高血管生成6-10(图1a)。的确,VEGF-B的促血管生成作用主要是在组织或血管退化/死亡(FGF2/FGFR1缺乏)的条件下被发现的,如心肌梗死或视网膜退化10,23,24。VEGF-B在脉络膜新生血管小鼠模型中被发现具有促血管生成作用7,然而,实际上,这些模型更接近血管退化(而不是生长)模型,因为这些模型中的新生血管最终几乎自发性完全退化消失25-27。因此,当血管退化/死亡时,VEGF-B已知的抗凋亡作用8,9能够提高血管存活,维持正常血管密度(图1b)。
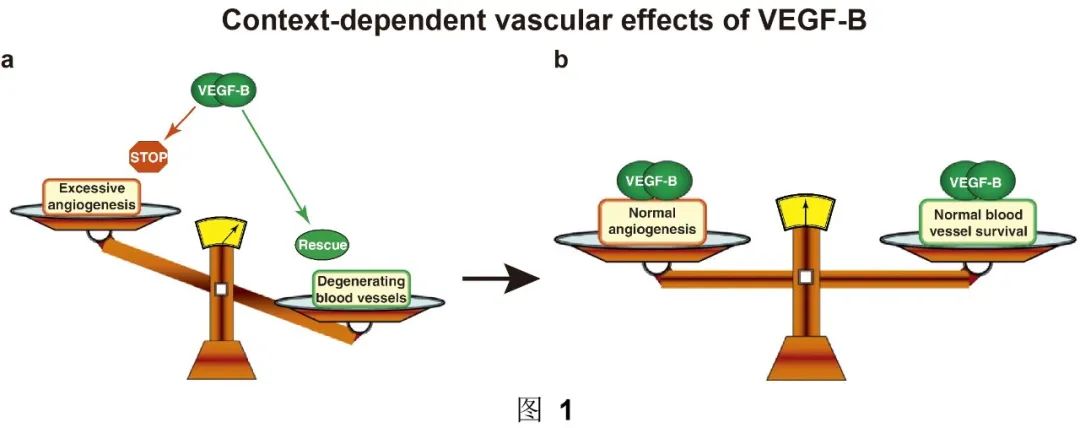
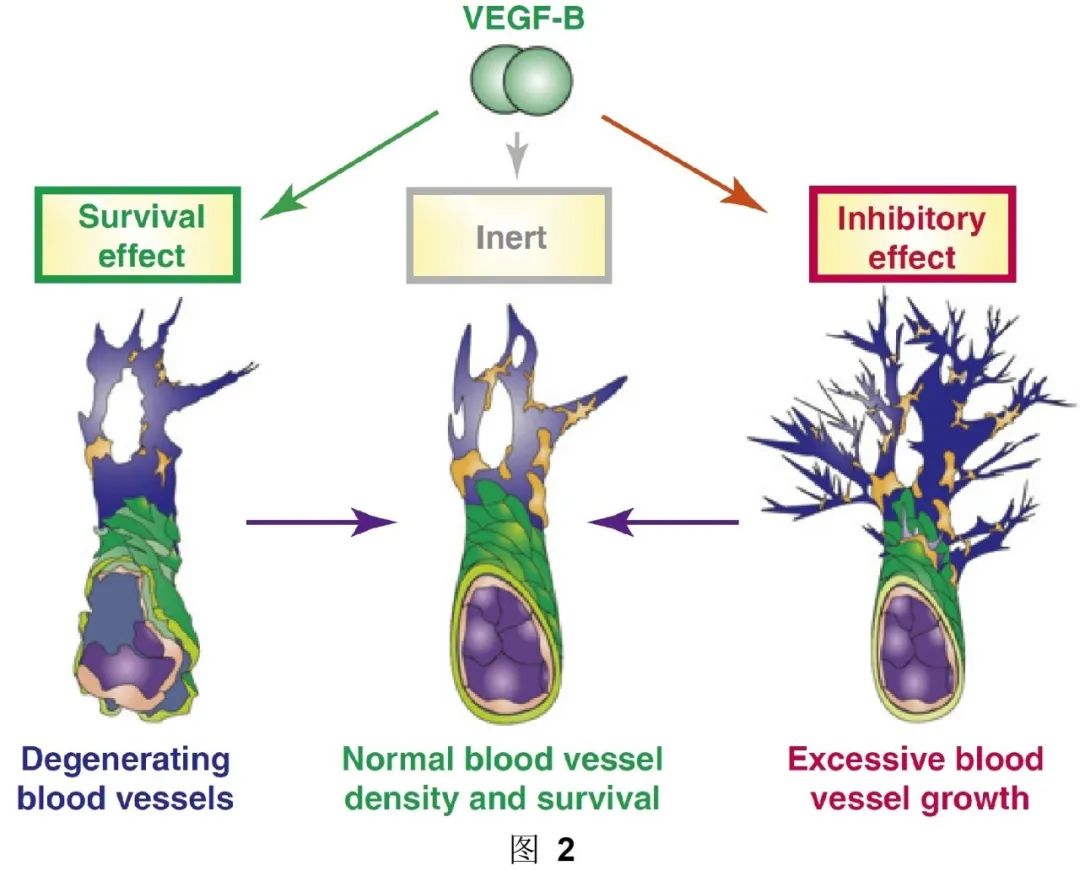
综上所述,当FGF2/FGFR1过多时(如肿瘤中),VEGF-B通过限制FGF2/FGFR1通路来避免血管过度生长(图2右)。相反,当FGF2/FGFR1缺乏时(如心肌梗死或中风),VEGF-B促进血管存活使其免于死亡(图2左)。VEGF-B通过这样一个高效而安全的“警察”作用来维持和平衡血管的正常密度(图2中)。这些颠覆性的发现将促使血管研究领域重新审视多年来对于VEGF-B的认知,尤其是在FGF2/FGFR1高表达时,抑制VEGF-B的治疗策略需谨慎考虑。
文章链接:
https://www.nature.com/articles/s41392-023-01539-9#Sec29.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







