铂耐药高级别浆液性卵巢癌患者检出TSC2基因变异,获益依维莫司
2024-04-21 苏州绘真医学 苏州绘真医学 发表于上海
本文描述了一位对依维莫司有反应的、携带TSC2突变、铂耐药的HGS卵巢癌患者。
铂耐药的复发性高级别浆液性卵巢癌患者预后较差,治疗选择有限。本文介绍了一名 48 岁女性患者,患有铂耐药的高级别浆液性卵巢癌,携带致病性TSC2 R611Q变异,且肿瘤靶向测序中发现TSC2单拷贝缺失(表明TSC2双等位基因失活)。该患者接受mTOR抑制剂依维莫司治疗,影像学反应良好,CA125显著下降;患者继续服用依维莫司 19 个月,直到疾病进展。虽然mTOR抑制剂常用于与结节性硬化症(TSC)相关的肿瘤,例如淋巴管平滑肌瘤病和恶性血管周围上皮样细胞瘤,但这是首例对mTOR抑制剂有反应的、携带TSC1/2突变的卵巢癌患者。该案例强调了DNA靶向测序在卵巢癌治疗中的实用性,并证明了泛肿瘤靶向治疗的价值。
背 景
卵巢高级别浆液性癌(HGSC)是最常见的卵巢恶性肿瘤,发现时通常为晚期。从基因角度来看,几乎所有HGSC的特征都是TP53突变和染色体不稳定,并且有大约一半存在同源重组缺陷(HRD),这是由于BRCA1/2或同源重组途径中其它基因的突变或甲基化导致的,使其易受到PARP抑制剂的影响。主要治疗方法是肿瘤减灭术和卡铂/紫杉醇化疗,然后根据肿瘤的HRD状态使用贝伐珠单抗和/或PARP抑制剂进行维持治疗。CA125是一种用于随访和监测疾病治疗反应的参考标志物,并已获得美国食品和药物监督管理局(FDA)的批准。近 75% 的HGSC患者会复发,最终会对含铂化疗产生耐药性或难治性。铂耐药卵巢癌的治疗选择包括单药化疗(活性有限)、化疗联合贝伐珠单抗以及最近的抗体药物偶联物(ADC)mirvetuximab soravtansine-gynx(Elahere),用于治疗叶酸受体α(FRα)高表达的肿瘤(约占所有病例的 35-40%)。铂耐药卵巢癌的治疗仍然是一个重大的、尚未满足的医疗需求。
TSC1和TSC2基因编码形成TSC1-TSC2复合物蛋白,该复合物是哺乳动物雷帕霉素靶点复合物1(mTORC1)的关键负调节因子。TSC1/2胚系突变会导致结节性硬化症(TSC),这是一种常染色体显性遗传病,其表现包括面部血管纤维瘤、室管膜下巨细胞瘤、心脏横纹肌瘤、肾血管平滑肌脂肪瘤和淋巴管平滑肌瘤病(LAM)。血管平滑肌脂肪瘤和LAM属于血管周围上皮样细胞瘤(PEComa),其特征是平滑肌和黑色素细胞免疫组织化学标记物均呈阳性。卵巢癌不是TSC的特征。
通常与TSC相关且携带TSC1/2突变的肿瘤,例如PEComa和LAM,对mTOR抑制剂有反应。在妇科中,恶性子宫PEComas经常用mTOR抑制剂治疗。然而,TSC1/2突变也存在于其它肿瘤类型中。例如,同时携带JAZF1::SUZ12基因融合和TSC2突变的罕见子宫肉瘤患者可能对mTOR抑制剂有反应。本文描述了一名接受依维莫司治疗的、携带TSC2突变的HGSC患者。
病 例
患者女,48 岁,白人,有 4 次怀孕史和 4 次分娩史(G4P4),有甲状腺乳头状癌病史,于 2016 年接受常规脐疝修补术。患者父亲有乳腺癌和前列腺癌阳性家族史。患者从不吸烟,并接受了遗传性癌症综合征检测,结果阴性。术中发现左侧输卵管积水和卵巢肿块。随后的经阴道超声检查显示左侧附件有一个 10.9 cm的实性囊性肿块,腹部/骨盆CT发现有可能发生转移的肝脏病变。术前CA125为 386 单位/mL。
患者接受了经腹全子宫切除术、双侧输卵管卵巢切除术和肿瘤减灭术。病理检查显示HGSC累及双侧卵巢、左侧输卵管旁软组织、子宫浆膜、盆腔腹膜、左侧输尿管、直肠乙状结肠和膈肌。大网膜肿瘤呈阴性。患者分期为pT3b pNx pMx(FIGO IIIB)。镜下检查发现肿瘤主要形成腺体和裂隙状空腔(图1)。细胞表现出中度异型性和嗜酸性细胞质。免疫组织化学研究表明,肿瘤细胞PAX8、WT-1 和叶酸受体α呈阳性(75%),HER2呈阴性(0)。
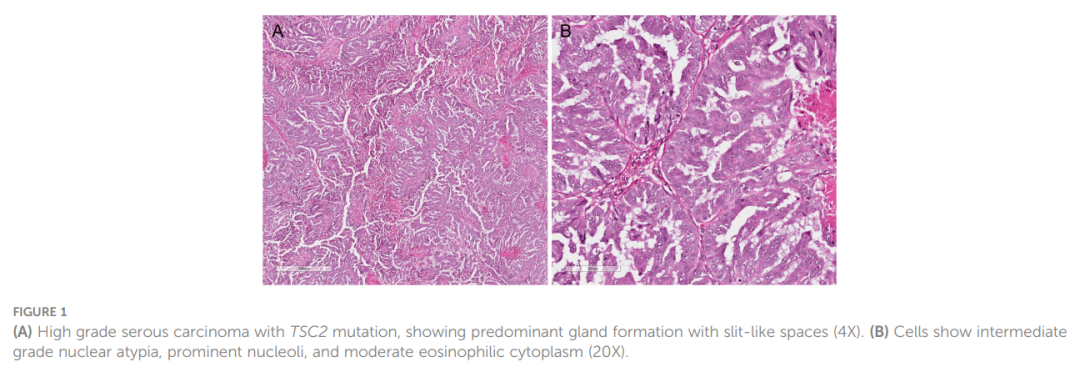
▲图1
使用NGS panel对肿瘤进行了基因检测,发现该肿瘤携带TSC2 c.1832G>A (p.R611Q)、TP53 c.587G>C (p.R196P)、BCL11B c.2224G>C (p.E742Q)、BUB1B c.1478C>T (p.T493I)、CBFA2T3 c.770C>T (p.T257M)、NSD1 c.708G>C (p.Q236H)、SETBP1 c.3712G>A (p.D1238N)、STK11 c.1263C>T (p.S421S) 和ZNRF3 c.334C>A (p.Q112K)。此外,还检出了许多拷贝数变异,包括涉及TP53和TSC2的单拷贝缺失。还检测到了生物学意义不明的UBE4B::KIF1B融合。BRCA1/2、TSC1/2和STK11在内的胚系检测未发现任何突变。
术后,患者接受了六个周期的静脉内和腹腔内紫杉醇联合顺铂治疗,获得了完全临床缓解。初次手术两年半后,由于CA125升高,患者进行了影像学检查,结果显示腹膜和腹壁出现结节。活检证实复发性HGSC。随后,患者参加了PARP抑制剂他拉唑帕利(talazoparib)和抗PD-L1抗体阿维鲁单抗的临床试验。患者最初接受这种治疗后情况稳定,但大约一年后,影像学和生化检测显示疾病负荷增加。患者转用卡铂和脂质体多柔比星,反应良好。再次复发后,因铂耐药转为贝伐珠单抗联合脂质体多柔比星治疗。患者病程因贝伐珠单抗引起的高血压、复发性黏膜炎和肾毒性而复杂化,基于上述原因该治疗方案暂停。在此期间,患者CA125升高,腹膜结节复发,并导致了恶性肾积水。由于存在TSC2突变并伴有TSC2单拷贝缺失,患者随后开始每日口服依维莫司 10 mg和每日口服来曲唑 2.5mg。由于血小板减少,依维莫司给药频率减少至 5 天给药/2 天停药。开始使用依维莫司后 12 和 16 个月的CT扫描显示肿瘤负荷减少,CA125正常(分别为 16 和 23 单位/mL)。总体而言,患者对来曲唑/依维莫司的耐受性良好,并维持了患者的生活质量,患者继续工作并继续既往生活。然而,开始使用依维莫司后 19 个月,患者CA125增加至 74 单位/mL,CT扫描显示疾病恶化,停用依维莫司(图2)。
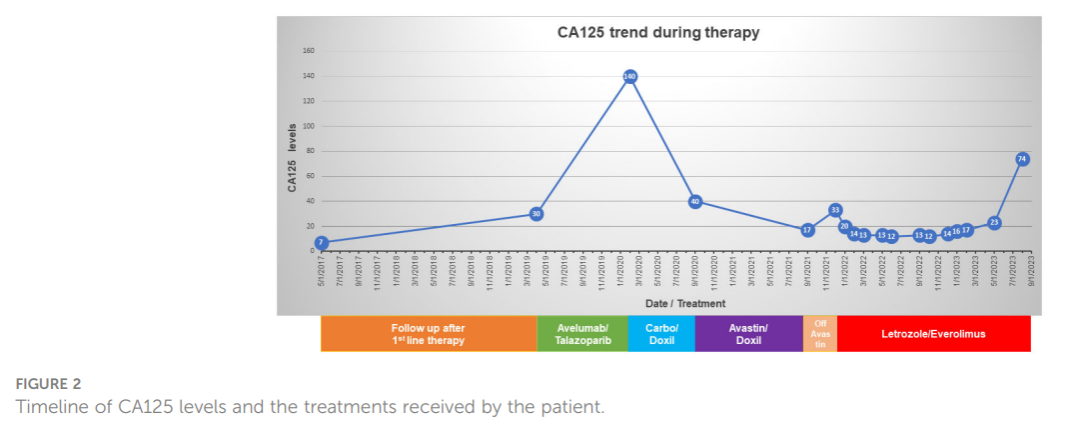
▲图2 CA125水平和患者治疗时间线
讨 论
本文描述了一位对依维莫司有反应的、携带TSC2突变、铂耐药的HGS卵巢癌患者。该肿瘤中存在的TSC2点突变和单拷贝缺失表明TSC2双等位基因失活,这与mTOR抑制剂靶向治疗的反应有关。在妇科中,mTOR抑制剂已成功用于治疗携带TSC2突变的子宫PEComas和间质肉瘤。然而,据研究人员所知,这份报告是首个描述TSC2突变卵巢癌对mTOR抑制剂有反应的报告。这是一个备受关注的领域,目前正在进行一项针对TSC1/2突变实体瘤患者的应用白蛋白结合西罗莫司的II期篮子试验(NCT05103358)。既往的II期试验未能确定在贝伐珠单抗中添加依维莫司对复发性卵巢癌具有显著获益;然而,该研究并未筛查患者mTOR通路变异。此外,既往曾报道过一项I期试验,旨在确定依维莫司与PARP抑制剂(PARPi)尼拉帕利联合治疗晚期卵巢癌或乳腺癌患者的安全性和耐受性。这项研究表明,依维莫司和尼拉帕利的组合即使在两种药物剂量较低的情况下也会产生显著毒性,因此是不可行的;该研究中的任何患者均未检出TSC2突变。
有一项研究对 316 例HGSC患者进行了卵巢癌基因频谱分析,5 例(1.6%)存在TSC1变异(3 例深度缺失[deep deletion],1 例截短突变和浅度缺失[shallow deletion],1 例错义突变),3 例(1%)存在TSC2有害变异(1 例具有深度缺失,2 例同时具有错义突变和浅度缺失)。因此,虽然TSC1/2变异在HGSC中并不常见,但一小部分病例存在mTOR通路异常,可能获益于靶向治疗。目前尚不清楚这些肿瘤是否表现出独特的形态学或免疫组织化学特征,例如在PEComa中观察到的黑色素细胞标记物阳性。然而,考虑到这些突变在HGSC中非常罕见,靶向测序可能是识别可从mTOR抑制剂中获益患者的最有效方法。
TSC2 R611Q是一种致病性变异,已在多例TSC患者中报道,TSC是一种由于TSC1/2胚系失活突变导致的常染色体显性遗传病。从功能上讲,这种氨基酸取代涉及TSC2蛋白的TSC1相互作用结构域,导致TSC2与TSC1的相互作用减少,并消除TSC复合物依赖的mTORC1活性抑制。mTORC1的组成型激活可以通过依维莫司(雷帕霉素衍生物)靶向,依维莫司可与FKPB12形成复合物,作为mTORC1的变构抑制剂。因此,依维莫司对结节性硬化症患者体内发生的多种肿瘤有活性,包括肾血管平滑肌脂肪瘤、淋巴管平滑肌瘤病(LAM)和室管膜下巨细胞星形细胞瘤。
需要强调的是,虽然选择依维莫司是因为TSC2双等位基因失活,但研究人员选择在依维莫司基础上添加激素治疗(使用芳香酶抑制剂来曲唑)有两个原因。首先,尽管HGSC不被认为是激素驱动的,并且对激素治疗的反应较差,但在至少 80% 的HGSC中观察到弱或强的ER表达(≥1%),并且两项研究已证明使用他莫昔芬或来曲唑治疗这些肿瘤(无论是在首次还是后续复发时)具有活性。其次,鉴于ER和PI3K/mTOR通路之间存在广泛的相互作用,激素治疗联合mTOR抑制剂已获证具有协同抗肿瘤活性,依维莫司联合依西美坦目前已获FDA批准用于治疗激素受体阳性、来曲唑或阿那曲唑治疗失败后人表皮生长因子受体2(HER2)阴性的转移性乳腺癌。值得注意的是,依维莫司和来曲唑的组合已在卵巢和子宫内膜的II期试验中进行了研究;然而,这两项试验都没有筛查肿瘤的TSC1/2突变,以识别可能对这种组合特别敏感的患者。
鉴于PI3K通路的激活(由于TSC2失活导致)是一种有据可查且已确定的激素治疗耐药机制,预计TSC2突变会对来曲唑产生耐药性,而不是敏感性。尽管如此,不能排除该患者对来曲唑/依维莫司反应的部分原因可能是来曲唑,因为他莫昔芬或来曲唑的激素治疗已证明对HGSOC具有活性,包括后来的复发(这也是为何在该患者依维莫司中添加来曲唑的原因)。
最终,该患者在治疗 19 个月后对依维莫司产生了耐药性,这一时间对于铂耐药HGS卵巢癌而言是显著的。依维莫司耐药的关键机制包括mTORC1突变的发生(可以通过靶向mTOR ATP结合位点的药物来克服,从而消除其激酶活性)以及PI3K信号通路的反馈激活(feedback activation)和MAPK的反常激活(paradoxical activation)/ERK信号传导。不幸的是,该患者在依维莫司治疗进展后无法进行活检,因此无法确定依维莫司获得性耐药的确切机制。
展望未来,考虑到该患者肿瘤中的FRα高表达(定义为染色强度≥2+ 的阳性细胞≥75%),该患者将成为ADC mirvetuximab(依维莫司治疗启动时该药物尚未获得FDA批准)的优秀候选者。具体来说,在SORAYA试验中,mirvetuximab在FRα高表达铂耐药卵巢癌患者中的ORR为 32.4%,中位缓解持续时间为 6.9 个月。此外,mirvetuximab的验证性随机 3 期试验(MIRASOL)表明:在铂耐药FRα高表达OC患者中,与研究者选择的化疗相比,mirvetuximab在中位PFS和OS方面均具有统计学显著获益,这是第一个在卵巢癌治疗中OS获益优于含铂化疗的药物。
绘真医学可提供FRα表达检测,基于免疫组化方法,采用MAB-1043抗体,检测卵巢癌、输卵管癌以及原发性腹膜癌患者的肿瘤细胞FRα蛋白表达水平。FRα阳性定义为≥75%的肿瘤细胞以2+强度染色。样本要求为至少5张防脱白片,或者蜡块,报告周期为5个自然日。
绘真医学FRα(叶酸受体α)表达检测送检

参考文献:
Peterson M, Kolin DL and Konstantinopoulos PA (2024) Case report: Response to everolimus in a patient with platinum resistant, high grade serous ovarian carcinoma with biallelic TSC2 inactivation. Front. Oncol. 14:1357980. doi: 10.3389/fonc.2024.1357980

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#依维莫司# #高级别浆液性卵巢癌# #铂耐药#
48