Blood:多发性骨髓瘤MRD评估的未来方向
2023-08-03 聊聊血液 聊聊血液 发表于上海
《Blood》近日发表一篇前瞻性综述,旨在总结MM领域目前可用的MRD研究证据,并为未来的应用提供方向。现翻译全文供各位老师参考。
MM的MRD评估
虽然新诊断多发性骨髓瘤(NDMM)很多可获得完全缓解(CR),但复发仍无法避免,还需要更深和更持续性的缓解来实现可操作性治愈(operational cure)。因此,必须在CR和严格CR(sCR)后向分子学/流式CR方向发展,以达到最终治愈。CR的定义是次优的,而治疗缓解是评估治疗疗效的关键要素。
20年前出现了使用多参数流式细胞术(MFC)评估可测量残留病灶(MRD),CR患者中存在残留浆细胞(PC)的患者比无残留浆细胞的患者差更(p=0.02)。此外,Puig等使用免疫球蛋白基因的等位基因特异性寡核苷酸实时定量聚合酶链反应(ASO RQ-PCR)评估103例持续性疾病患者的MRD,报告了相似的结果,即MRD阴性(MRD-)患者优于MRD阳性(MRD+)患者,并得出结论,ASO RQ-PCR是评估MM的治疗疗效和风险分层的有力工具。
《Blood》近日发表一篇前瞻性综述,旨在总结MM领域目前可用的MRD研究证据,并为未来的应用提供方向。现翻译全文供各位老师参考。

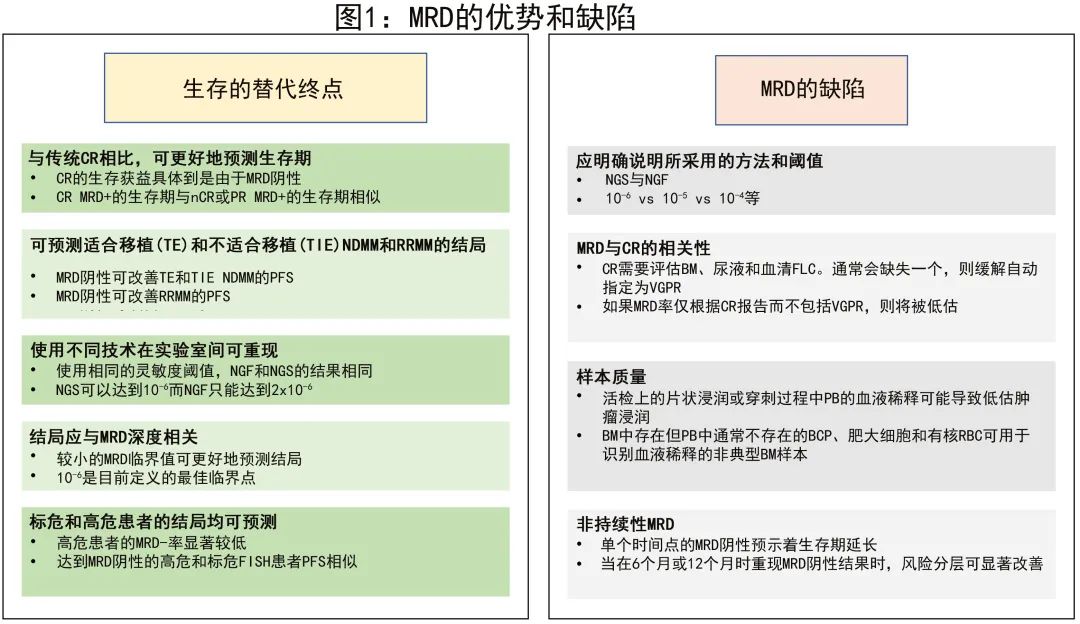
MRD作为生存期的替代终点
MRD可作为生存期和治疗监测替代终点的要求,这一问题至关重要。Avet-Loiseau等进行的META分析支持MRD状态可用作NDMM无进展生存期(PFS)替代指标。但还有几个障碍需要克服:(i)MRD必须是比常规CR更好的生存预测因子;(ii)MRD不仅应预测适合移植(TE)和不适合移植(TIE)NDMM的结局,还应预测复发/难治性疾病(RRMM)的结局;(iii)实验室间使用不同技术测量MRD的结果应具有重现性;(iv)预后应与MRD的深度相关;(v)MRD应可预测标危和高危患者的结局。
在此背景下,Lahuerta等比较了GEM 2000中患者的结局、GEM2005MENOS65研究(TE MM)和 GEM2010MAS65研究(老年MM患者研究入组后9个月评估MRD )。从常规缓解来看,达到CR的患者(n=548/1230;45%)的PFS(中位56个月)显著优于接近CR(nCR)、部分缓解(PR)或<PR的患者(中位数,分别为43、33和20个月)。但如果将MRD-患者与MRD+ 患者分开,则显然CR患者的生存获益应归因于MRD阴性(MRD vs CR:p<0.001)。事实上,仅MRD阴性可使PFS显著改善(中位63个月),因为MRD+ CR患者的生存期与MRD+ nCR或PR患者相似(中位PFS分别为27、27和29个月),而MRD+ <PR患者的中位PFS仅11个月。因此,MRD阴性在预测结局方面优于CR,即使MRD阴性检测阈值为10-4。
关于NDMM(TE和TIE)和RRMM患者的结局预测,有超过100篇报道和4项META分析支持MRD与PFS/总生存期(OS)之间的相关性。Munshi等的扩展META分析纳入8114例患者,证实MRD阴性对PFS和OS均有积极影响。事实上,MRD阴性可改善TE NDMM(风险比[HR]=0.39)、TIE NDMM(HR=0.35)及RRMM患者(HR=0.30)的PFS;在所有三种疾病环境中,MRD-患者均表现更好。在年轻患者中,实现MRD阴性对于实现可操作性治愈不可或缺。但也要成人,有小部分MRD阳性患者也可以在11年后达到生存曲线的平台期,并认为已经实现可操作性治愈;这些可能是具有MGUS样基因标记的患者,与疾病风险较高的患者相比,其达到MRD阴性的生存获益不太显著,然而后一组患者在诊断时很难识别。
此外,两线或三线治疗后的流失率(尤其是在老年和虚弱患者中)非常高,因此,通过早线和一线治疗达到最佳缓解也非常重要。
从技术角度来看,尤其是将MRD作为生存终点替代指标的关键在于重现性时,基于二代流式细胞术(NGF)和二代测序(NGS)的MRD评估方法的经验正在积累。特别重要的是,EuroFlow联盟最近做出了重要努力,开发了一种在MM中使用NGF进行MRD检测的高灵敏度、完全标准化的方法。比较NGS和NGF的研究很多,显示NGS和NGF之间具有相关性,但是NGF 未来是否能可靠地取代金标准NGS,还需要更多使用标准化方法的研究。
缓解深度是评价治疗疗效和预测生存期的关键要素,根除所有肿瘤细胞对于治愈大多数恶性肿瘤是必要的,而这需要尽可能达到并维持最深缓解。如上所述,MM中的CR是次优定义,因其依赖于检测技术的低限,无法区分残留肿瘤细胞和多克隆PC。NGF可以达到预期2x10-6左右的检测限,即在几乎90%的MM患者中检测到一百万个正常细胞内的两个肿瘤细胞,而分子学金标准NGS可以达到10-6的灵敏度。两种技术还存在其他特征的差异(细胞活力、DNA提取、获得结果的时间等)。
对于作为预后(PFS、OS)替代终点的MRD状态,不同的检测阈值可影响预后,而与使用的技术无关。Avet-Loiseau等在前瞻性试验中使用免疫球蛋白基因NGS定量MRD,并将其与PFS和OS相关联,表明最佳检测限与PFS和OS的最佳区分相关,并建议10-6应为佳临界值。Paiva等在III期PETHEMA/GEM2012试验中评估了基于NGF的MRD评估的可行性、检测限和临床影响,两项研究使用两种评估方法独立评估,显示MRD水平越低则预后越好。
若要作为预后的替代终点,MRD还必须能够预测标危和高危患者的生存结局。Paiva等研究了FISH定义的标危和高危患者[即t(4;14)、t(14;16)和/或del(17p)] 中MRD阴性的影响,尽管FISH高危患者的MRD-率显著低于标危患者(分别为37%和50%;p=0.03),但达到MRD阴性的高危和标危FISH患者的3年PFS率相似(分别为94%和91%;p=0.56);相比之下,FISH高危和标危的MRD+患者的中位PFS分别为27个月和35个月(p=0.025)。但与之相反,在IFM 2009试验中,基于开始维持治疗时的MRD结果,高危患者的PFS较差,校正风险比为1.69(P=0.008);重要的是,在维持治疗结束时达到MRD阴性的高危和标危患者的PFS无差异,校正风险比(协变量:MRD、治疗和ISS分期)为1.08(P=0.785)。本研究表明,高危患者即使达到MRD阴性,其预后仍然受损,可能是由于MRD阴性早期消失所致(MRD阴性持续存在似乎可克服高危细胞遗传学的有害影响)。最后,高危细胞遗传学在MRD阴性对患者预后的影响方面可能并不完全相等。Chakraborty等的一项回顾性研究中, 缺失(17p)亚组(n=84)和伴≥2种高危细胞遗传学异常亚组(n=32)中,MRD阴性未转化为更优的PFS或OS,而在t(4;14)患者(n=65)中,MRD阴性转化为显著更优的PFS和OS。
另外必须强调的是,小部分患者在缓解后>5年仍为MRD阳性(检测限10-6),并显示正常与异常单克隆浆细胞免疫表型(MGUS样)。
总之,尽管所有MRD阴性并不等同,但MRD阴性仍是MM治疗的新终点,应将MRD阴性纳入到治疗缓解评估标准中,以便在临床试验内或临床试验外统一报告结果。此外,虽然小部分具有MGUS样基因标记的患者实现MRD阴性的生存获益不太显著,但MRD应成为大多数患者MM治疗的新目标,并应加入PFS和OS作为临床试验的终点。MRD已纳入缓解评估标准中,检测阈值为10-5且持续至少一年,也越来越成为骨髓瘤治疗的新目标。应不断努力将NGF或NGS纳入未来的试验中,以更好地定义其最佳使用,然后将这些方法扩展到日常实践。
骨髓“外”的MRD
MM具有较高的空间和时间异质性,且通过影像学技术确定的基线局灶性病变与复发克隆之间存在密切关系。MM的克隆结构(clonal architecture,)可包括位点特异性亚克隆(site-specific subclones),导致难以采集MM克隆多样性的全部程度。因此,单点骨髓采样可能无法采集肿瘤异质性,而重复进行连续评估时患者的接受度又较低。而微创的“液体活检”可识别和分析循环MM细胞,包括检测疾病负荷、分子学改变和监测治疗反应。MM中其主要挑战在于检测外周血(PB)中的MRD。为确定在使用该分子学靶点的MRD评估中,血浆是否可以有效替代骨髓(BM),Mazzotti等开展了一项比较性前瞻性研究,在随访期间从37例患者中获得配对BM和PB样本并使用深度测序评估MRD,结果44%的患者PB结果为假阴性(r=0.003,p=0.98)。该研究表明,循环肿瘤(ct)DNA与仅使用Ig基因重排的NGS检测的BM MRD之间无相关性,表明单独的ctDNA并非这些疾病状态的适用常规标志物。
Sanoja-Flores等在真实世界研究了137例NDMM患者积极治疗后血液中NGF检测ctPC对预后的影响。在整个MM患者队列中,NGF检测的血液ctPC的存在与否是PFS的有力独立预后标志物(HR=5.1,95%CI,2.9-8.9;p<0.0001),PB ctPC阴性(n=101)和PB ctPC阳性(n=36)患者的中位PFS分别为46个月和9个月,p<0.0001;然而,相当大比例的BM-MRD+ 患者在(配对)血液样本中仍检测不到ctPC:55/137 (40%)。这些结果表明,ctPC在MM中的灵敏度低于BM MRD,因此不适合作为这些疾病状态的常规标志物。
质谱(MS)是基于BM的MRD评估的有吸引力的微创替代方法,开发超灵敏MS方法已经取得重大进展。克隆型肽(clonotypic peptide)方法和完整蛋白(intact protein)方法均利用M蛋白的独特质量和序列测定其浓度,均具有高灵敏度或高通量等特定优势。每个方法都具有高灵敏度或高通量等特定优点,可为更频繁的MRD监测铺平道路,以允许检测早期疾病复发。Puig等证明MS检测MM患者的M蛋白更敏感(包括基线和治疗期间),并提供更准确的患者结局预测。因此,评估MS以及NGS或NGF检测的BM MRD的前瞻性研究,对于破译未来每种方法各自的作用不可或缺,以及了解是否可能在PB上常规使用MS来检测 MRD,而非侵入性较大的BM方法(至少在某些时间点)。
影像学在MM MRD评估中也可发挥重要作用。总体而言,还需要更多研究来排除影像学和生物学在MRD评估中的各自作用,虽然影像学可检测髓外疾病,但仍待确定其与NGS和NGF在评估髓内疾病方面的良好相关性,使两种方法更具有互补性而非排他性。
MRD的缺陷
不管是在临床实践还是研究中,MRD分析都有一些缺陷,包括评估中和报告中。
第一个缺陷是将MRD与CR相关联,这可以通过两项研究来说明:CASSIOPEIA和GMMGHD7。CASSIOPEIA中巩固治疗后的CR率vs MRD阴性率(10-5)分别为39% vs 64%,GMMGHD7中诱导治疗后的CR率vs MRD阴性率分别为24% vs 50%(10-5);两个时间点的MRD率均远高于CR率。问题在于CR需要评估BM、尿液和血清游离轻链,一旦其中一个数值缺失,则缓解应为VGPR而非CR。如果根据CR报告MRD率,则会低估MRD率,从而导致混淆。Puig等评估了PETHEMA/GEM2021MENOS65研究中治疗的前164例巩固后患者,比较了免疫固定电泳、MS偶联液相色谱和NGF三种技术的预测价值,令人惊讶的是,通过免疫固定电泳并不能区分PFS (p=0.2923),但MS和NGF均分离了两个PFS显著不同的队列(分别为HR=2.18;p=0.0016和HR=2.83;p<0.0001);MS阳性和NGF阳性患者的中位PFS为4.4个月,MS阴性和NGF阴性患者的中位PFS为未达到。这就提出了CR和MRD阴性之间结果相互矛盾的问题。事实上,尽管FDA在2020年的指南中规定应仅在CR患者中评估MRD,但免疫固定电泳评估的CR可能受到误导,诱因包括M蛋白的长半衰期、治疗性抗体干扰或CR评估不准确(缺失BM、尿液或血清游离轻链评估)。因此,CR和MRD阴性评估之间存在不一致,建议在达到非常好的部分缓解(VGPR)的患者中也应评估MRD。
此外,为了避免数据解释中的其他缺陷,在报告MRD分析时应特别注意,无论是在临床实践还是试验中。应明确说明使用的方法(NGS/NGF),更重要的是采用的检测阈值(如前所述,10-6的检测限与10-4存在很大差异)。
另一个关键问题在于BM样本的质量(可同时影响NGS和NGF)。活检时存在片状浸润或PB穿刺过程中稀释血液可能导致低估肿瘤浸润。B细胞前体(BCP)、肥大细胞和有核红细胞在BM中存在,但PB中通常不存在,可用作血液稀释的指征,用于识别不典型BM样本。使用流式细胞术可同时评估MRD和血液稀释,以避免可能的假阴性MRD。血液稀释的BM穿刺样本不符合MRD评估条件。入组PETHEMA/GEM2010MAS65临床试验的118例TIE MM患者的PFS和OS,根据治疗结束时MRD阳性和阴性进行分层,并对后者根据BM BCP低于或高于0.31% (健康成人的中位值)进一步分层。在MRD阴性患者中,BCP≥0.31%的患者的中位PFS显著高于<0.31%的患者(52 vs 28个月;p=0.033);3年OS率分别为95.5%和74%(p=0.048)。
最后一个缺陷是非持续性MRD。达到MRD阴性且显示一过性或非持续性MRD阴性的患者可能属于预后不良组。尽管单个时间点的MRD阴性可明确预测更长的生存期,但该结果在6个月或12个月时重现时,风险分层可显著改善。在至少达到CR的患者中,如果将持续阴性≥12个月的MRD患者与未持续的MRD患者分开,则前一组的PFS更佳;这在对达雷妥尤单抗MAIA和ALCYONE试验进行的研究清楚地进行了呈现(NGS检测阈值为10-5)。
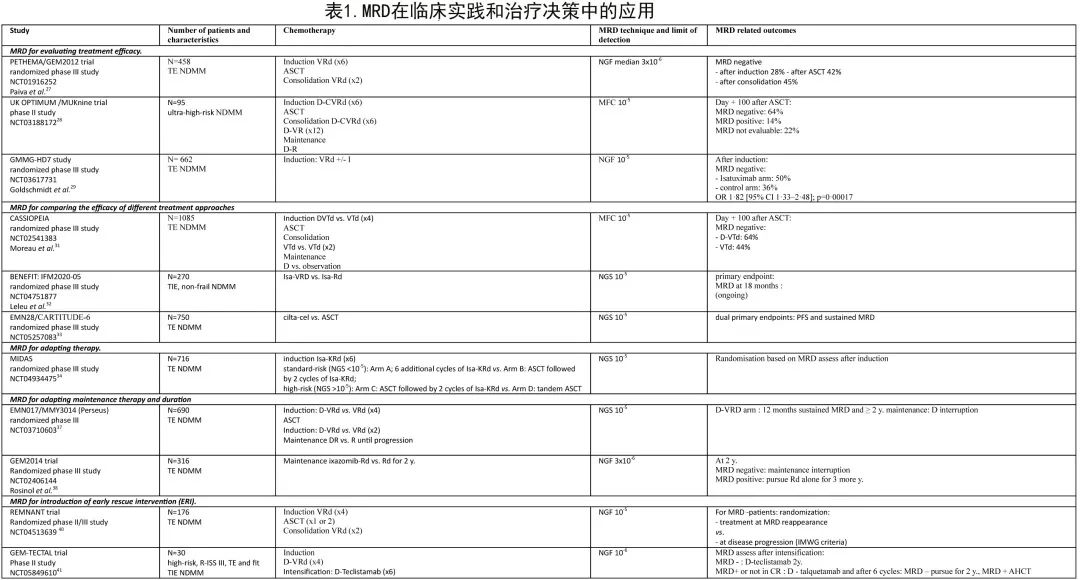
MRD在临床实践和治疗决策中的作用
基于当前临床试验的数据,支持在临床实践和治疗决策中进行MRD评估的证据主要关注领域包括:评价治疗疗效和比较两种治疗方案;根据MRD调整治疗;调整维持强度和持续时间;引导早期挽救性干预(early rescue intervention,ERI)(表1)。
MRD用于评估疗效
Paiva等说明了MRD在评价治疗疗效中的价值。PETHEMA/GEM2012研究包括VRd诱导(6个周期)、ASCT和VRd巩固(2个周期)三个阶段,采用MRD评价各阶段的疗效:诱导后MRD阴性率为28%(n=129),ASCT后为42%(n=194),巩固后为45%(n=208)。根据以下MRD对数水平对患者进行分组:(i)≥10-4(ii)≥10-5至<10-4和(iii)≥2 x 10-6至10-5,MRD对数水平(iii)的患者比例从ASCT后的9%增加至巩固治疗后的19%。对于2个周期VRd巩固治疗后MRD降低2 log直至维持治疗前MRD阴性的患者,这可以证明额外2个周期的巩固治疗是合理的,从而维持缓解。
UK OPTIMUM/MUKnine研究在107例超高危NDMM患者[(≥2个高危因素:t(4;14)、t(14;16)、t(14;20)、gain(1q)、del(1p)、del(17p)或基因表达SKY92(SkylineDx)或PCL]中评估了ASCT后的MRD状态和PFS。患者接受D-CVRd诱导治疗(6个周期)、增强大剂量美法仑和ASCT,随后接受D-VRd巩固治疗6个周期或D-VR巩固治疗12个周期和D-R维持治疗直至疾病进展。诱导结束时81%的患者和ASCT后第+100天时78%的患者有可通过流式细胞术(10-5)进行MRD评估的BM穿刺样本,证明了以中心MRD状态作为终点开展研究的可行性。ASCT后第+100天,64%的患者的MRD状态为阴性,14%的患者为阳性,22%的患者为无法评价。
MRD阴性也用作GMMG-HD7研究的主要终点,该研究中,660例患者随机接受VRD联合或不联合isatuximab作为适合移植的新诊断MM的诱导治疗。在诱导化疗结束时NGF(EuroFlow)评估MRD。isatuximab组166例(50%)患者和对照组117例(36%)患者在诱导治疗后实现了MRD阴性(OR=1.82;p=0.00017)。
克服高危细胞遗传学的最佳方法是实现MRD阴性,如Paiva等2019年所示。在GEM2012研究中,当MRD仍为阳性时,R-ISS-I、R-ISS-II和R-ISS-III状态患者的结局逐渐变差(36个月PFS率分别为62%、53%和28%),而MRD-患者的36个月PFS率无显著差异(分别为95%、94%和88%)。因此,R-ISS-III患者可通过MRD阴性克服不良预后,这应该是高危患者的目标。然而,尽管实现MRD对克服不良预后很有价值,但应记住,HR MM患者不太可能实现持续的深度MRD阴性,从而突出了该人群的挑战。
MRD比较不同治疗方案的疗效
CASSIOPEIA研究(一项在ASCT前、后比较D-VTd与VTd的III期研究)证实了MRD在比较两种治疗方案疗效方面的价值,纳入111家研究中心的1085例18-65岁TE NDMM患者,整个研究期间通过NGS和NGF评估MRD,包括诱导(4个周期)、巩固(2个周期)和维持;对于≥PR的患者,在巩固治疗后进行第二次随机化,接受D单药治疗或观察。进行中的BENEFIT:IFM2020-05研究纳入65-79岁TIE非虚弱NDMM患者,随机接受Isa-VRd或Isa-Rd治疗,采用18个月后的MRD阴性(NGS 10-5)作为主要终点。
在750例年龄≥18岁、按ISS分期、细胞遗传学风险和年龄分层的TE NDMM患者中比较ciltacabtagene autoleucel(cilta-cel)与ASCT的EMN28 III期随机研究的结果也值得期待,其双重主要终点为PFS和CR患者的持续MRD阴性率(NGS 10-5),将比较D-VRd + ASCT常规治疗与D-VRd + cilta-cel的价值。
MRD用于调整治疗
MRD评估对于根据MRD随访调整治疗也可能具有重要价值。在IFM MIDAS(MRD调整策略)研究中,所有18-65岁的TE患者均接受Isa-KRd诱导治疗(6个周期),然后根据标危或高危进行分层,并非根据细胞遗传学进行分层,而是根据MRD状态进行分层:标危为NGS<10-5,高危为NGS>10-5。然后根据MRD状态进行随机化进入4个治疗组之一:标危(NGS<10-5):A组;Isa-KRd额外6个周期,B组:ASCT,随后2个周期Isa-KRd;高危(NGS>10-5):C组:ASCT,随后2个周期Isa-KRd,D组:串联ASCT。对于维持治疗(3年),A/B组患者接受R,C/D组患者接受更强化的治疗(iberdomide和isatuximab)。
UK小组启动了一项类似的改良疗法II期研究——RADAR研究,以定义预测性生物标志物的作用。对于通过诱导/ASCT达到MRD-的TE患者,评估移植后降级治疗是否安全有效,而保持MRD+的患者则评估ASCT后治疗递增的影响,包括免疫治疗。当与其他基线风险参数结合时,治疗过程中的风险动态评估可作为最准确的风险评估方法。然而必须指出,由于一过性或非持续性MRD阴性患者可能代表预后不良组,因此未来此类方法应尝试在单一时间点纳入持续性MRD而非MRD。
MRD用于调整维持强度和持续时间
调整维持治疗的持续时间可在降低成本方面带来显著的附加值,也将减少短期和长期不良事件。正在进行的RADAR研究中,维持治疗的选择是基于移植后MRD状态和细胞遗传学风险,维持治疗后重新评估MRD以决定是否继续治疗。在MASTER研究中,根据gain/amp 1q、t(4;14)、t(14;16)、t(14;20)或del(17p)定义的高危细胞遗传学异常(HRCA)对患者进行分类,123例患者中57%为高危。84例患者达到MRD-SURE(无治疗观察和MRD监测),包含0、1和2+ HRCA(超危)的62%、78%和63%。2年PFS为87%(HRCA为0、1和2+ 的患者分别为91%、97%和58%,p<0.001)。对于HRCA为0、1或2+ 的患者,治疗停止后12个月MRD复发或进展的累积发生率分别为4%、0%和27%。OS的结果方向相似(p=0.03)。对于HRCA为0或1的患者,有机会使用MRD监测而非无限期维持治疗,但在超高危患者中不应停止治疗,因为会快速复发。该患者人群的检测限应至少为10-6,否则将遗漏残留细胞,正如R-ISS III期患者的PFS较差所示。
EMN017/MMY3014 III期注册研究(Perseus)中提出了适应性(adaptive)维持治疗强度的另一种可能性,该试验入组640例18-70岁的NDMM患者,比较D-VRd与VRd诱导(4个周期)、ASCT后巩固(2个周期)以及DR或R维持至进展。主要终点为PFS,次要终点为巩固治疗后的MRD(NGS 10-5)。在D-VRd组,维持至少2年后MRD持续阴性12个月的患者停用D,并在MRD转阳时恢复D。
西班牙GEM2014研究还探索了MRD在优化维持治疗中的作用。诱导和巩固治疗后,稳定患者随机接受伊沙佐米-Rd(IRd)与Rd维持治疗2年。2年后,MRD-患者(NGS 3 x 10-6)停止维持治疗,MRD+患者继续接受Rd治疗3年。2年时的PFS存在显著差异(p<0.001),MRD患者继续表现良好,复发极少,而MRD+患者尽管接受了维持治疗,但仍持续复发。
MRD引导早期挽救性干预(early rescue intervention,ERI)
根据MRD引入ERI具有重要性和必要性。尚无研究以随机方式评估MRD复发的治疗,但REMNANT研究(挪威391例TE患者的随机II/III期研究)正在评价治疗一线治疗后治疗MRD复发是否可延长MM患者的PFS和OS,并与一线治疗疾病进展时治疗复发进行对比。患者在诊断时入组,并接受VRd诱导(4个周期)、单次或串联ASCT和VRd巩固治疗(4个周期)。MRD-患者(NGF 10-5)在MRD复发或根据传统IMWG标准为疾病进展时,随机接受治疗。该研究2期部分的主要终点是巩固治疗后30-45天的MRD- (NGF 10-5) CR,目前已对26例患者进行了评估,13例患者(50%)为≥CR和MRD-,并已入组研究第2部分。
西班牙研究小组还设计了GEM-TECTAL研究,纳入FISH染色体异常高危患者(del(17p)、t(4;14)、t(14;16)和/或1q amp)或R-ISS III期患者或髓外病变患者,可以为TE或TIE但elderly-fit。D-VRd治疗4个周期后进行MRD评估和干细胞采集,接受6个周期的双特异性T细胞衔接系统teclistamab治疗。如果为MRD-将继续接受teclistamab治疗2年,如果MRD+则接受6个周期的另一种双特异性抗体,即talquetamab(联合D);MRD-患者将接受该治疗2年,MRD+患者将继续进行ASCT。
结论性意见
MRD是目前MM研究中最热门的问题之一。确定MRD作为生存期和治疗监测替代终点所需求的内容是一项重点工作,需要实施最敏感和侵入性较小的技术来评估治疗疗效,特别是如果以完全根除肿瘤细胞为目的。后者在一线治疗中尤其如此,此时应提供可能的最佳治疗,以进一步改善患者预后。
参考文献
Mohty M ,Avet-Loiseau H,Harousseau J.Potential future direction of measurable residual disease evaluation in multiple myeloma.Blood . 2023 Jul 20;blood.2023020284. doi: 10.1182/blood.2023020284.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












