不关注遗传也要检测胚系突变!1/3癌症患者检出阳性,约80%阳性患者可用靶药
2024-08-14 苏州绘真医学 苏州绘真医学 发表于上海
本研究的主要目的是确定可干预PGV的发生率及其在晚期癌症患者中的治疗应用。
传统上,胚系基因检测是在疑似患有遗传性癌症综合征的患者中进行的,以加强癌症监测和/或预防策略,但越来越多地用于治疗指征。研究者对在该中心接受胚系基因检测的患者进行了回顾性审查,以确定可干预致病性胚系变异(PGV)的流行率及其临床效用。
从2000年到2022年,1154名癌症患者接受了胚系检测,其中大多数(945/1154)接受了多基因panels检测。411名(35.6%)患者携带PGV,其中334名(81%)患者具有临床可干预PGV。BRCA1/2占可干预突变的62.3%,其次是错配修复(18%)和其他同源重组修复(HRR)基因(19.7%)。152名胚系阳性患者患有晚期癌症,79名接受了靶向胚系治疗(PARP抑制剂=75;免疫疗法=4)。免疫疗法和PARP抑制剂的中位持续时间分别为20.5个月(范围:5-40个月)和8个月(范围:1-76个月)。在接受铂类化疗的BRCA/HRR突变携带者中,新辅助治疗背景下的病理完全缓解率为53%(n=17例乳腺癌),在晚期背景下的客观缓解率>80%(n=71)。
接受检测的癌症患者中有三分之一携带PGV,其中约80%为临床可干预的。真实世界中,四分之三的胚系阳性晚期癌症患者接受了靶向胚系治疗,凸显了胚系检测在指导癌症治疗方面的实用性。
-
本研究评估了癌症易感基因PGV的治疗意义;
-
在亚洲三级医疗中心的遗传学诊所转诊和接受检测的癌症患者中,三分之一携带胚系PGV;
-
约80%的胚系PGVs位于BRCA1/ 2、其他HRR基因或MMR基因中,并且在临床上可用于治疗;
-
三级医疗中心约75%具有可干预PGV的晚期癌症患者接受了相应的靶向治疗;
-
这项研究强调了真实世界中癌症易感基因胚系检测的治疗意义。
研究背景
从历史上看,指南建议在具有致病性胚系变异(PGV)显著风险的特定人群中对癌症易感基因进行胚系基因检测。胚系基因检测的传统标准包括个人/家族相关癌症史、年轻发病癌症的个人史或多种原发性癌症。胚系基因检测的传统目的是识别可能受益于加强癌症监测和/或预防策略的高危个体。采用这种有针对性的方法的主要原因是检测成本高以及过去基因检测缺乏治疗可行性。
多年来,基因检测的标准和方法已发生了巨大的变化。由于胚系信息可以指导治疗、临床试验入组和患者决策,因此现在越来越多地出于治疗原因进行基因检测。随着新一代测序(NGS)的引入和生物信息学分析的进步,测序技术的改进使得快速有效地检测PGV成为可能,而且成本不高。此外,人们发现了更多的癌症易感基因,例如TP53、ATM、PALB2、CHEK2、RAD51C和RAD51D突变,对这些基因的更深入理解导致更多基因被整合到常规多基因panel检测(MGPT)中。MGPT的广泛使用表明PGV相当常见,可能存在于没有癌症家族史的患者中。
MGPT的广泛使用已证明其有可能改变患者管理。使用未经患者预选的MGPT可检测到更多PGV患者,包括不符合常规检测标准的患者。先前的一项研究报告称,1040名晚期癌症患者中,17%携带PGV,其中超过一半(55%)不符合常规检测标准。许多其他研究也发现,未经家族史选择的实体瘤患者中,有相当一部分(3.9%-56.2%)携带PGV。因此,指南现在支持对更广泛人群进行胚系检测,包括所有卵巢癌、胰腺癌、转移性前列腺癌和转移性乳腺癌患者。
随着精准疗法的出现,检测可干预PGV变得至关重要。同源重组是一种高度精确的DNA修复机制,涉及多种介质,例如BRCA1/2。同源重组修复(HRR)基因缺陷可能会增加多种癌症的风险,尤其是乳腺癌、卵巢癌、胰腺癌和前列腺癌。由于同源重组缺陷(HRD)细胞对聚ADP核糖聚合酶抑制剂(PARPi)敏感,因此这种DNA修复途径具有临床意义。此外,HRD也是铂敏感性的重要介质。它阻止了DNA损伤药物(如铂基化疗)引起的基因损伤的修复,破坏了同源重组的能力,进一步导致基因组不稳定和细胞死亡。
对HRR可干预的理解改变了BRCA1/2突变的乳腺癌、卵巢癌、前列腺癌和胰腺癌的治疗模式,以及以HRD为特征的更广泛的卵巢癌群体,其中各种PARPi已证明作为单一疗法、联合治疗或维持策略有效。此外,免疫检查点抑制剂(ICI)已被批准用于错配修复缺陷肿瘤患者,包括携带错配修复(MMR)PGV的患者。这些靶向胚系基因型的疗法对晚期癌症患者的治疗方法产生了重大影响。
本研究的主要目的是确定可干预PGV的发生率及其在晚期癌症患者中的治疗应用。具体来说,本研究重点关注BRCA1/2/HRR或MMR PGV患者,以及他们对PARPi、铂类化疗或ICI的治疗反应。HRR基因包括BRCA1、BRCA2、ATM、BRIP1、BARD1、CDK12、CHEK1、CHEK2、FANCL、PALB2、PPP2R2A、RAD51B、RAD51C、RAD51D和RAD54L。
研究结果
总体研究人群和PGV发生率:
2000年至2022年间,有3700名患者被转诊至NCIS癌症遗传诊所,接受遗传咨询,以进行遗传性癌症综合征的胚系检测和/或治疗决策。在转诊的3700名癌症患者中,1154名癌症患者接受了胚系检测,其中82%(945/1154)接受了NGS多基因检测。93%的患者(1069/1154)符合基于年轻、多原发癌和/或癌症家族史的常规检测标准;7%(n= 81)不符合常规基因检测标准,接受了专门检测以指导治疗决策。检测年龄中位数为44岁(范围为19-89岁)。85%为女性,65.6%为华裔,其次是其他种族(21%)、马来人(7.7%)和印度人(5.7%)。本队列中最常见的恶性肿瘤是乳腺癌(56%)、卵巢癌(14%)、结肠癌(7.6%)、子宫内膜癌(3.9%)、前列腺癌(3.9%)、胰腺癌(2.6%)和其他癌症类型(11.7%)。对于上皮性卵巢癌(EOC)患者,最常见的亚型是高级别浆液性癌(n=135,69.9%),其次是子宫内膜样癌(n=19,9.8%)、透明细胞癌(n=19,9.8%)、癌肉瘤(n=5,2.6%)和粘液癌(n=4,2.1%)。就癌症分期而言,26.5%为IV期疾病,18.9%为III期疾病,54.6% 为I-II期癌症。
35.6%(411/1154)的患者PGV检测呈阳性,其中334/411(81%)潜在可干预(图1A)。临床可干预的PGV中,BRCA1/2变异占62.3%,其次是MMR变异(18%;MLH1 8.7%、MSH2 6%、MSH6 2.1%、PMS2 1.2%),以及其他HRR基因变异(19.7%;RAD51 6.3%、ATM 4.8%、PALB2 3%、BRIP1 2.4%、CHEK2 2.1%、其他1.2%)(图1B)。其余77名患者(19%)携带不可干预的PGV,包括TP53(4.4%)、MUTYH(2.2%)、RET(2.2%)、APC(1.7%)、SDHB(1.5%)、RAD50(1%)、PTEN(0.7)、SDHD(0.7%)、FH(0.7%)和其他(3.6%)(图1C)。
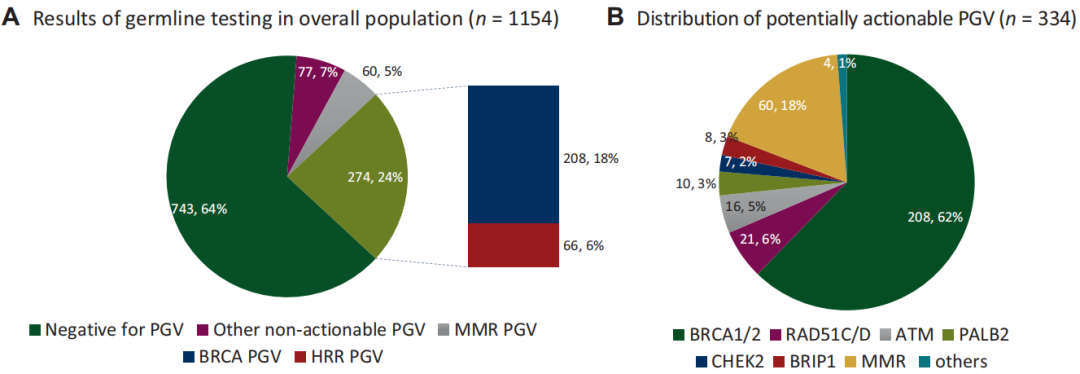
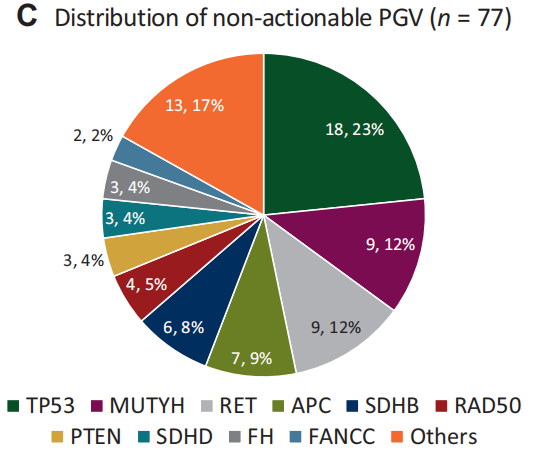

图1
274名患者在BRCA/HRR基因中存在PGV(BRCA=208,HRR=66)。乳腺癌、EOC、前列腺癌和胰腺癌患者中BRCA/HRR PGV的发生率为25.2%、42.2%、23.5%和23.3%。在携带BRCA/HRR PGV的患者中,乳腺癌(n=165,60%)和EOC(n=73,26.7%)是最常见的原发性癌症,其次是前列腺癌(n=12,4.4%)和胰腺癌(n= 7,2.6%)。
60名患者携带MMR PGV,最常见的癌症是结直肠癌(n= 32,53%),其次是子宫内膜癌(n= 12,20%)、乳腺癌(n= 6,10%)和EOC(n= 4,6.7%)。MMR PGV 在结肠癌中的发生率最高(31.1%),其次是子宫内膜癌(22.6%)和EOC(2.1%)。最常见的MMR基因是MLH1(48.3%),其次是MSH2(33.3%)、MSH6(11.7%)和PMS2(6.7%)。大多数患者患有早期癌症,仅15%(9/60)患有晚期癌症。
在411名PGV患者中,152名(37%)患有晚期癌症,定义为任何IV期癌症和III-IV期EOC(表1)。
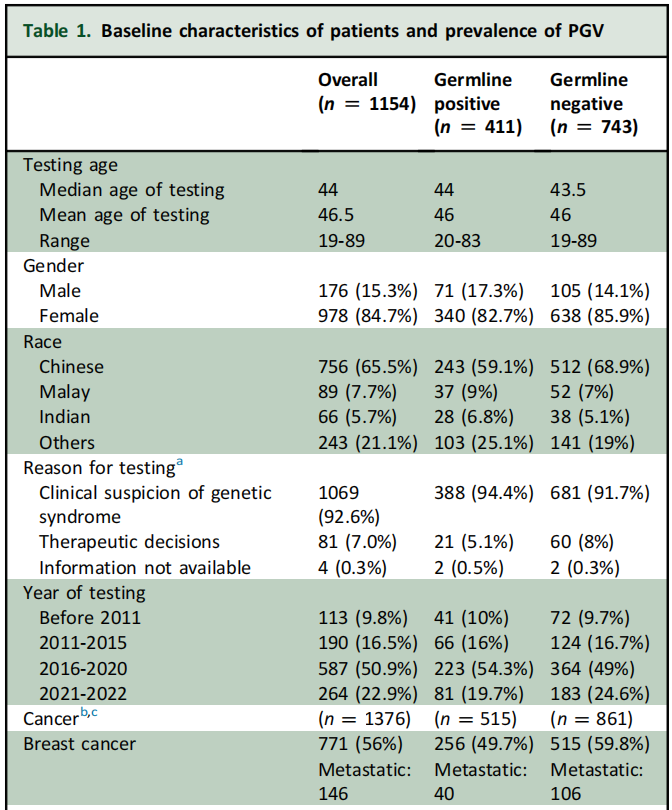
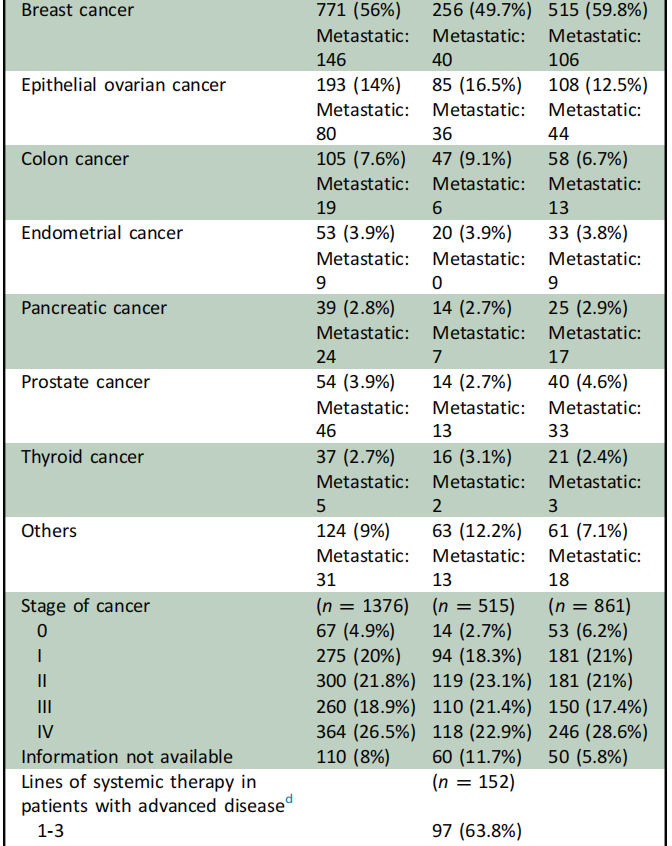

表1
胚系结果的治疗应用:
334/411(81%)PGV 具有潜在治疗意义,包括274(82%)名BRCA/HRR PGV患者和60(18%)名MMR PGV患者。在晚期癌症患者(n= 426)中,137名携带PGV,包括126(92%)名BRCA/HRR患者和11(8%)名MMR PGV患者。在BRCA/HRR携带者中,90 名患者符合PARPi的获批临床适应症。69/90(76.7%)名患者根据获批适应症接受了PARPi治疗,另外6名患者[胆道癌(n=2)、肺癌(n=1)、宫颈癌(n=1)、乳腺癌(n=1)、卵巢癌(n=1)] 接受了非说明书用途治疗。21/90(23.3%)BRCA/HRR携带者符合批准适应症,但由于各种原因未接受PARPi(表2)。
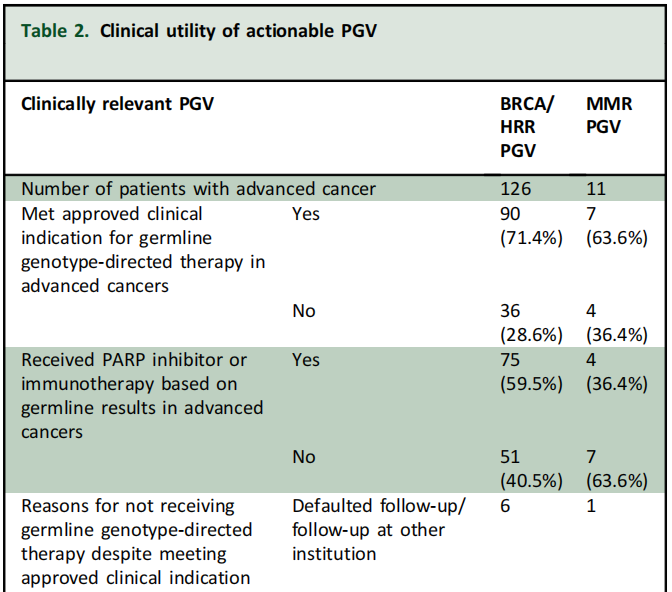
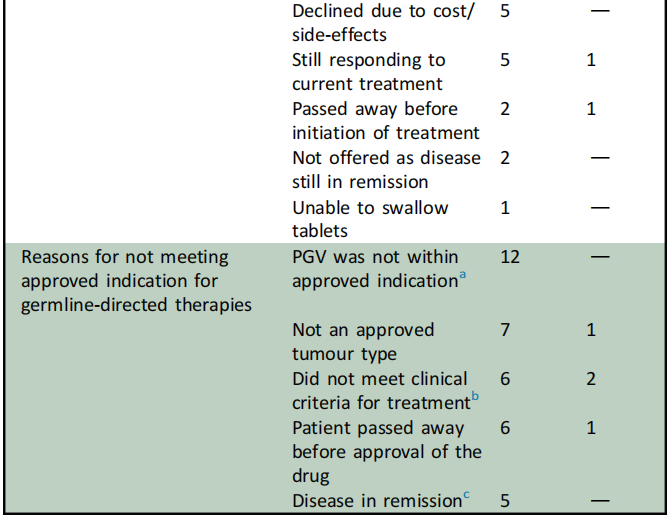

表2
在接受PARPi的BRCA/HRR携带者中,EOC是最常见的原发性癌症(n=49;BRCA 77.6%,其他HRR 22.4%),其次是乳腺癌(n=14;BRCA 92.9%,其他HRR 7.1%),然后是前列腺癌(n=6,BRCA 33.3%,其他HRR 66.7%)和胰腺癌(n=2;BRCA 100%)。本人群中最常用的PARPi是奥拉帕利(n=71),其次是尼拉帕利(n= 2)和维利帕利(n=2)。所有肿瘤类型的PARPi治疗中位持续时间为8个月(范围:1-76个月),EOC为10个月(范围:1-76个月),乳腺癌为9个月(范围:2-23个月),前列腺癌为7.5个月(范围:1-13个月),胰腺癌为4个月(范围:1-7个月)。相比之下,6名接受标签外治疗的患者的PARPi治疗中位持续时间仅为2个月(范围:1-31个月)(表3)。
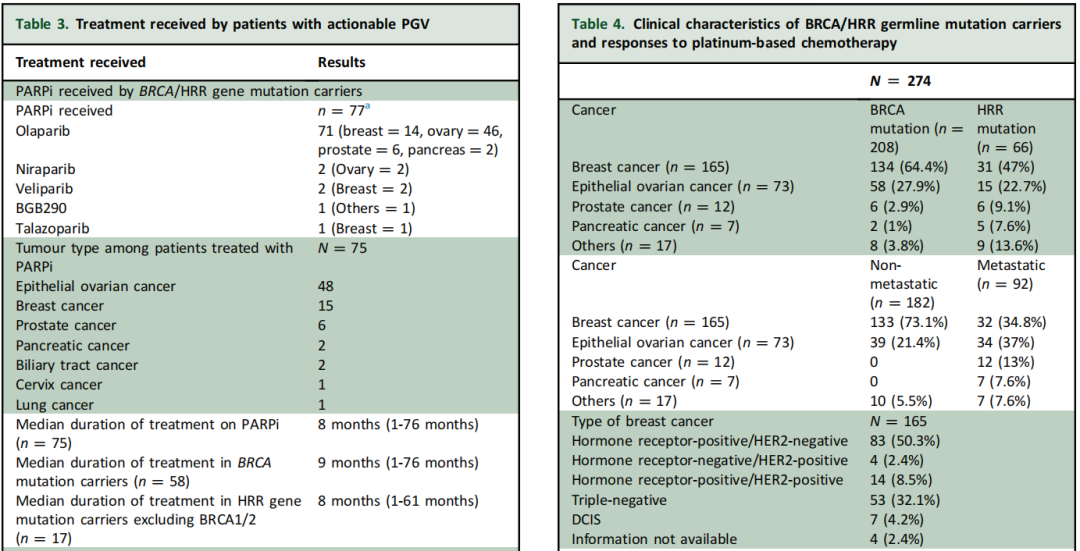
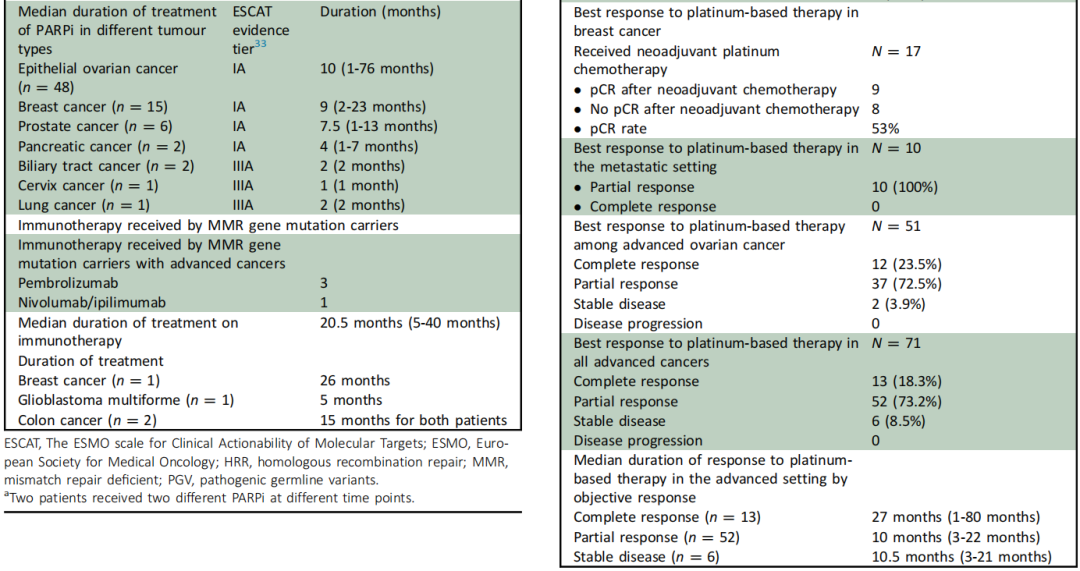
表3、4
在MMR携带者中,有7人符合ICI的批准临床适应症,其中4名患者(结肠癌=2、多形性胶质母细胞瘤=1、乳腺癌=1)实际接受了ICI(帕博利珠单抗=3;纳武利尤单抗/伊匹木单抗=1)。1例结肠癌患者接受了纳武利尤单抗/伊匹木单抗治疗,其他患者接受了帕博利珠单抗治疗。ICI治疗的中位持续时间为20.5个月(范围:5-40个月)。2例结肠癌患者的ICI治疗持续时间分别为40个月和15个月,乳腺癌患者的ICI治疗持续时间为26个月,多形性胶质母细胞瘤患者的ICI治疗持续时间为5个月。
BRCA/HRR人群和对铂类化疗的反应:
研究者分析了BRCA/HRR携带者对铂类化疗的反应。165名乳腺癌患者携带BRCA/HRR PGV,80.6%患有0-III期癌症,19.4%患有IV期癌症,50%患有激素受体(HR)阳性/人表皮生长因子受体2(HER2)阴性亚型,其次是三阴性(32.1%)和HR阳性/HER2阳性亚型(8.5%)。17名患有早期乳腺癌的BRCA/HRR携带者接受了含卡铂的新辅助联合化疗,其中9/17(53%)获得病理完全缓解(pCR)[三阴性乳腺癌(7/11,63.6% pCR),HER2+(2/4,50% pCR),HR+/HER2−(0/2,0% pCR)]。10 名患有晚期乳腺癌的BRCA/HRR 携带者接受了铂类化疗,均获得部分缓解。
在接受铂类化疗的晚期EOC患者中(n=51),客观缓解率(ORR)为96%,其中完全缓解率为23.5%,部分缓解率为72.5%。在接受铂类化疗的所有BRCA/HRR晚期癌症患者中(n=71;卵巢癌=51,乳腺癌=9,胰腺癌=4,前列腺癌=4,其他=3),ORR为91.5%,其中完全缓解率为18.3%,部分缓解率为73.2%。完全缓解患者的中位缓解持续时间为27.5个月(范围:1-80个月),部分缓解患者的中位缓解持续时间为10个月(范围:3-22个月)(表4)。
讨 论
本研究强调了胚系基因检测在指导晚期癌症患者治疗决策方面的效用。研究者发现大约三分之一的患者携带PGV,其中约80%为潜在可干预。本研究中PGV的发生率高于之前研究的7%-17%,主要是因为本研究患者通过三级癌症遗传学诊所进行了检测,并且绝大多数(93%)符合遗传性癌症综合征的疑似临床标准。在本研究中,研究者将可干预PGV的分析限制在BRCA/HRR和MMR基因。值得注意的是,BRCA1/2 PGV占可干预PGV的60%以上,而HRR基因和MMR基因各占约20%。
在患有晚期癌症的BRCA/HRR携带者中,71%符合PARPi治疗的获批临床适应症。超过四分之三的患者在真实世界中接受了PARPi治疗,凸显了胚系基因信息在亚洲高度发达国家的高度治疗效用。治疗的中位持续时间与之前报告的数据基本一致。这些真实世界的数据凸显了胚系基因检测对指导治疗决策的重要性。仅肿瘤测序已被提议检测致病胚系和体细胞变异。然而,这种方法可能无法检测到约10%的临床相关PGV。因此,肿瘤测序阴性的高危患者仍应接受胚系基因检测。除了高危患者,胚系检测还可以扩展到患有罕见肿瘤类型的患者。例如,先前的一项研究表明,在纯胰腺腺泡细胞癌患者中,BRCA/HRR基因突变的PGV 率很高(48%)。这有助于选择可能受益于高效靶向胚系疗法的患者,对生存结果有潜在积极影响。PGV检测不理想可能会阻碍治疗努力。如果资源允许,这进一步支持考虑对具有潜在治疗意义的肿瘤类型进行常规胚系检测。
在未来几年,更多患者可能会受益于靶向胚系治疗。除了晚期患者,PARPi还在早期疾病中确立了适应症,III期OlympiA试验证明,奥拉帕利在胚系BRCA1/2突变高危早期乳腺癌中作为辅助治疗具有无病生存率和总体生存率获益。美国食品药品监督管理局(FDA)批准奥拉帕利用于乳腺癌辅助治疗,这是一个重要里程碑,大大扩大了可受益于靶向胚系治疗的患者群体。目前,PARPi正在胰腺癌(APOLLO试验,NCT04858334)、乳腺癌(PARTNER试验,NCT03150576;OlympiaN,NCT05498155)和前列腺癌(NePtune 试验NCT05498272)的辅助/新辅助治疗中进行研究。
在本队列中,BRCA/HRR PGV的发生率(42.2%)高于文献中报道的,即17%-25%未经选择的EOC患者检出BRCA/HRR PGV。在本研究中,BRCA/HRR PGV发生率较高的原因有几个:本队列是一个经过高风险癌症遗传学诊所检测的高度选择性人群,其中大多数人在临床上怀疑患有遗传性癌症易感综合征。此外,大多数患者(80%)都接受了MGPT。广泛的panel检测可能导致非BRCA HRR PGV的检出率更高,从而导致BRCA/HRR PGV的总体发生率更高。
在接受新辅助化疗的BRCA/HRR乳腺癌患者中,pCR率为53%,与之前的研究一致。在转移性环境中,BRCA/HRR患者对铂类化疗的ORR非常高,为91.5%,其中完全缓解率为18.3%,部分缓解率为73.2%,中位持续时间分别为27个月和10个月,具有极强的临床意义。这些发现支持将铂类化疗纳入BRCA/HRR PGV患者的治疗手段中,在资源有限的环境中尤其重要。
研究者还将MMR PGV患者纳入分析,因为ICI已获FDA批准用于此类患者。在本研究中,4名MMR PGV携带者接受了ICI,疾病得到了持久控制,这具有临床意义,并进一步支持对更广泛的癌症人群进行胚系检测,以确定可能受益于免疫疗法的错配修复缺陷型肿瘤患者。本研究的主要优势在于,这是第一项以大样本量在真实世界亚洲人群中研究胚系检测的临床效用的研究。然而,本研究受到回顾性质的限制,存在固有偏见,并且应用于研究人群的基因panel类型也存在差异。
在三级癌症中心接受检测的癌症患者中,约有三分之一携带PGV,其中约80%潜在可干预。约四分之三携带可干预PGV的晚期癌症患者接受了靶向胚系治疗,证实了胚系检测在指导真实世界治疗方面的临床效用。胚系基因检测现在具有重要的治疗意义。随着靶向胚系治疗的范围不断扩大,未来增加胚系检测资源以指导真实世界中的精准肿瘤治疗的方法至关重要。
参考文献:
Cheo SW, Ong PY, Ow SGW, et al. Therapeutic applications of germline testing for cancer predisposition genes in Asia in the real world. ESMO Open. 2024;9(6):103482. doi:10.1016/j.esmoop.2024.103482

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#癌症患者# #胚系基因检测# #致病性胚系变异#
42