Adv Sci:南方医科大学周爱东团队发现FBXO7调控胶质母细胞瘤间充质特性和耐药性的新机制
2023-10-30 医药加学习班 医药加学习班 发表于上海
该研究表明FBXO7是SCF复合物的底物识别成分,与帕金森病的发病机制有关,其通过控制Rbfox2介导的选择性剪接赋予GBM间充质特性和化学抗性。
间充质胶质母细胞瘤(GBM)对放疗和化疗具有高度耐药性,导致GBM患者生存结局较差。然而,尚不清楚决定间充质表型的潜在机制。
2023年10月11日,南方医科大学周爱东团队在Advanced Science 在线发表题为“FBXO7 Confers Mesenchymal Properties and Chemoresistance in Glioblastoma by Controlling Rbfox2-Mediated Alternative Splicing”的研究论文,该研究表明FBXO7是SCF复合物的底物识别成分,与帕金森病的发病机制有关,其通过控制Rbfox2介导的选择性剪接赋予GBM间充质特性和化学抗性。具体来说,FBXO7通过PRMT5在Arg341和Arg441的精氨酸二甲基化,通过K63连接的泛素链使Rbfox2 Lys249泛素化,稳定Rbfox2。
FBXO7调控Rbfox2介导的间充质基因剪接,如FoxM1、Mta1和Postn。XO7诱导的FoxM1外显子Va包入促进MEK1和核易位的FoxM1磷酸化,从而上调CD44、CD9和ID1水平,导致GBM干细胞自我更新和间充质转化。此外,通过替莫唑胺稳定FBXO7,FBXO7耗竭使小鼠中的肿瘤异种移植物对化疗敏感。结果表明,FBXO7-Rbfox2轴介导的剪接有助于间充质转化和肿瘤发生,靶向FBXO7是GBM治疗的潜在策略。

胶质母细胞瘤(GBM)是最具侵袭性的中枢神经系统(CNS)肿瘤,对常规放疗和化疗具有高度耐药性。GBM肿瘤由异质肿瘤细胞群组成,包括具有干细胞特性的细胞群,称为胶质母细胞瘤干细胞(GSCs)。该团队已有表明,GSCs在GBM的发生、化疗/放疗耐药和复发中起着关键作用。了解GSCs的调控机制将有助于确定新的治疗靶点,并为GBM的治疗开发更有效的方法。
根据分子特征,GBM可以分为不同的亚型。从生物学上讲,GBM可分为前神经型(PN)和间叶型(MES)两种不同亚型与PN GBM亚型(PN-GBM)相比,MES亚型(MES-GBM)预后更差。近期研究结果表明,大多数GBM亚型起源于常见的类PN前体神经胶质瘤,从PN向MES的演变被认为是化疗/放疗耐药、肿瘤复发和患者死亡的主要原因。此外,放疗和化疗诱导GBM MES转化,大多数复发性GBM肿瘤属于MES亚型。然而,目前对GBM进展和复发期间决定表型转换的分子机制知之甚少。
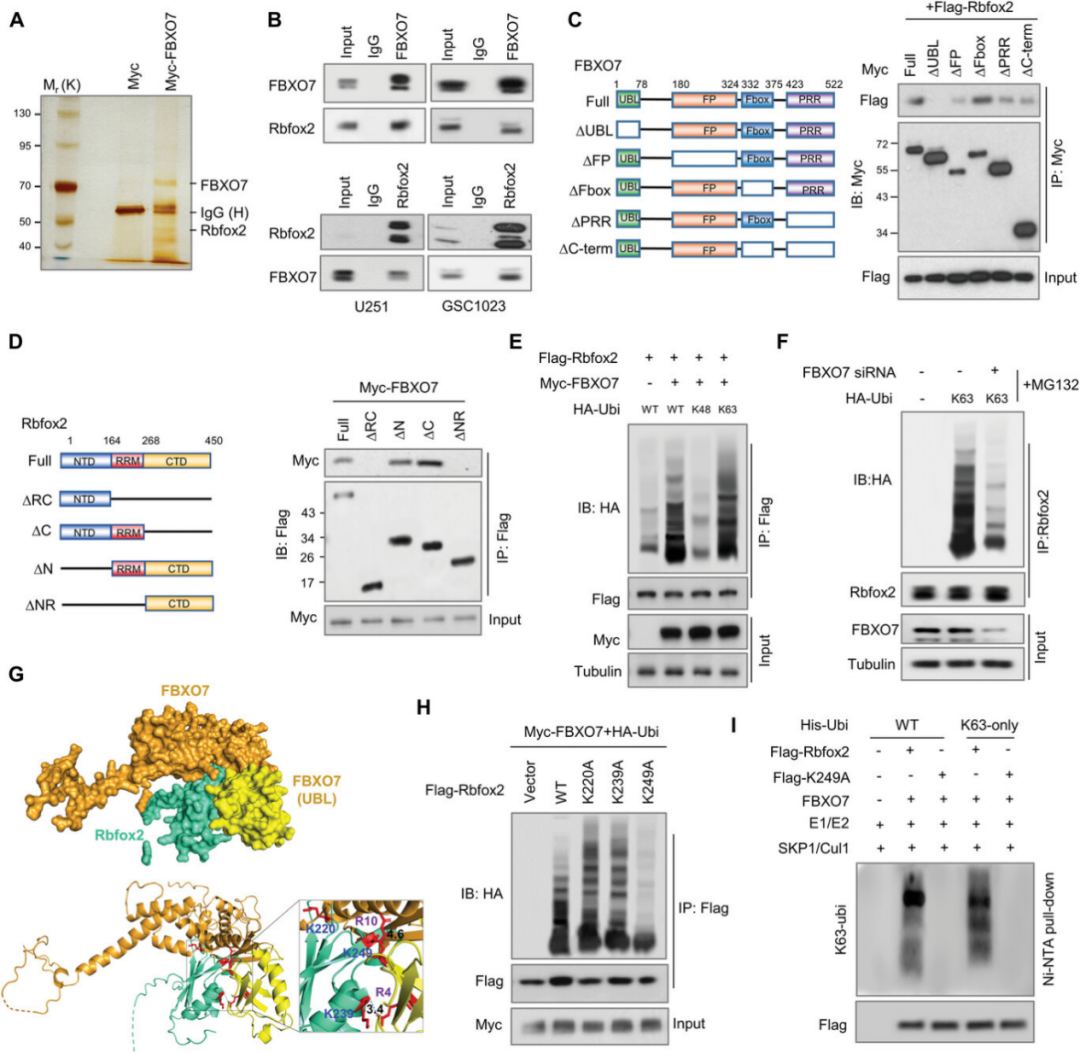
FBXO7与Rbfox2相互作用并在K249处促进Rbfox2的K63连锁泛素化(摘自Advanced Science)
FBXO7也称为Park15,是FBP家族的一员。像该家族的其他成员一样,FBXO7作为Skp1-cullin1-F-box蛋白(SCF)泛素E3连接酶复合物的底物识别成分发挥作用。此外,FBXO7还通过不依赖SCF的方式介导底物泛素化。FBXO7对神经元的生长和发育至关重要。小鼠中FBXO7的敲除往往导致神经元过早死亡,使得胚胎死亡。FBXO7的突变使FBXO7蛋白不稳定,其在帕金森病(PD)中尤为常见,是早发性PD的主要原因。相关研究表明,FBXO7的突变或缺乏将导致线粒体功能障碍和线粒体自噬受阻,从而导致PD的发生。FBXO7在癌症研究中的报道很少,且研究结果往往相互矛盾。据报道,FBXO7在肺癌和结肠直肠癌中高度表达,并促进细胞周期蛋白D/Cdk6依赖性成纤维细胞转化。另一方面,FBXO7是基因组稳定性所必需的,并抑制结肠直肠癌的发生和发展。
流行病学研究表明,神经退行性疾病(ND)与中枢神经系统肿瘤呈负相关。这可能涉及细胞存活的极端差异:PD是由细胞过早死亡引起的,而癌症是由不受控制的细胞生长引起的。尽管参与PD发病机制的少数基因已被证明可调控GBM的发生,但仍不清楚PD和GBM之间潜在作用机制。该研究确定FBXO7是GBM肿瘤发生、MES转化和耐药的关键调节因子,发现FBXO7通过K63连接的泛素化稳定Rbfox2,并控制Rbfox2介导的间充质基因的选择性剪接,从而促进GBM MES转化和化疗耐药。靶向FBXO7-Rbfox2轴成为治疗GBM的潜在策略。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202303561
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言