前列腺癌是男性第二大常见的癌症,是男性癌症死亡的第三大常见原因,2018年WHO统计新增病例约130万,大约20%的患者出现转移。对去势敏感和去势抵抗的前列腺癌患者的治疗现在包括多种类型的化疗(docetaxel, cabazitaxel)和新型激素制剂(abiraterone,enzalutamide, apalutamide, darolutamide),所有这些都能提高患者的生存率和生活质量。然而,接受标准治疗的患者的生存率仍然很低。 前列腺特异性膜抗原(PSMA)是一种非分泌性膜酶,具有羧肽酶和叶酸水解酶的活性,具有较大的细胞外结构域。PSMA受体在前列腺癌细胞中具有致癌信号作用,作用于谷氨酸受体并激活Pi3 K和Akt生长途径。它在90%的转移性前列腺癌中过表达,而在正常组织中生理表达水平较低(前列腺、小肠、唾液腺和泪腺以及肾脏)。 在过去的十年中,已经创建了许多针对该蛋白的疗法,许多临床研究已经积极证明了靶向PSMA放射性配基治疗(PRLT)的耐受性和有效性。目前,针对放射性药物靶向性的改进以及与其他肿瘤药物的联合正在研究中,以进一步提高其治疗效果。这些令人鼓舞的结果导致了以PSMA为靶点的其他疗法的发展,如PSMA CAR-T细胞治疗、PSMA靶向ADC和PSMA靶向双特异性T细胞导向疗法。 PSMA蛋白也称为谷氨酸羧基肽酶II和叶酸水解酶1,它是一种跨膜糖蛋白酶,存在于细胞表面。PSMA蛋白分为三部分,即胞内区、跨膜区和胞外区,胞外区占PSMA蛋白的95%,是小分子和抗体作用的主要位点。 PSMA糖基化是酶活性所必需的,并以二聚体和单体形式存在于顶端细胞表面。其很短的具有19个氨基酸的胞内结构域含有一个MXXXL基序,该基序通过与网格蛋白适配器蛋白2复合物相互作用介导内化。胞内结构域与丝蛋白A结合,作为更大的大分子复合物的一部分,包括整合素β1、p130 Crk相关底物、c-SRC和表皮生长因子受体并最终激活蛋白激酶B(AKT)通路和MAPK通路促进增殖和存活。 此外,PSMA的官方基因名为叶酸水解酶1(FOLH1),反映其在叶酸摄取中的主要作用。细胞内叶酸浓度被认为是一把双刃剑,低水平与染色体损伤易感性增加有关,而高水平则增加肿瘤生长。由于PSMA可能内化其配体,因此它可能参与前列腺组织中叶酸的摄取。事实上,研究发现,表达PSMA的细胞对叶酸的摄取增加了2倍,这表明PSMA可能与叶酸转运有关。 PSMA在前列腺癌以外的一些肿瘤的新生血管系统中也有表达。与野生型动物相比,PSMA基因敲除动物的血管生长显著减弱,同样,PSMA抑制剂2-磷酰甲基戊二酸可以阻止新生血管的形成。对不同细胞外基质蛋白的检测表明,PSMA对血管的侵袭是由层粘连蛋白介导的。 放射配基或放射性核素治疗包括紧密耦合的诊断和治疗程序。第一步涉及使用PSMA正电子发射断层扫描(PET)/计算机断层扫描(CT)进行诊断性扫描,以评估肿瘤PSMA的表达。在生物分布良好的情况下,使用放射性同位素标记的PSMA配体(如177Lu或131I)治疗。 利用放射性标记(177Lu或90Y)PSMA mAb J591的1期和2期临床试验显示了有希望的结果,其靶向细胞外结构域,然后通过内吞作用被内化,然而,其具有较高比例的不可逆血液学毒性。此外,使用131I标记的PSMA配体进行的首次临床试验结果显示,在60%接受治疗的PC患者中,PSA降低>50%,且仅具有轻微的血液毒性和良好的效果。下表显示了目前已经在人类中使用的治疗分子。 在前列腺癌中,一些ADC目前正在临床开发中,其靶点包括PSMA、STEAP-1、TROP2、CD46和B7-H3。PSMA靶向ADC的早期研究结果显示出一定的活性。 MLN2704包含与有效载荷maytansinoid-1连接的人源化J591抗体。在一项对62名采用不同治疗方案的患者的研究中,5名患者(8%)出现PSA50反应。观察到包括周围神经病变在内的不良事件,10%为3级或以上。 Petrylak等人报告了另外一种PSMA ADC的II期研究结果,这种PMSA靶向ADC是与单甲基auristatin E(MMAE)偶联的完全人源化IgG1单克隆抗体。在119名接受abiraterone或enzalutamide治疗后进展的患者中,14%的患者出现PSA50反应。不良反应包括粒细胞减少(32%),以及3级神经病变(8%)等,最终导致31%的患者停止治疗。 MEDI3726是一种使用吡咯苯二氮卓二聚体(PBD)有效载荷的PSMA靶向ADC。在报告的33名患者中,在不同剂量水平的治疗下,有3名(9%)患者出现PSA50反应。然而,包括毛细血管渗漏综合征和皮肤毒性在内的不良事件导致39%的患者停止治疗。 基于这三项研究,以PSMA为靶点的ADC在CRPC中确实具有一定的活性,然而,与治疗相关的不良事件限制了其治疗的能力。 在前列腺癌中,一些CAR-T细胞研究目前正在进行中,其中许多靶向PSMA。 Junghans等人报告了PSMA靶向CAR-T细胞的I期试验结果。在这项研究中,五名患者接受了预处理化疗,随后接受PSMA靶向的CAR-T细胞以及持续输注低剂量IL-2。所有患者均证实CAR-T细胞植入,其中两名患者达到PSA50反应,在所有患者中均未观察到CRS。 Slovin等人介绍了7名患者在条件化疗后接受PSMA靶向CAR-T细胞治疗的结果,其中CAR-T细胞在血液中持续存在长达两周,一名患者病情稳定>16月。 与其他靶向免疫治疗方法一样,PSMA是前列腺癌双特异性T细胞导向疗法的一个极具吸引力的靶点。 Pasotuxizumab/BAY2010112/AMG 212 临床研究中最领先的PSMAxCD3双抗是Bayer和Amgen开发的Pasotuxizumab/BAY 2010112/AMG 212。该分子与Blinatumomab相似,以BiTE形式构建。这种结构形式使Pasotuxizumab与Blinatumomab有相同的缺点:半衰期短,这是因为这种结构不含Fc部分,不能结合到能够延长半衰期的FcRn受体。因此,需要繁琐的连续输注,而且成本较高。 在一项I期临床研究中,Pasotuxizumab在转移性CRPC患者中剂量递增,以评估最大耐受剂量(MTD),但由于试验提前终止而未能达到。试验中分别对31例和16例患者进行皮下注射(SC)和静脉持续输注(IV),3例患者出现CRS。特别相关的是观察到SC组的所有可评估患者均出现ADA,而IV组未观察到ADA。SC组和IV组分别有9名和3名患者的PSA降低>50%,其中包括两名长期应答者。 AMG-160 AMG160是新一代半衰期延长的BiTE结构,两个单链抗体片段附着于IgG抗体的Fc部分,导致半衰期延长。 在I期临床研究中,每2周AMG160通过短期静脉输注给药,43例转移性CRPC患者接受了≥1剂AMG 160的治疗,其中41例(95.3%)出现不良反应。然而,未达到最大耐受剂量。总的来说,68.6%的患者在所有剂量组中显示PSA下降,与Pasotuxizumab类似,34.3%的患者显示PSA下降超过50%。尽管临床看到了一些效果,但这种结构的免疫原性似乎是一个问题:在评估出现ADA的30名患者中,有6名(20.0%)患者的ADA水平已发展到影响药物暴露水平,尽管是静脉注射。AMG 160与pembrolizumab联用的研究目前正在进行。 APVO414/MOR209/ES414 APVO414/MOR209/ES414是一种所谓的ADAPTIR形式的PSMAxCD3双抗,由正常IgG抗体中的Fc部分和两个单链抗体片段组成。与HLE-BiTE的格式相似,Fc部分延长了半衰期。 然而,尽管有很好的临床前结果,但由于该结构具有很高的免疫原性,临床试验被迫中止了。这在一定程度上与HIE-BiTE的研究结果一致,接受每周一次APVO414静脉输注的12例转移性CRPC患者中有7例发生ADAs,在改用持续输注后,仍有50%的患者出现ADAs,尽管水平较低。目前,APVO414的临床开发已被搁置,可能是由于免疫原性问题。 HPN424 与前面的结构不同, HPN424不是双特异性,而是三特异性抗体,即所谓的TriTAC模式,其以单价形式针对CD3和PSMA。除了PSMA和CD3,它还具有与人血清白蛋白(HSA)结合的特异性,可延长血清半衰期,其在食蟹猴的半衰期约为80小时。其中CD3结合域是单链抗体片段,而HSA和PSMA是单域抗体。与单链抗体相比,单域抗体提供了更高的稳定性,但也存在更高免疫原性的潜在缺点。 目前,HPN424在一项I期研究中进行评估,以确定在晚期CRPC患者中的MTD。截至2020年5月,44名转移性CRPC患者每周接受一次治疗,临床疗效的迹象观察到包括许多患者的PSA降低,有8名患者超过24周。HPN424的半衰期约为24.9小时,在大约7%的患者中观察到ADA。 JNJ-63898081 JNJ-63898081是一种所谓的duobody形式,是基于IgG4的Fab-arm交换的特性进行双特异性抗体开发平台。JNJ-63898081目前正在转移性CRPC患者的一期研究中进行评估,尚未报告结果。 CC-1 这是一种所谓的IgGsc形式,靶向PSMA和CD3,被命名为CC-1。在这种形式下,单链抗体片段融合于IgG1抗体Fc部分的羧基端。一方面,由于其修饰的Fc部分与FcRn保持结合,因此具有延长半衰期的优势;另一方面,相比BiTE,它的免疫原性较低。 2019年,CC-1在CRPC患者中的一项开放标签、多中心剂量递增和剂量扩增的一期试验正在有效招募,以评估其在安全性、有效性和免疫原性方面的临床效果。 PSMA是改善男性前列腺癌患者预后的极好靶点。PRLT在标准治疗后进展的前列腺癌患者中显示出低毒性和高效性,III期试验的结果显示总体生存率有所提高,然而,由于大多数患者倾向于复发,因此需要探索更好的策略以获得更深入和更持久的反应。 针对PSMA的非放射性方法也引起了人们的兴趣。其中,基于早期试验的双特异性T细胞导向疗法是最有希望的免疫治疗。随着具有良好性质和组合方法的新结构不断出现,有望克服目前的局限性,并在未来几年内使PC患者的治疗方面取得突破性进展。 参考文献: 1. PSMA targeting in metastaticcastration-resistant prostate cancer: where are we and where are we going? Ther Adv Med Oncol. 2021; 13: 17588359211053898. 2. Bispecific Antibodies inProstate Cancer Therapy: Current Status and Perspectives. Cancers (Basel). 2021 Feb; 13(3): 549. 3. PSMA Theranostics: CurrentStatus and Future Directions. Mol Imaging. 2018Jan-Dec; 17: 1536012118776068. 4. A Perspective on the EvolvingStory of PSMA Biology, PSMA-Based Imaging, and Endoradiotherapeutic Strategies.J Nucl Med. 2018 Jul; 59(7): 1007–1013. 公众号已建立“小药-生物资源对接服务平台”微信行业交流群以及读者交流群,扫描下方小编二维码加入,入行业群请主动告知姓名、工作单位和职务。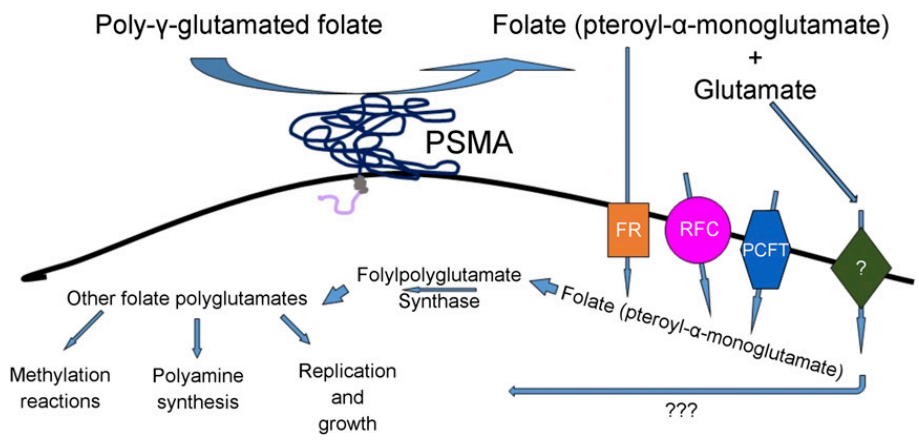

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






