【Blood Adv】双特异性T细胞衔接抗体治疗多发性骨髓瘤的耐药机制及其临床意义
2024-03-31 聊聊血液 聊聊血液 发表于陕西省
《Blood Advances》近日发表综述,阐述了导致双特异性TCE耐药的肿瘤内在(tumor-intrinsic)和肿瘤外在(tumor-extrinsic)机制,以及其临床意义。
MM中双特异性TCE
双特异性 T 细胞衔接抗体 (TCE) 正在彻底改变多发性骨髓瘤 (MM) 的患者治疗,它们可重定向 T 细胞以对抗癌细胞,其中靶向CD3和BCMA的teclistamab和elranatamab已在国外获批用于治疗三类暴露复发/难治性多发性骨髓瘤 (RRMM),分别是基于Majestec-1和Magnetismm-3研究。此外,靶向其他肿瘤抗原(例如FCRH5和GPRC5D)的双特异性TCE也证实疗效良好,靶向GPRC5D的talquetamab双特异性TCE也获批治疗RRMM(基于MONUMENTAL-1研究)。
双特异性TCE还正在早期治疗中进行研究,包括一线治疗。但研究中约三分之一的 RRMM 患者发生原发性耐药,大多数缓解者也会最终发生获得性耐药。因此了解双特异性 TCE 的耐药机制对改善 MM 的免疫治疗至关重要。
《Blood Advances》近日发表综述,阐述了导致双特异性TCE耐药的肿瘤内在(tumor-intrinsic)和肿瘤外在(tumor-extrinsic)机制,以及其临床意义。

TCE耐药的临床决定因素
临床试验确定了预测BCMA BsAb 疗效不佳的多个基线临床因素,包括存在髓外病变 (EMD)、ISS III 期和难治性状态。在 Magnetismm-3 研究中,EMD患者对 elranatamab 的 ORR 为38.5%,而无 EMD 的患者为71.4%。ISS III期(与 ISS I-II期相比)和 五药难治性疾病(与无五药难治性相比)患者的缓解率也低于elranatamab。在 Majestec-1研究中,EMD或 ISS III 期患者对 teclistamab 的 ORR 也显著较差。EMD 患者对 teclistamab 的缓解率较低可能与该人群中可溶性 BCMA 水平较高有关。高肿瘤负荷也与elranatamab(骨髓[BM]浆细胞>50%)和teclistamab(BM浆细胞>60%)的缓解率较低相关。而高危细胞遗传学风险未显著影响两药的缓解率。
Talquetamab 是迄今为止唯一获批的GPRC5D BsAb。在 Monumental-1研究中,髓外病变是唯一显著影响缓解率的基线临床特征,EMD患者每周一次和每两周一次队列的中位 ORR 分别为48.5%和43.2%,而无EMD患者的中位 ORR 分别为81.8%和88%;ISS、细胞遗传学和难治性状态对talquetamab 的缓解无显著影响。
TCE耐药的肿瘤内在机制
TCE耐药的肿瘤内在机制包括:TNFRSF17基因失活、GPRC5D遗传学或表观遗传学失活、MHC I 类分子缺失。
BCMA TCE 治疗前和复发时骨髓瘤细胞的全基因组测序 (WGS)发现,TNFRSF17 基因(编码BCMA蛋白)的基因失活是常见的肿瘤内在耐药机制。
GPRC5D 的突变景观多涉及沿蛋白序列分布的截断突变,与 TNFRSF17 的热点突变形成鲜明对比,TNFRSF17可改变 TCE 识别,同时保留BCMA 介导的促生存信号(图1)。对 GPRC5D TCE 的耐药性通常为靶标的完全失活,表明骨髓瘤细胞对GPRC5D缺失的耐受性优于对BCMA缺失的耐受性。
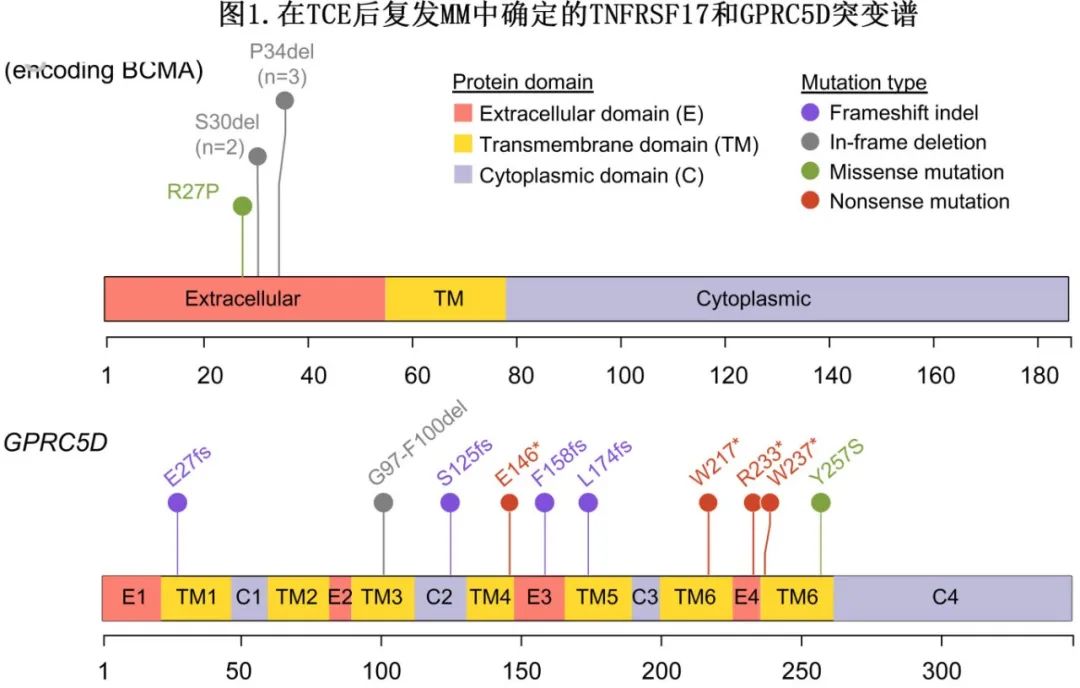
多项证据发现,在靶抗原缺失的基础上,MHC I 类分子缺失也是 TCE 耐药的潜在肿瘤内在机制。首先,TCE治疗后 MHC I 类 (HLA-E、HLA-C) 和 II 类基因 (CD74) 的表达失调。其次,在部分患者中,通过流式细胞术在复发时发现 MHC I 类表面表达缺失。然而,MHC I类分子表达缺失的频率和因果机制仍有待确定。
肿瘤外在耐药机制
双特异性 TCE 治疗的反应受到多种肿瘤外在因素的影响,包括预先存在的 T 细胞全景、T 细胞全景的演变和骨髓瘤细胞产生的免疫抑制性肿瘤微环境,并与既往治疗相关。
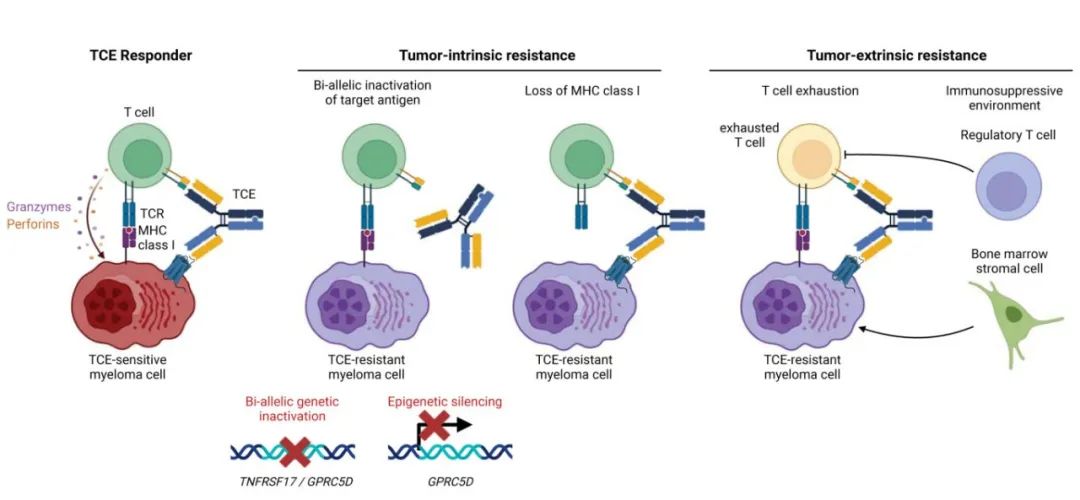
图2总结了TCE耐药的肿瘤内在和肿瘤外在机制。
临床意义
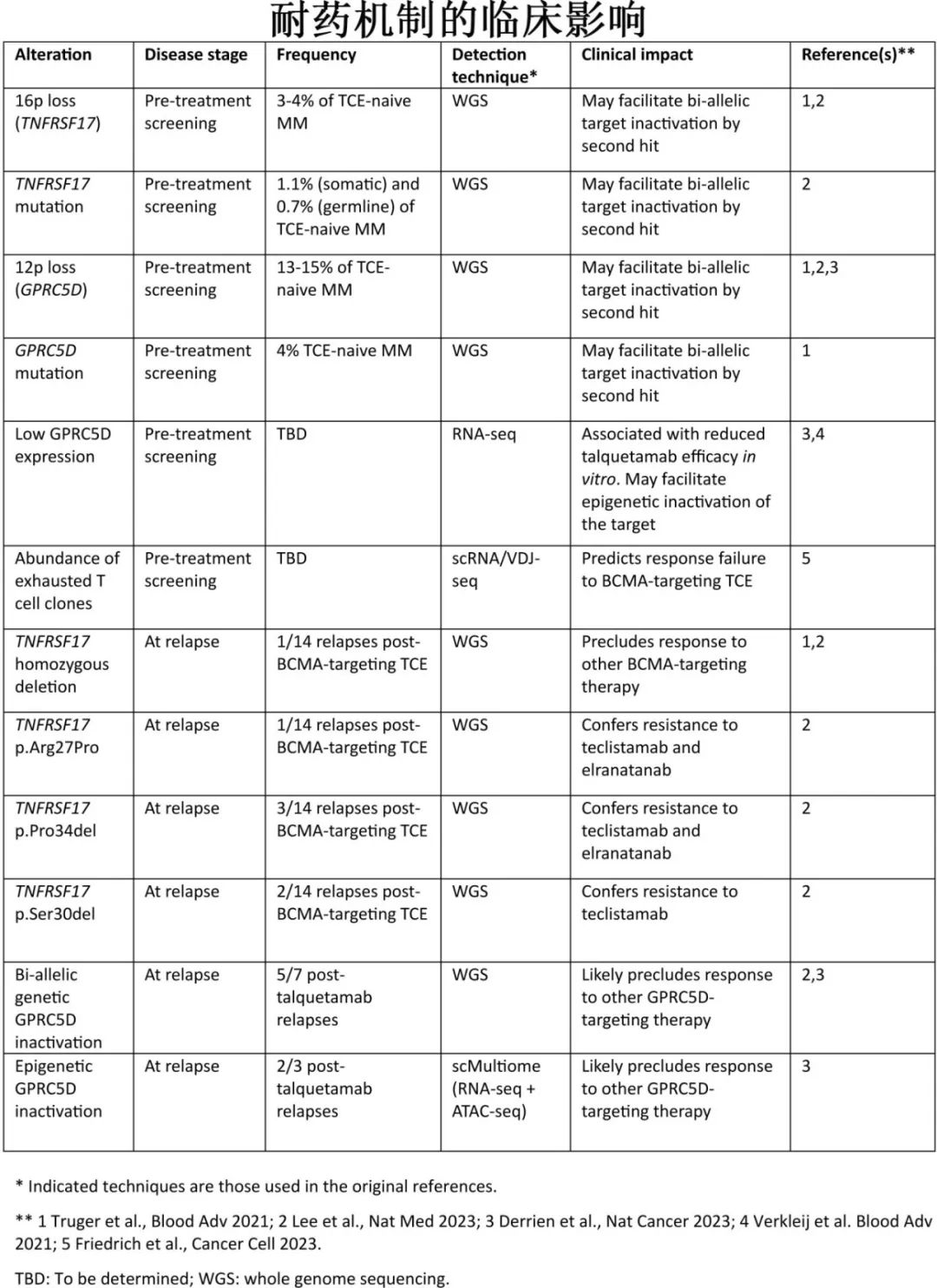
确定TCE 耐药的分子学机制,可为指导未来多发性骨髓瘤的免疫治疗提供有价值的见解。治疗前确定肿瘤细胞中靶抗原和免疫细胞库的分子特征,可有助于为每例患者选择最合适的免疫治疗;复发时了解耐药的分子学原因,将有助于选择后线治疗和调整免疫治疗排序。
总结
本文回顾了最近关于双特异性 TCE 耐药的临床和分子学因素的研究,耐药性可来自肿瘤内在或肿瘤外在机制。肿瘤固有耐药性包括导致靶抗原丢失的各种改变,如染色体缺失、点突变或表观遗传沉默;MHC I 类分子的缺失,可阻止 MHC I 类分子:TCR共刺激信号,也有报道。肿瘤外在耐药机制包括丰富的耗竭 T 细胞克隆和产生免疫抑制微环境的多个因素。重要的是,部分耐药机制损害对一种 TCE 的反应,但同时保留了其他 TCE 的疗效。上述发现具有临床意义,监测肿瘤细胞中靶抗原的状态及其免疫环境将是为每例患者选择最合适 TCE 的关键,以及设计多发性骨髓瘤免疫治疗的组合和排序策略
参考文献
Letouzé E, et al. Mechanisms of resistance to bispecific T cell engagers in multiple myeloma and their clinical implications.Blood Adv . 2024 Mar 21:bloodadvances.2023012354. doi: 10.1182/bloodadvances.2023012354.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#双特异性T细胞衔接抗体# #多发性骨髓瘤#
98