Nature:大脑-脂肪回路控制肥胖症
2021-08-19 haibei MedSci原创
该研究确定了一个神经-间质单位,它将来自长距离神经回路的线索转化为脂肪驻留的ILC2功能,从而塑造了宿主的代谢和肥胖。
肥胖是由于脂质堆积过多造成的,这些脂肪储备在饮食匮乏时期可作为高能量来源。已有的研究显示,来自交感神经元和免疫细胞的信号调节脂肪细胞,从而促进了脂肪组织生物学的发展。交感神经元活动驱动脂肪分解,而第2组先天性淋巴细胞(ILC2s)通过2型先天性细胞因子和Met-enkephalin(Met-enk)促进内脏脂肪组织的代谢。
最近的研究进展表明,神经和免疫系统之间的相互作用已成为宿主防御和炎症的重要调节因素。然而,目前我们还不清楚神经元和免疫细胞是否在脑-体轴中合作,以协调代谢和肥胖。研究人员最近提出了一个假设,即神经系统和ILC2合作,利用高阶的脑-体界面控制脂肪生理学。

最近,研究人员描述了一个神经-间质单元,它通过脑-脂肪回路控制第2组先天性淋巴细胞(ILC2s)、脂肪组织生理学、代谢和肥胖。研究人员发现,交感神经末梢通过β2-肾上腺素受体作用于邻近的脂肪间质细胞,控制胶质神经营养因子(GDNF)的表达和性腺脂肪中ILC2s的活性。因此,ILC2s自主操纵GDNF受体机制导致ILC2功能、能量消耗、胰岛素抵抗和肥胖倾向的改变。
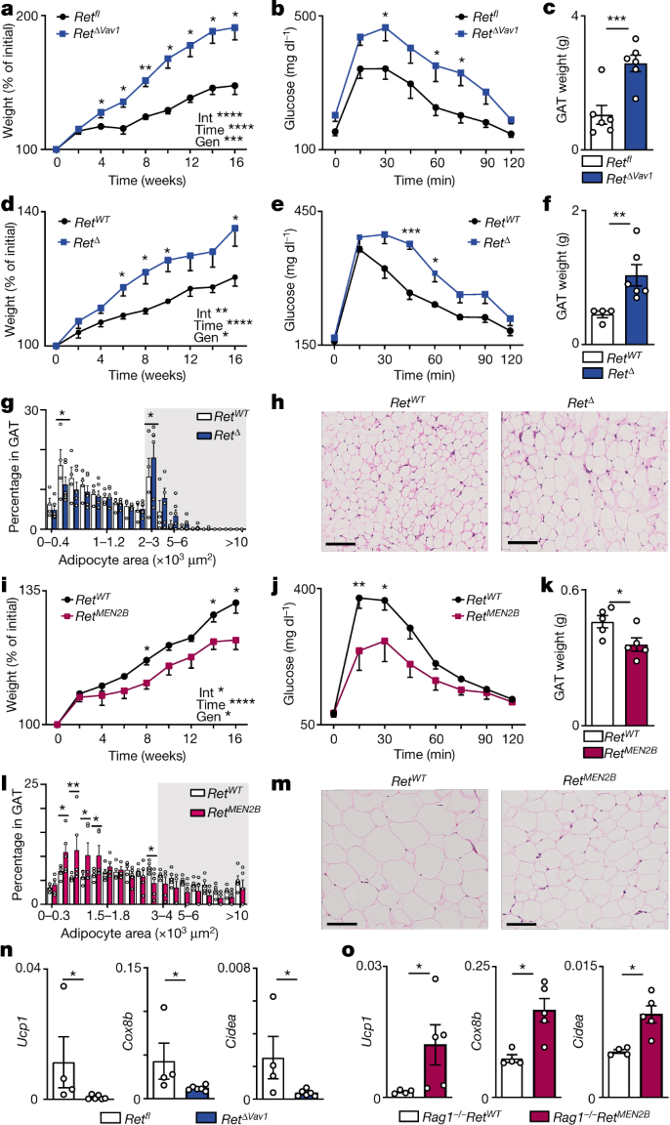
ILC2-内在的RET线索控制着脂肪组织的生理学和肥胖
此外,研究人员利用逆行追踪以及化学、手术和化学遗传学操作,确定了一个交感神经主动脉回路,该回路调节性腺脂肪中的ILC2s,并与高阶脑区相连,包括下丘脑室旁核。
总之,该研究确定了一个神经-间质单位,它将来自长距离神经回路的线索转化为脂肪驻留的ILC2功能,从而塑造了宿主的代谢和肥胖。
原始出处:
Filipa Cardoso et al. Neuro-mesenchymal units control ILC2 and obesity via a brain–adipose circuit. Nature (2021).

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#Nat#
69
#肥胖症#
82