犬尿喹啉酸在肠易激综合征中的作用机制
2023-09-14 协和医学杂志 协和医学杂志 发表于加利福尼亚
本文就KYN代谢途径及其代谢产物KA在IBS中的作用机制进行综述,以期为IBS的临床治疗提供参考。
综 述
肠易激综合征 (IBS)是常见的肠道功能紊乱性疾病,常导致腹痛、腹泻、焦虑及抑郁等临床症状。我国IBS患病率为1.4%~11.5%[1],其因慢性复发性,严重影响患者的生活质量[2]。
研究显示IBS患者的生活质量与精神症状的严重程度显著相关,且精神症状越严重,其肠道症状的发生频率越高[3]。因此,精神症状成为中重度IBS患者治疗效果差的重要影响因素[4]。
近期研究表明,IBS患者中存在肠道菌群-犬尿氨酸(KYN)代谢紊乱,KYN代谢产物犬尿喹啉酸(KA)与喹啉酸(QA)之间的水平变化对IBS患者的腹痛程度及精神症状均有影响,且KA在其中可能发挥保护性作用[5-6],这可能成为诊断及治疗IBS的新思路。因此本文就KYN代谢途径及其代谢产物KA在IBS中的作用机制进行综述,以期为IBS的临床治疗提供参考。
1 犬尿氨酸代谢途径
KYN代谢途径是色氨酸降解的主要途径[7]。约90%的色氨酸经色氨酸2,3-双加氧酶(TDO)或吲哚胺2,3-双加氧酶(IDO)催化生成KYN, KYN代谢途径包括以下3种[8]:
(1)经犬尿氨酸转氨酶(KAT)催化生成KA;
(2) 经犬尿氨酸-3-单加氧酶(KMO)催化生成3-羟基犬尿氨酸(3-HK),3-HK经犬尿氨酸酶(KYNU)催化生成3-羟基邻氨基苯甲酸(3-HAA),3-HAA进一步转化为2-氨基-3-羧基粘康酸-6-半醛(ACMS),ACMS通过非酶环化生成QA,QA最终转化为烟酰胺腺嘌呤二核苷酸(NAD);
(3)经犬尿氨酸酶催化生成邻氨基苯甲酸(AA),AA也可进一步转化为QA。
除此之外,色氨酸降解途径还包括5-羟色胺(5-HT)途径及吲哚途径[7]:
(1)5-HT途径约占3%,色氨酸经色氨酸羟化酶 (TPH) 催化生成5-HT,影响肠道黏膜分泌、肠道蠕动、内脏感觉及精神心理状态等[7,9],5-HT的水平变化可能与IBS亚型改变相关,目前选择性5-HT4受体激动剂、5-HT3受体拮抗剂和5-HT再摄取抑制剂等可治疗IBS患者的腹痛症状及精神症状[10];
(2)吲哚途径是指色氨酸经肠道菌群直接分解为色胺、吲哚及其衍生物,吲哚作为芳香烃受体(AHR)的配体,有助于维持IBS患者肠道上皮完整性,并参与调节肠道免疫功能,发挥抗炎作用,缓解肠道炎症[11-12]。
2 犬尿喹啉酸与IBS的相关性
目前IBS的临床诊断主要采用罗马标准,最新的罗马Ⅳ标准根据排便习惯及粪便性状不同将IBS分为4种亚型:腹泻型肠易激综合征(IBS-D)、便秘型肠易激综合征(IBS-C)、混合型肠易激综合征(IBS-M)及未定型肠易激综合征(IBS-U)[1]。
目前关于IBS机制的研究主要集中于色氨酸向5-HT转化途径方面,研究表明5-HT具有调节胃肠道功能及情绪的作用[13],而色氨酸代谢的主要途径为KYN途径,越来越多的研究也证实KYN代谢产物KA与IBS亚型的肠道症状和精神心理症状存在显著相关性[5-6,14]。
Clarke等[14] 对罗马Ⅱ标准(在过去12个月中,至少有12周出现腹部不适或腹痛)诊断的IBS患者进行研究,发现男性患者的KYN水平升高,IDO活性明显增加,并与症状的严重程度、焦虑抑郁水平呈正相关,而KYN代谢物KA的浓度及KA/KYN比值降低。
叶华等[5]研究发现,罗马Ⅲ标准(6个月前出现腹部不适,近3个月每月至少有3 d出现反复发作的腹痛或腹部不适)诊断的IBS-D型患者血清KYN、IDO mRNA和蛋白表达水平明显升高而KA浓度明显降低,且该变化与疼痛阈值相关。
根据最新的罗马Ⅳ标准,腹痛是诊断IBS的必要标准之一[10]。在此标准下,Li等[6]发现IBS-D患者结肠黏膜内N-甲基-D-天门冬氨酸受体亚型2B(NMDAR 2B)的表达增加,与血清KA水平呈负相关(r=-0.796,P<0.05),与QA水平(r=0.596,P<0.05)及IBS症状严重程度(r=0.579,P<0.05)、焦虑程度(r=0.651,P<0.05)及抑郁程度(r=0.561,P<0.05)呈正相关。
KYN代谢途径激活,QA增加,KA减少,神经毒性与保护性代谢产物失衡可能与IBS患者的胃肠道及精神心理症状存在相关性[15-16]。由此推断KA或许能够改善IBS患者的腹痛或精神症状。由于各研究的诊断标准不同,研究结果存在一定差异,且研究绝大部分仅限于IBS-D亚型,不完全适用于所有类型的IBS患者,仍需对其他亚型进行深入研究,以明确KA调节IBS的相关机制。
3 犬尿喹啉酸调节IBS的潜在作用机制
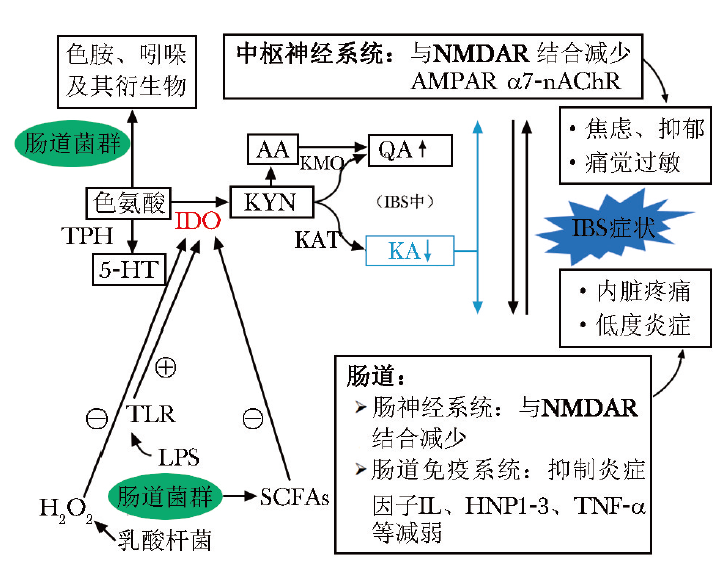
KA调节IBS的潜在作用机制
TPH:色氨酸羟化酶;5-HT:5-羟色胺;IDO:吲哚胺2,3-双加氧酶;TLR:Toll样受体;LPS:脂多糖;SCFAs:短链脂肪酸;H2O2:过氧化氢;AA:邻氨基苯甲酸;QA:喹啉酸;KYN:犬尿氨酸;KMO:犬尿氨酸-3-单加氧酶;KAT:犬尿氨酸转氨酶;KA:犬尿喹啉酸;NMDAR:N-甲基-D-天门冬氨酸受体;IL:白细胞介素;HNP1-3:人中性粒细胞防御素1-3;TNF-α:肿瘤坏死因子-α;AMPAR:α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体;α7-nAChR:α7-烟碱型乙酰胆碱受体;IBS:肠易激综合征
3.1 KA具有一定的抗炎作用
超过10%的感染性肠炎患者可进展为IBS[17],当肠黏膜存在低度炎症反应时,肠道屏障功能受损,介导内脏高敏感性从而导致腹痛等肠道症状发生[18-19]。而KA可抑制脂多糖(LPS)诱导的树突状细胞(DC)中白细胞介素(IL)-23的表达及促炎性Th17细胞亚群的体外分化,因此具有一定的抗炎作用[20]。
KA还可抑制高速泳动族蛋白B1(HMG protein B1)、人中性粒细胞防御素(HNP)及肿瘤坏死因子-α(TNF-α)的表达[21-22]。另有体外实验表明,KA可抑制黄嘌呤氧化酶的表达,降低TNF-α及NO的表达水平,减少LPS诱导的细胞死亡[23-25]。KA通过抑制IL-23、HNP、TNF-α等炎症因子的表达及抗氧化作用可减轻炎症反应,有望成为治疗IBS的新方法。
3.2 KA可改善内脏疼痛反应
IBS患者均会出现不同程度的腹痛症状,临床上也常把腹痛缓解作为治疗的主要目标之一。谷氨酸(Glu)可通过NMDA受体传递盆腔和内脏传入的感觉刺激,中枢神经系统中NMDA受体的激活也参与了内脏运动对伤害性结直肠扩张的反应,这可被NMDA受体甘氨酸位点结合拮抗剂(7-Cl-KA)所阻断[7]。
KA作为离子型谷氨酸能NMDA受体拮抗剂,可能在IBS导致的内脏疼痛反应中发挥重要作用,其与NMDA受体结合可减少由NMDA受体过度激活介导的细胞内钙超载而引发的不良后果(包括蛋白激酶、蛋白酶、磷脂酶、一氧化氮合酶的激活,线粒体形态的改变,活性氧和活性氮的形成,脂质过氧化和细胞骨架失稳,细胞凋亡或坏死)[26-29]。多项研究表明,KA及其合成类似物可能为治疗神经病理性疼痛综合征提供新的治疗选择[30-31]。
3.3 KA可改善精神症状
研究发现NMDA受体位于参与抑郁症状发展的大脑区域,如海马体、杏仁核和扣带回,因此阻断NMDA受体可能具有抗焦虑和抗抑郁作用。研究表明,NMDA受体甘氨酸位点结合拮抗剂(4-Cl-KA)可在小鼠体内发挥抗抑郁作用,显示出比Glu拮抗剂(如氯胺酮)更高的安全性[32-34]。
阿尔茨海默症、精神分裂症等神经系统疾病相关研究发现,KA也是α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(AMPAR)和α7-烟碱型乙酰胆碱受体(α7-nAChR)拮抗剂,其间接影响Glu、多巴胺、乙酰胆碱和γ-氨基丁酸的浓度,上述受体及神经递质均与神经发育、认知、行为和记忆等密切相关[35]。大脑中高水平的KA具有抗惊厥、镇静和脑缺血保护作用[36]。但尚缺乏KA及其合成类似物或NMDA受体拮抗剂在IBS患者中的镇痛、抗焦虑、抗抑郁作用相关研究。
4 肠道菌群-KYN代谢途径与IBS的相关性
近年来,肠道菌群失调与IBS的发病机制相关性从“可能有关”逐渐转变为“发挥重要作用”。动物实验表明,肠道菌群变化可导致IBS患者的肠道运动、内脏疼痛反应、肠道通透性、大脑功能和行为发生改变。肠道菌群失调除诱发肠道功能障碍外,还可能导致大多数IBS患者出现精神症状。
诸多研究表明,IBS患者肠道菌群中的促炎细菌种类相对丰富,乳酸杆菌和双歧杆菌等益生菌数量相对较少[37-38]。此外,空肠弯曲菌、艰难梭菌、幽门螺杆菌、志贺氏菌和沙门氏菌等致病菌在IBS患者肠道中富集[39]。对IBS患者粪便菌群的分析显示,菌群多样性降低,在门水平上厚壁菌增多,拟杆菌减少,厚壁菌/拟杆菌比例增加[1,40]。
研究者尝试绘制出IBS患者的肠道菌群特征图谱,但尚未发现可作为IBS标记物的菌群特征,肠道菌群进一步改变宿主功能的机制尚未完全明确,可能是肠道菌群释放的抗原或代谢产物调节色氨酸代谢途径,尤其是KYN代谢途径,影响IBS的发生发展。
菌群移植研究表明,菌群变化会影响情绪,使KYN代谢产物水平发生变化,这与KYN/色氨酸比值增加有关[41]。Kelly等[42]将抑郁患者的粪菌移植到GF小鼠体内,并进行蔗糖偏好实验,发现小鼠摄入蔗糖量显著减少,且小鼠血清中KYN/色氨酸比值显著升高,这提示KYN代谢途径激活后通过其下游的神经毒性/神经保护性代谢产物在脑功能方面发挥重要作用,但该研究未对菌群成分进行分析,仍具有一定的局限性。
目前菌群特征虽尚未明确,但已有益生菌可减少色氨酸向KYN转化。例如,研究表明,经罗伊氏乳杆菌治疗可减少色氨酸向KYN转化,患者的抑郁行为得到改善[43]。经约翰逊乳杆菌喂养的小鼠肠腔内H2O2浓度升高,而回肠内IDO mRNA及KYN水平显著降低[44]。
Desbonnet等[45]研究发现,将双歧杆菌移植至小鼠体内后,色氨酸及KA水平升高。在服用植物乳杆菌的重度抑郁患者中同样存在KYN浓度降低和认知功能改善[46]。但肠道菌群对KYN下游代谢产物的影响仍缺乏进一步研究,如KYN代谢酶的检测,探讨中间代谢产物及肠道菌群的变化及相关机制研究。
5 肠道菌群调节KYN代谢途径的相关机制
5.1 通过H2O2抑制IDO活性
Valladares等[44]发现约翰逊乳杆菌调节KYN代谢途径可能是产生H2O2 使IDO失活,经约翰逊乳杆菌无细胞悬液培养的HT-29肠上皮细胞中,IDO活性降低,但无细胞悬液经H2O2酶预处理后IDO活性恢复,这或许是肠道菌群影响KYN代谢的一种可能机制[47]。
5.2 通过激活Toll样受体启动KYN代谢
LPS和脂磷壁酸(LTA)等微生物成分激活Toll样受体(TLR)是肠道菌群调节KYN代谢途径的关键影响因素。GF小鼠TLR表达减少,可能与γ干扰素(IFN-γ)介导的IDO活性升高有关[48],目前研究表明刺激TLR-2、TLR-3、TLR-4、TLR-7、TLR-8和TLR-9可诱导KYN产生[49]。
5.3 通过短链脂肪酸调控IDO活性
肠道菌群相关代谢产物短链脂肪酸(SCFAs),尤其是丁酸盐,作为肠细胞的主要能量来源参与KYN代谢过程,也是通过双重机制下调肠道IDO表达的关键因素[50]。
首先,丁酸盐可减少信号转导分子和转录激活子1 (STAT1)的表达,抑制STAT1的IFN-γ依赖性磷酸化,并随后抑制STAT1驱动的IDO转录活性。其次,丁酸盐作为组蛋白脱乙酰酶抑制剂下调IDO的转录,通过抑制IDO活性,丁酸盐抑制色氨酸产生KYN。
6 小结与展望
诸多研究证实IBS患者的症状严重程度与IDO活性及KYN浓度有关[5-6,14]。由于KA对中枢神经系统和肠道具有抗炎、镇痛、改善情绪等保护性作用,KA在KYN代谢途径中的代谢失衡可能是脑-肠轴疾病发展的基础。目前研究表明,KA水平与IBS症状严重程度呈负相关,但在IBS患者中存在较大异质性,KA在IBS患者中发挥的保护性作用仍有待进一步明确。
肠道菌群能够直接或间接影响IDO活性,进而影响色氨酸代谢向KYN途径转化。诸多研究表明,IBS患者与精神疾病患者肠道微生物的变化相似,但具体参与IBS躯体及精神症状发生发展的细菌种类和肠道菌群调节KYN代谢产物的作用机制尚未明确。
未来可通过代谢组学、宏基因组学、宏转录组学和蛋白质组学等不同方法,深入研究与IBS患者的躯体症状以及焦虑、抑郁等精神症状相关的KYN代谢产物变化和菌群构成,明确IBS患者肠道菌群、KYN代谢产物和精神心理症状间的相关性。
同时,进一步探究KYN代谢途径,尤其是KA在脑-肠轴中发挥的作用机制及肠道菌群的介导作用,将为减轻IBS患者临床症状提供重要的参考依据。
参考文献
[1]中华医学会消化病学分会胃肠功能性疾病协作组,中华医学会消化病学分会胃肠动力学组. 2020年中国肠易激综合征专家共识意见[J]. 中华消化杂志, 2020, 40: 803-818.
[2]Yildiz A, Kizil E, Yildiz A. Quality of life and psychometric evaluation of patients diagnosed with irritable bowel syndrome: an observational cohort study[J]. Sao Paulo Med J, 2020, 138: 282-286.
[3]Ford AC, Sperber AD, Corsetti M, et al. Irritable bowel syndrome[J]. Lancet,2020, 396: 1675-1688.
[4]黄丹, 梁列新, 方秀才, 等. 精神心理因素对腹泻型肠易激综合征患者生命质量的影响[J]. 中华消化杂志, 2015, 35: 599-605.
[5]叶华, 于丰彦, 黄绍刚, 等. 腹泻型肠易激综合征患者的内脏敏感性与色氨酸代谢通路的相关性研究[J]. 胃肠病学, 2016, 21: 719-723.
[6]Li P, Zheng J, Bai Y, et al. Characterization of kynurenine pathway in patients with diarrhea-predominant irritable bowel syndrome[J]. Eur J Histochem, 2020, 64: 3132.
[7]Bosi A, Banfi D, Bistoletti M, et al. Tryptophan metabolites along the microbiota-gut-brain axis: an interkingdom communication system influencing the gut in health and disease[J]. Int J Tryptophan Res, 2020, 13: 1178646920928984.
[8]Kennedy PJ, Cryan JF, Dinan TG, et al. Kynurenine pathway metabolism and the microbiota-gut-brain axis[J]. Neuropharmacology, 2017, 112: 399-412.
[9]Mishima Y, Ishihara S. Enteric Microbiota-Mediated Serotonergic Signaling in Pathogenesis of Irritable Bowel Syndrome[J]. Int J Mol Sci, 2021, 22: 10235.
[10]Vasant DH, Paine PA, Black CJ, et al. British Society of Gastroenterology guidelines on the management of irritable bowel syndrome[J].Gut, 2021, 70: 1214-1240.
[11]Ala M. Tryptophan metabolites modulate inflammatory bowel disease and colorectal cancer by affecting immune system[J]. Int Rev Immunol, 2022, 41: 326-345.
[12]Mava M, Elodie B, Nathalie R, et al. AhR/IL-22 pathway as new target for the treatment of post-infectious irritable bowel syndrome symptoms[J].Gut Microbes, 2022, 14: 2022997.
[13]Luo M, Zhuang X, Tian Z, et al. Alterations in short-chain fatty acids and serotonin in irritable bowel syndrome: a systematic review and meta-analysis[J]. BMC Gastroenterol, 2021, 21: 14.
[14]Clarke G, Fitzgerald P, Cryan JF, et al. Tryptophan degradation in irritable bowel syndrome: evidence of indoleamine 2, 3-dioxygenase activation in a male cohort[J]. BMC gastroenterol, 2009, 9: 6.
[15]Hestad K, Alexander J, Rootwelt H, et al. The Role of Tryptophan Dysmetabolism and Quinolinic Acid in Depres-sive and Neurodegenerative Diseases[J]. Biomolecules, 2022, 12: 998.
[16]Chen LM, Bao CH, Wu Y, et al. Tryptophan-kynurenine metabolism: a link between the gut and brain for depression in inflammatory bowel disease[J].J Neuroinflammation, 2021, 18: 135.
[17]Klem F, Wadhwa A, Prokop LJ, et al. Prevalence, risk factors, and outcomes of irritable bowel syndrome after infectious enteritis: a systematic review and meta-analysis[J]. Gastroenterology, 2017, 152: 1042-1054.
[18]Barbara G, Barbaro MR, Fuschi D, et al. Inflammatory and microbiota-related regulation of the intestinal epithelial barrier[J]. Front Nutr, 2021, 8: 718356.
[19]González-Castro AM, Martínez C, Salvo-Romero E, et al. Mucosal pathobiology and molecular signature of epithelial barrier dysfunction in the small intestine in irritable bowel syndrome[J]. J Gastroenterol Hepatol, 2017, 32: 53-63.
[20]Gaffen SL, Jain R, Garg AV, et al. The IL-23-IL-17 immune axis: from mechanisms to therapeutic testing[J].Nat Rev Immunol, 2014, 14: 585-600.
[21]Tiszlavicz Z, Németh B, Fülp F, et al. Different inhibitory effects of kynurenic acid and a novel kynurenic acid analogue on tumour necrosis factor-α (TNF-α) production by mononuclear cells, HMGB1 production by monocytes and HNP1-3 secretion by neutrophils[J]. Naunyn Schmiedebergs Arch Pharmacol, 2011, 383: 447-455.
[22]Mándi Y, Endrész V, Mosolygó T, et al. The opposite effects of kynurenic acid and different kynurenic acid analogs on tumor necrosis factor-α (TNF-α) production and tumor necrosis factor-stimulated gene-6 (TSG-6) expression[J]. Front Immunol, 2019, 10: 1406.
[23]Kaszaki J, Palásthy Z, Erczes D, et al. Kynurenic acid inhibits intestinal hypermotility and xanthine oxidase activity during experimental colon obstruction in dogs[J]. Neurogastroenterol Motil, 2008, 20: 53-62.
[24]Moroni F, Fossati S, Chiarugi A, et al. Kynurenic acid actions in brain and periphery[J]. Int congr ser, 2007, 1304: 305-313.
[25]Kiank C, Zeden JP, Drude S, et al. Psychological stress-induced, IDO1-dependent tryptophan catabolism: implications on immunosuppression in mice and humans[J]. PLoS One, 2010, 5: e11825.
[26]Ferreira FS, Schmitz F, Marques EP, et al. Intrastriatal quinolinic acid administration impairs redox homeostasis and induces inflammatory changes: prevention by kynurenic acid[J]. Neurotox Res, 2020, 38: 50-58.
[27]Guillemin GJ. Quinolinic acid, the inescapable neurotoxin[J]. FEBS J, 2012, 279: 1356-1365.
[28]Filpa V, Moro E, Protasoni M, et al. Role of glutamatergic neurotransmission in the enteric nervous system and brain-gut axis in health and disease[J]. Neuropharmacology, 2016, 111: 14-33.
[29]McRoberts JA, Coutinho SV, Marvizón JC, et al. Role of peripheral N-methyl- D-aspartate (NMDA) receptors in visceral nociception in rats[J]. Gastroenterology, 2001, 120: 1737-1748.
[30]Majláth Z, Trk N, Toldi J, et al. Memantine and kynurenic acid: current neuropharmacological aspects[J]. Curr Neuropharmacol, 2016, 14: 200-209.
[31]Ciapaa K, Mika J, Rojewska E. The kynurenine pathway as a potential target for neuropathic pain therapy design: from basic research to clinical perspectives[J]. Int J Mol Sci, 2021, 22: 11055.
[32]Ghasemi M, Phillips C, Trillo L, et al. The role of NMDA receptors in the pathophysiology and treatment of mood disorders[J]. Neurosci Biobehav Rev, 2014, 47: 336-358.
[33]Cao B, Zhu J, Zuckerman H, et al. Pharmacological interventions targeting anhedonia in patients with major depressive disorder: a systematic review[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2019, 92: 109-117.
[34]Zanos P, Piantadosi SC, Wu HQ, et al. The prodrug 4-chlorokynurenine causes ketamine-like antidepressant effects, but not side effects, by NMDA/glycineB-site inhibition[J]. J Pharmacol Exp Ther, 2015, 355: 76-85.
[35]Tan HL, Chiu SL, Zhu Q, et al. GRIP1 regulates synaptic plasticity and learning and memory[J]. Proc Natl Acad Sci USA, 2020, 117: 25085-25091.
[36]Li Y, Cheng X, Liu X,et al. Treatment of Cerebral Ischemia Through NMDA Receptors: Metabotropic Signaling and Future Directions[J]. Front Pharmacol, 2022, 13: 831181.
[37]Rodio-Janeiro BK, Vicario M, Alonso-Cotoner C, et al. A Review of Microbiota and Irritable Bowel Syndrome: Future in Therapies[J].Adv Ther, 2018, 35: 289-310.
[38]Johnsen PH, Hilpüsch F, Cavanagh JP, et al. Faecal microbiota transplantation versus placebo for moderate-to-severe irritable bowel syndrome: a double-blind, randomised, placebo-controlled, parallel-group, single-centre trial[J].Lancet Gastroenterol Hepatol, 2018, 3: 17-24.
[39]Shariati A, Fallah F, Pormohammad A, et al. The possible role of bacteria, viruses, and parasites in initiation and exacerbation of irritable bowel syndrome[J].J Cell Physiol, 2019, 234: 8550-8569.
[40]Duan R, Zhu S, Wang B, et al. Alterations of Gut Microbiota in Patients With Irritable Bowel Syndrome Based on 16S rRNA-Targeted Sequencing: A Systematic Review[J].Clin Transl Gastroenterol, 2019, 10: e00012.
[41]Carabotti M, Scirocco A, Maselli MA, et al. The gut-brain axis: interactions between enteric microbiota, central and enteric nervous systems[J]. Ann Gastroenterol, 2015, 28: 203-209.
[42]Kelly JR, Borre Y, O'Brien C, et al. Transferring the blues: depression-associated gut microbiota induces neurobehavi-oural changes in the rat[J]. J Psychiatr Res, 2016, 82: 109-118.
[43]Marin IA, Goertz JE, Ren T, et al. Microbiota alteration is associated with the development of stress-induced despair behavior[J]. Sci Rep, 2017, 7: 43859.
[44]Valladares R, Bojilova L, Potts AH, et al. Lactobacillus johnsonii inhibits indoleamine 2, 3-dioxygenase and alters tryptophan metabolite levels in BioBreeding rats[J]. FASEB J, 2013, 27: 1711-1720.
[45]Desbonnet L, Garrett L, Clarke G, et al. The probiotic Bifidobacteria infantis: an assessment of potential antidepressant properties in the rat[J]. J Psychiatr Res, 2008, 43: 164-174.
[46]Rudzki L, Ostrowska L, Pawlak D, et al. Probiotic Lactobacillus Plantarum 299v decreases kynurenine concentration and improves cognitive functions in patients with major depression: A double-blind, randomized, placebo controlled study[J]. Psychoneuroendocrinology, 2019, 100: 213-222.
[47]Tomás MS, Claudia Otero M, Ocaña V, et al. Production of antimicrobial substances by lactic acid bacteria I: determination of hydrogen peroxide[J].Methods Mol Biol, 2004, 268: 337-346.
[48]Wang Y, Devkota S, Musch MW, et al. Regional mucosa-associated microbiota determine physiological expression of TLR2 and TLR4 in murine colon[J]. PLoS One, 2010, 5: e13607.
[49]Orhan F, Bhat M, Sandberg K, et al. Tryptophan Metabolism Along the Kynurenine Pathway Downstream of Toll-like Receptor Stimulation in Peripheral Monocytes[J]. Scand J Immunol, 2016, 84: 262-271.
[50]Martin-Gallausiaux C, Larraufie P, Jarry A, et al. Butyrate produced by commensal bacteria down-regulates indolamine 2, 3-dioxygenase 1 (IDO-1) expression via a dual mechan-ism in human intestinal epithelial cells[J]. Front Immunol, 2018, 9: 2838.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














目前,关于#犬尿喹啉酸#(5-HT4 受体激动剂)在肠易激综合征(IBS)中的作用尚在研究阶段。肠易激综合征是一种慢性的肠道功能紊乱症状,包括腹痛、#腹泻#、#便秘#和腹胀等。#5-HT4 受体激动剂#类药物如犬尿喹啉酸主要通过调节肠道的神经传递和肠蠕动来影响症状。以下是一些关于犬尿喹啉酸在肠易激综合征中的可能作用: 1. 促进胃肠动力: 犬尿喹啉酸作为5-HT4 受体激动剂,主要通过促进胃肠道的蠕动和排空来增强肠道的运动。这有助于改善肠道的排便功能,对于 IBS-C(以便秘为主的肠易激综合征)可能有积极的影响。 2. 调节神经传递: 5-HT4 受体主要分布在胃肠道神经系统中。犬尿喹啉酸的作用可能通过增加肠道内5-HT4 受体的激活,从而增强胃肠道的神经传递。这对于调节疼痛感知、腹痛等症状可能有一定效果。 3. 改善腹痛和不适感: 犬尿喹啉酸的作用可能有助于减轻腹痛和不适感,这是 IBS 患者常见的症状。通过增强肠道的运动和调节神经传递,犬尿喹啉酸可能有助于减轻腹痛症状。 4. 影响粘膜免疫系统: 5-HT4 受体激动剂的作用可能会对肠道粘膜免疫系统产生影响,但具体机制仍需深入研究。这可能与对炎症和免疫反应的一定程度的调节有关。 注意事项: 个体差异: 对于不同患者,对犬尿喹啉酸的反应可能存在个体差异。 适应证: 犬尿喹啉酸通常被用于治疗 IBS-C,对于 IBS-D(以腹泻为主的肠易激综合征)可能不是首选药物。 不良反应: 使用犬尿喹啉酸可能会导致一些不良反应,包括头痛、腹泻等,患者需在医生监督下使用。 总体而言,犬尿喹啉酸作为一种治疗 IBS 的药物,其作用主要通过调节胃肠道的蠕动和神经传递来减轻症状。然而,具体疗效和安全性仍需在更多研究中验证,患者在使用前应咨询医生的建议。
87
#犬尿喹啉酸#在#肠易激综合征#中的作用机制
90