Blood Cancer J:多发性骨髓瘤急性轻链管型肾病的诊断和治疗
2023-04-10 聊聊血液 网络 发表于上海
应尽快开始使用 PLEX 体外去除轻链,以帮助更快地降低血清 FLC 浓度。
轻链管型肾病 (LCCN) 引起的急性肾损伤 (AKI) 是多发性骨髓瘤 (MM) 的主要并发症之一,最常见于MM 初始诊断时,但也可在疾病晚期复发期间发生。如果以血清肌酐 (Scr) 浓度 > 1.4 mg/dL衡量,诊断时 AKI 的发生率为16-31%,而如果以Scr > 2 mg/dL定义,AKI的发生率为16-22%;如果基于估计的肾小球滤过率 (eGFR),36-45%的患者eGFR<60 mL/min/1.73 m2,而12-17%的eGFR<30 mL/min/1.73 m2。一项包含1038例 MM 患者的大型法国研究发现,约25%的患者符合2014年国际骨髓瘤工作组 (IMWG) 肾损害标准(Scr> 2 mg/dL或eGFR<40 mL/min/1.73 m2),12.9%需要透析。其他研究报告发现在 MM 临床病程中6-8%的患者存在透析依赖。
在4种骨髓瘤定义事件 (MDE)(高钙血症、肾损害、贫血和溶骨性病变)中,即使在调整其他辅因子和合并症后,肾损害对总生存期 (OS) 的影响也最大,在烷化剂时代尤其明显。尽管在临床试验环境中新药(尤其是硼替佐米)可减弱该效应,但真实世界数据仍反映出骨髓瘤诊断时的 AKI 对死亡率可产生负面影响,尤其是在治疗的前6个月。肾功能恢复可逆转对 OS 的负面影响,但即使长期生存率有所改善,肾脏未恢复的患者的短期死亡率仍较高(无论采用何种治疗方案)。
诊断
MM肾损害目前定义为eGFR<40 mL/min/1.73 m2或Scr>2 mg/dL。出于诊断和管理目的,必须确定 MM 中 AKI 的病因,只有 LCCN 才可能成为MDE,其管理与其他原因所致 AKI 的管理需求不同。因此在出现 AKI 的 MM 患者中,必须排除肾衰竭的其他原因,如脱水、高钙血症、药物诱导的肾炎、不相关的糖尿病或高血压和其他单克隆丙种球蛋白病相关肾脏病理。除 LCCN 外,单克隆蛋白还可引起许多其他肾脏疾病,统称为诊断伞(diagnostic umbrella),现称为具有肾脏意义的单克隆丙种球蛋白病 (MGRS)。
肾活检是区分LCCN、MGRS病变和其他不相关 AKI 病因的金标准,但由于各种原因,肾脏活检并不总是可行的,尤其是在急性情况下。如果根据临床表现排除了脱水、高钙血症和其他原因引起的AKI,那么应主要鉴别LCCN 和 MGRS 肾脏病变。由于大多数 MGRS 肾脏病变累及肾小球,因此引起高度白蛋白尿;而LCCN主要与本周蛋白尿相关,蛋白尿通常 < 10%。因此对于蛋白尿>1 g/日且白蛋白尿<10%、血清 FLC 浓度>150 mg/dL的患者,LCCN的概率足够高,可以省略肾脏活检;而白蛋白尿程度较高或血清 FLC 较低,或 AKI 病因存在任何不确定性的患者应接受肾活检。
当前的一线治疗选择
蛋白酶体抑制剂(表1)
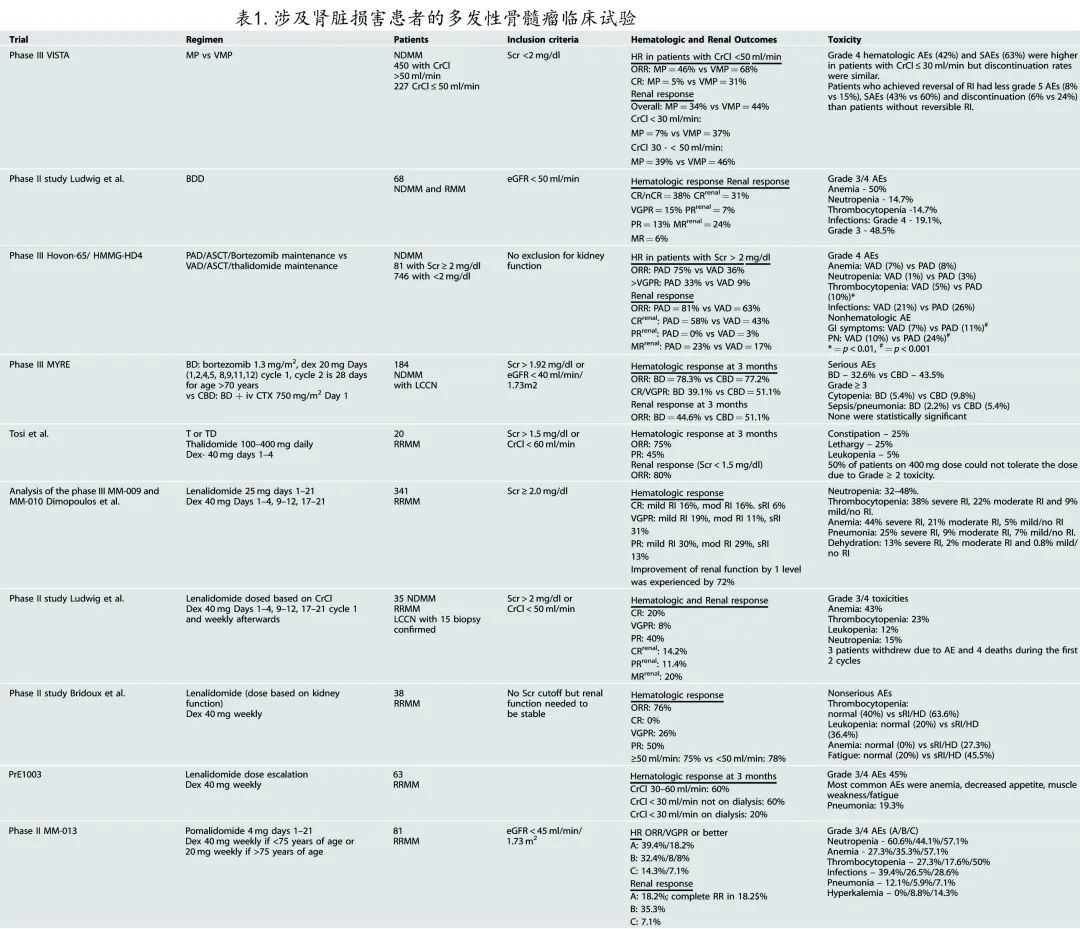
硼替佐米不经肾脏清除,也无肾毒性。在 VISTA研究中,在eGFR < 50 mL/min/1.73 m2的患者中,硼替佐米 (V) 与美法仑和泼尼松 (MP) 联用可显著提高ORR,从46%增至68%, CR率从5%增至31%。VMP 组eGFR < 30 mL/min/1.73 m2患者的肾功能恢复率为37%,MP治疗患者为7%。
在一项 II 期研究中,硼替佐米联合多柔比星和地塞米松 (BDD) 治疗新诊断 (NDMM) 和复发患者,中位 eGFR 为20.5ml/min,结果ORR 为72%,≥VGPR缓解率为52%。eGFR 改善与血液学缓解 (HR) 深度相关,达到 > VGPR、PR或MR、疾病稳定或更低的患者的中位治疗后 eGFR 分别为59.6 mL/min、38.9 mL/min、16.8 mL/min;中位PFS 为12.1个月,中位随访22.4个月后尚未达到OS。
在 III 期 Hovon-65/HMMG-HD4 研究中,将 BDD 对比长春新碱阿霉素和地塞米松 (VAD) 诱导,随后进行自体干细胞移植 (ASCT),随后在 VAD 组中进行沙利度胺维持治疗,在 BDD 组中进行硼替佐米维持治疗。尽管Scr> 2mg/dL的患者中高危细胞遗传学 [del17p 和t(4;14)] 比例显著较高,但 BDD 治疗的 OS 与基线肌酐≤2 mg/dL的患者相似。与VAD(分别为36%和9%)相比,BDD在基线肌酐 > 2 mg/dL的患者中达到了显著更高的 ORR 和 > VGPR率(分别为75%和33%)。总的来说,无论接受何种治疗,基线肌酐≤2 mg/dL的患者的OS相似,但Scr> 2mg/dL的患者接受 VAD 治疗后OS较差。BDD 治疗患者的总体肾脏缓解率为81%(58%肾脏CR),而VAD为63%(43%肾脏CR)。
一项比较硼替佐米+地塞米松 (BD) 与硼替佐米+环磷酰胺+地塞米松 (CBD) 的随机研究发现,对于不需要透析的肾损害 NDMM 患者,两方案的3个月HR率(BD 78.3% vs CBD 77.2%,p=1.00) 和 > VGPR率 (BD 39.1%,CBD 51.1%,p=0.14) 相似。总体肾脏反应也无差异(BD组44.6% vs CBD组51.1%,p=0.46),但 AKI 3 期患者(肌酐增加>基线的3倍)的恢复存在有利于CBD的趋势(BD组23.2% vs CBD组46.7%,p=0.07)。
其他蛋白酶体抑制剂一线治疗重度肾损害 MM 患者的数据有限。在重度肾损害患者中进行了一项伊沙佐米的 I/Ib 期研究中有7例透析患者,从安全性和药代动力学角度确定28天/周期的第1、8、15天的剂量为3 mg,但未提供疗效数据。一项在重度肾损害患者(包括10例透析患者)中开展的卡非佐米研究推荐使用的剂量为27和56 mg/m2。在一项使用15和 27 mg/m2 剂量的卡非佐米-地塞米松治疗肾损害复发性难治性 (RRMM) 患者的 II 期研究中,不同程度肾损害患者(包括接受透析的患者)的 HR 相似;ORR 为25.5%,均为≤ PR,10例中度肾损害(肌酐清除率为30-49 mL/min)患者中有3例发生AKI,除此之外不良反应也相似。然而肾毒性(包括血栓性微血管病)风险阻碍了卡非佐米成为伴 AKI 的 MM 患者的有力选择。
免疫调节剂(表1)
免疫调节剂已用于伴肾损害 MM 患者,它们作用机制相似但药理学特性不同,使每种药物具有独特的药代动力学和不同的副作用。沙利度胺可被所有体液水解,肾脏清除率可能有限,但药代动力学研究显示透析可清除药物,因此应在透析后给药。来那度胺可经肾脏清除和透析,需要根据 GFR 和透析状态调整剂量。泊马度胺经肾脏分泌,但经肝脏代谢,即使在重度肾损害患者中也仅导致半衰期轻度延长,因此无需根据肾功能调整剂量,但应在透析后给药。
沙利度胺在 MM 肾衰竭患者中仅有2项小型研究。第一项研究仅7例患者,肌酐清除率 (CrCl) 为 47 mL/min且依赖透析,接受沙利度胺 100-400 mg 每日给药;3例患者达到CR且持续5-8个月,1例患者达到PR且持续1年。在透析依赖患者中观察到的不良反应包括便秘、周围神经病变和高钾血症。另一项研究中20例肾损害 RRMM 患者接受沙利度胺或沙利度胺地塞米松治疗,干细胞移植后75%的患者达到HR,45%达到≥PR;由于不良反应,接受 400 mg 每日剂量治疗的患者中50%需要将剂量降低至每日200 mg。
肾损害 MM 患者中有多项来那度胺-地塞米松 (Rd)II 期研究。使用的给药方案为:其中1项研究中,对于CrCl > 30但≤50 mL/min,每日10 mg;对于CrCl < 30 mL/min但未接受透析,15mg q48h;对于28天/周期接受透析21天的患者,透析后每日5mg。一项小型研究中,35例 NDMM 和复发患者接受来那度胺-大剂量地塞米松治疗,4例在前2个周期内死亡,5例退出研究(3例因不良事件)。在意向治疗分析中,20%达到CR,8%达到VGPR。16/35例 (45.7%) 患者达到肾脏缓解,14.2%达到肾脏CR,11.4%达到肾脏PR,20%达到肾脏MR。另一项使用相同来那度胺剂量但每周给予地塞米松的 Rd II 期研究达到的 ORR 为76%,PR为50%,VGPR为26%;肾功能正常和轻度肾损害患者与中度肾损害至 ESRD 患者之间的 ORR 相似,但重度肾损害患者(eGFR < 30 mL/min/1.73 m2或ESRD)中仅1例达到VGPR。一项在肾损害 RRMM 患者中进行的剂量递增研究中,透析依赖患者在透析后接受来那度胺相似的给药方案(15 mg 每周3次给药);无论透析状态如何, CrCl 30-59 mL/min 患者达到的最高剂量为每日25 mg,CrCl < 30 mL/min患者为每日15 mg;ORR 为54.3%,透析组的反应最差 (20%);28例患者发生3/4级不良事件,1例透析依赖患者死于治疗引起的肺部感染、败血症和多器官衰竭,另外5例患者死于治疗引起的无关死亡,死因包括肝硬化、腹腔内出血、猝死和2例ESRD;中位 PFS 为12.6个月,OS为20.0个月。
RRMM 患者中有一项泊马度胺和低剂量地塞米松的 II 期研究。所有81例患者的 eGFR 均 < 45 mL/min/1.73 m2,有14例透析依赖患者。泊马度胺在28天周期的第1-21天以 4 mg 给药,结果A 组(eGFR介于30-45 mL/min/1.73 m2之间)的 ORR 为39.4%,B组(< 30 mL/min/1.73 m2但未接受透析)为32.4%,C组(接受透析的患者)为14.3%。无患者CR,但在 A 组18.2%、B组8.8%和 C 组7.1%的患者中达到VGPR。中位 PFS [6.5 m (A) vs 4.2 m (B) vs 2.4 m (C)]和OS[16.4 m(A)vs 11.8 m(B)vs 5.2 m(C)]与基线肾功能相关,且透析依赖患者最短。白细胞减少在透析依赖患者中的发生率是非透析依赖患者的2倍以上,但感染率相似;在透析依赖患者中血小板减少也是最严重的。3组之间剂量减少和停药率相似。
CD38单抗
达雷妥尤单抗的3项研究均排除了eGFR < 30 mL/min/1.73 m2的患者,因此关于重度肾损害或透析的数据仅限于达雷妥尤单抗的病例报告。在伴肾损害的 RRMM 患者中开展的比较isatuximab、卡非佐米、地塞米松与卡非佐米+地塞米松的IKEMA研究中也仅2.7%和2.4%的患者伴重度肾损害。
体外治疗
血浆置换 (PLEX) 治疗 MM AKI有3项随机研究但结局不同。Zucchelli 等人将15例患者随机分配至每日 PLEX 血液透析组,14例患者随机分配至腹膜透析 (PD) 组。结果PLEX组本周蛋白尿减少大于PD组(p<0.001);PLEX组13例透析依赖患者中11例变得不依赖透析,但PD组11例中仅2例恢复了肾功能。尽管结果积极,但本研究因为 PD 组中的高早期死亡率 (35.7%,PLEX组6.7%)而受到批评。
Johnson 等将21例患者随机分配至血液透析组与血液透析+每周3次 PLEX 组,PLEX 组7/11例和血液透析组5/10例需要透析;结果PLEX 组63.6%与血液透析组50%肾功能改善 (p=NS),但在透析依赖患者中所有3例痊愈患者均接受了PLEX。
Clark 等将58例患者随机分配至5-7个 PLEX (前10天)组,39例患者随机分配至对照组,两组分别有25.9%和36%的患者需要血液透析。研究结束时,对照组分别有17.9%和33.3%的患者需要透析和发生死亡,而PLEX 组为8.6%和32.8% (P=NS)。57.9%的 PLEX 患者达到主要终点(死亡、透析依赖和eGFR < 29 mL/min/1.73 m2的复合终点),而对照组为69.2%,p=0.36。
尽管部分人根据 Clark 研究认为 PLEX 无效,但这些研究之间的显著差异也非常重要。在 Zucchelli 和 Johnson 研究中,大多数患者通过肾活检证实了LCCN,但在 Clark 研究中很少进行活检。Zucchelli 研究(阳性结果)的透析需求是 Clark 研究(阴性结果)的3倍。Johnson 研究的研究者还认为 PLEX 对 AKI 更严重的患者更有益。最后,Zucchelli研究中的患者接受每日PLEX,而 Johnson 和 Clark 研究仅限于隔日一次。
用于治疗 LCCN 的其他体外器械包括高截留量 (HCO) 透析器。HCO 透析器是孔径高达50 kd(正常透析器为5 kd)的透析器,可使血清 FLC 水平降低>70%,目前已有两项随机试验。
MYRE在法国入组98例透析依赖患者。患者接受 BD 治疗,21天/周期,如果疗效不佳,可在周期3后加用环磷酰胺;在前10天内进行了8次 5 h HCO 透析,而对照组使用常规透析器进行相同的透析。与对照组相比,HCO透析器的ORR更高(78.3%与60.4%,p=0.06),> VGPR率也更高(分别为69.6%与47.9%,OR-2.37,p=0.03)。HCO 血液透析在6个月(次要终点,分别为56.4%和35.4%,OR–2.37,p=0.04)和12个月(分别为60.9%和37.5%,OR 2.59,p=0.02)时的肾功能恢复显著较高,但在3个月时未达到显著性(主要终点,分别为41.3%和33.3%,p=0.42),此外OS 无差异。
EuLITE 研究纳入90例透析依赖患者,以BDD 作为化疗药物。HCO 透析计划在第一天进行6 h,然后在10天内进行另外7次 8 h 透析。对照组患者接受 4 h 透析,每周3次。尽管单次治疗 FLC 降低(κ为-77%,λ为-72%)与 MYRE 研究相似,但与对照患者相比,使用 HCO 透析器治疗的 EuLITE 患者在6个月时的 CR (14% vs 30%) 和 VGPR (23% vs 32%) 较低。此外,尽管90天时的肾脏恢复率相似(HCO组56%与对照组51%,p=0.81),但是与对照组相比HCO组年龄调整后的总生存期较差(HR–2.63,p=0.03); HCO组感染并发症较高(尤其是肺部感染,分别为31%与9%),可能起到了一定的作用。
建议
考虑到肾脏恢复的重要性和快速降低血清 FLC 的需求,伴 AKI 的 MM 患者中采用积极的治疗方法是合理的。使用的方案应具有较高且快速的缓解率,使用的药物不应需要根据肾功能调整,并应易于获得,以便立即给药。目标应该是尽快减少循环血清FLC,包括使用PLEX(图1)。
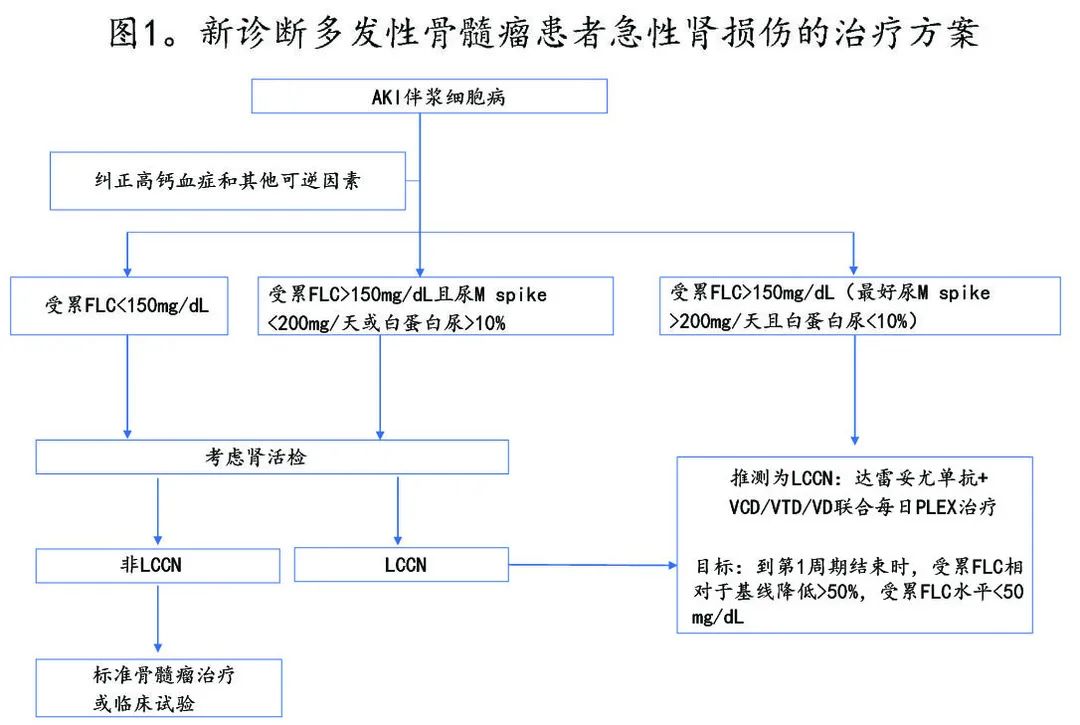
在 NDMM 中,基于初始治疗各种药物和治疗方案的疗效,作者首选达雷妥尤单抗联合VCD或 VD 作为初始治疗。VCD/VD 具有疗效,但根据临床经验和 Andromeda 研究数据,加入达雷妥尤单抗可加速缓解并限制体外去除轻链所需的天数。如果住院患者易于获得 IMiD,可选择达雷妥尤单抗+VTD代替达雷妥尤单抗+VCD。由于来那度胺需要调整剂量,在一线中很可能应避免使用来那度胺。
应尽快开始使用 PLEX 体外去除轻链,以帮助更快地降低血清 FLC 浓度。尽管关于 PLEX 的数据存在争议,但该操作的风险较低,作者认为可为患者提供最佳的肾脏恢复机会。应每日进行PLEX,直至受累 FLC 低于 150 mg/dL 或较基线降低 > 60%(如可能)。由于 PLEX 可清除达雷妥尤单抗,因此应在 PLEX 后给予达雷妥尤单抗。若HCO 透析器可用,可以选择代替PLEX,但应执行 MYRE 研究中使用的 5 h 疗程。
RRMM 患者的情况更为复杂,因许多复发药物尚未在重度肾损害患者中进行研究。但对于这些患者来说肾脏恢复同样重要,因为 CAR-T 细胞治疗和临床试验需要eGFR> 40-50 mL/min/1.73 m2。如果患者在接受抗 CD38 单抗治疗后未复发,可使用达雷妥尤单抗或isatuximab。硼替佐米、地塞米松、沙利度胺联合4天连续输注顺铂、多柔比星、环磷酰胺和依托泊苷 (VDT-PACE)可用于肾损害患者。对于这些患者,顺铂通常省略,环磷酰胺应根据肾功能调整剂量。对于未来有潜在治疗选择的患者应给予PLEX。
参考文献
Nelson Leung, S Vincent Rajkumar.Multiple myeloma with acute light chain cast nephropathy.Blood Cancer J . 2023 Mar 29;13(1):46. doi: 10.1038/s41408-023-00806-w.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言