用羊水培养类器官,登上Nature Medicine!
2024-03-06 BioMed科技 BioMed科技 发表于上海
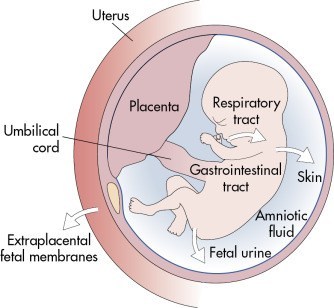
研究表明羊水中存在着来自不同发育器官的组织特异性胎儿上皮祖细胞,并且在定义的培养条件下,这些细胞可以形成类似其来源组织的羊水器官样体。
尽管现代的遗传学和影像分析技术已经相当先进,但对于先天异常的严重程度的准确预测仍然是具有挑战性的。在某些情况下,针对产前治疗的患者分层已经显示出改善先天性膈疝、双胎输血综合征和脊髓裂的临床结果。然而,在其他一些情况下,如下泌尿道梗阻,适当的患者选择仍然是一个障碍。在过去,主要的器官样本是从人类的废弃的产后生物样本中获得的,但这些方法在产前模型、诊断和再生医学方面的应用受到了限制。
2024年3月4日,英国伦敦大学学院的Paolo De Coppi和Mattia Francesco Maria Gerli等人,以羊水作为来源,通过单细胞分析鉴定并分离了胎儿消化道、肾脏和肺部起源的上皮干/祖细胞。这些细胞在培养条件下形成了克隆性上皮器官样本,表现出小肠、肾小管和肺部的特征。羊水器官样体(AFO)具有与其来源组织相符的转录组、蛋白质表达和功能特征。研究人员还从羊水中衍生出肺部器官样本,并从先天性膈疝胎儿的气管液细胞中获得,重现了该疾病的一些特征。AFO的获取时间表与产前干预相符,有望允许在临床相关的发育阶段进行针对胎儿的个性化治疗工具和再生医学策略的调查。该研究成果以“Single-cell guided prenatal derivation of primary fetal epithelial organoids from human amniotic and tracheal fluids”为题发表在Nature Medicine上。共同第一作者是,英国伦敦大学学院的Mattia Francesco Maria Gerli和Giuseppe Calà。

同期,Lilly Tozer在Nature发表了题为“Organoids grown from amniotic fluid could shed light on rare diseases”的新闻报道:相比使用多能干细胞制作的器官样本,羊水细胞已经具有器官身份,这使得未来将这些器官样本应用于临床更为可行。尽管这项研究还没有准备好转移到临床阶段,但这一发现有望为罕见疾病的研究和个性化治疗提供新的途径,并为未来的研究提供了更多的可能性。

【单细胞分析人类羊水以研究组织特异性胎儿上皮前体细胞的存在】
研究人员收集了来自12个孕妇羊水样本,并使用荧光活化细胞分选(FACS)技术分离出具有完整细胞膜的活性核细胞。然后,他们进行了3'单细胞RNA测序(scRNA-seq),生成了一个无监督的Uniform Manifold Approximation and Projection(UMAP)图,使用Seurat v.4进行了分析。然后,研究人员通过SingleR软件包自动对上皮细胞簇进行注释,确认了这些细胞群表达的泛上皮标记基因。随后,通过流式细胞术进行了蛋白质验证,确认了大多数可活性羊水细胞中上皮细胞黏附分子(EpCAM)和ECAD的广泛存在。接着,研究人员使用单细胞基因集富集分析(scGSEA)探索了羊水上皮细胞簇中特定的消化道、肾脏和肺部特征。最后,他们对这些细胞进行了经典的组织特异性前体标记物评分,指示了羊水中存在消化道、肾脏和肺部上皮前体细胞的存在。
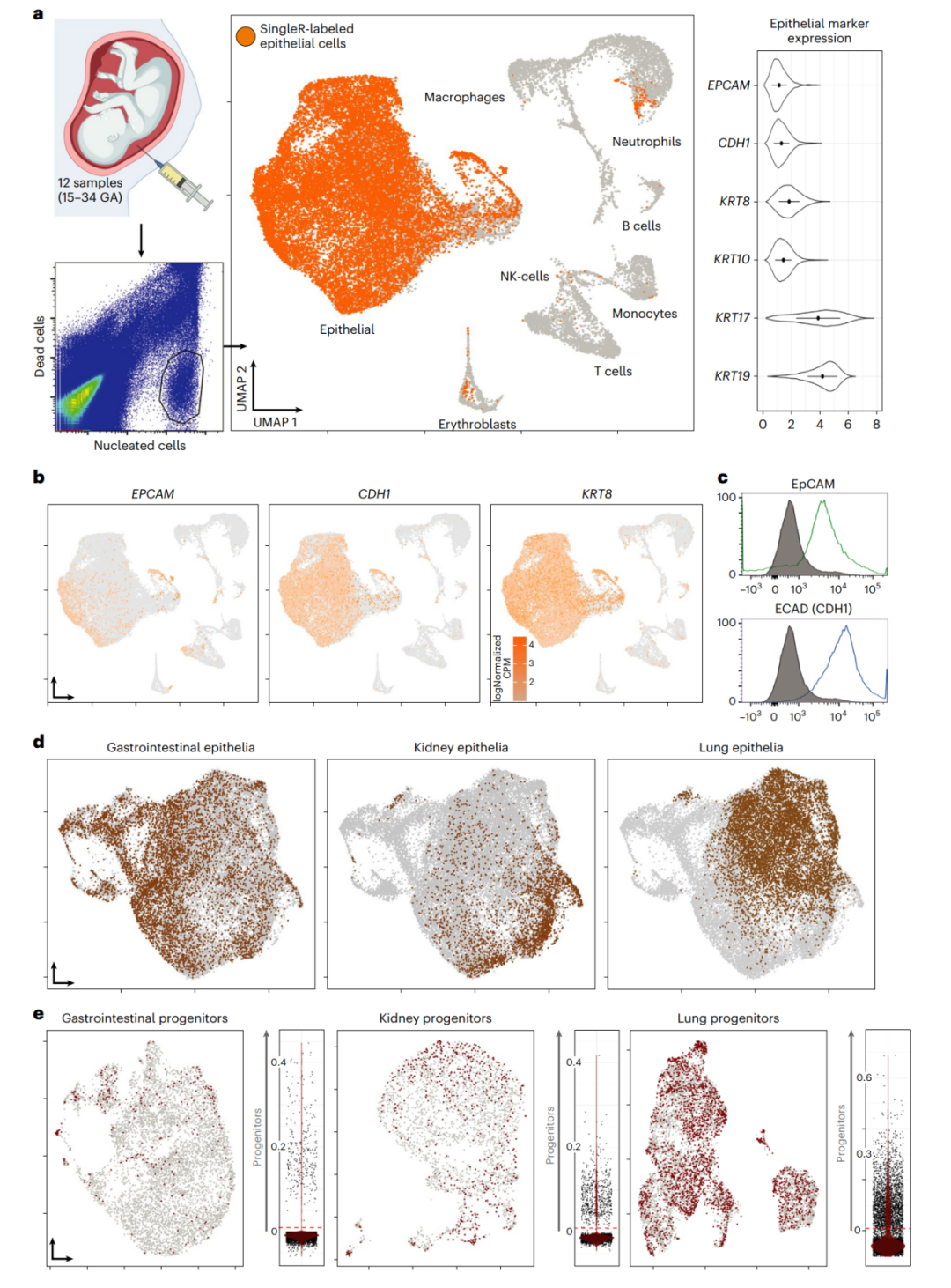
图1 | 羊水内容的单细胞分析。
【原代胎儿上皮人类AFOs的生成】
研究人员将羊水中的活性细胞种植在Matrigel滴中,并在一个通用的上皮细胞培养基中培养它们,没有特定于组织的信号。随着时间的推移,个体羊水细胞开始增殖和自组织形成3D器官样本,可在2周内观察到。为了建立克隆系,研究人员从形成的AFO中挑选单个样本,将其解离成单个细胞并重新培养。通过这种方法,他们从42个羊水样本(孕龄16-34周)中获得了423个AFO系。AFO表现出多种形态,可以扩展至第20代,并成功进行冷冻保存,证明了其自我更新和长期培养的证据。89.7%的羊水样本中观察到了器官样本的形成,中位形成效率为0.011%。研究人员进行了批量RNA测序,以调查每个克隆AFO系列的组织特性,证据表明,肠、肾和肺的AFEpCs可以形成反映其各自原始组织的克隆AFO系列。
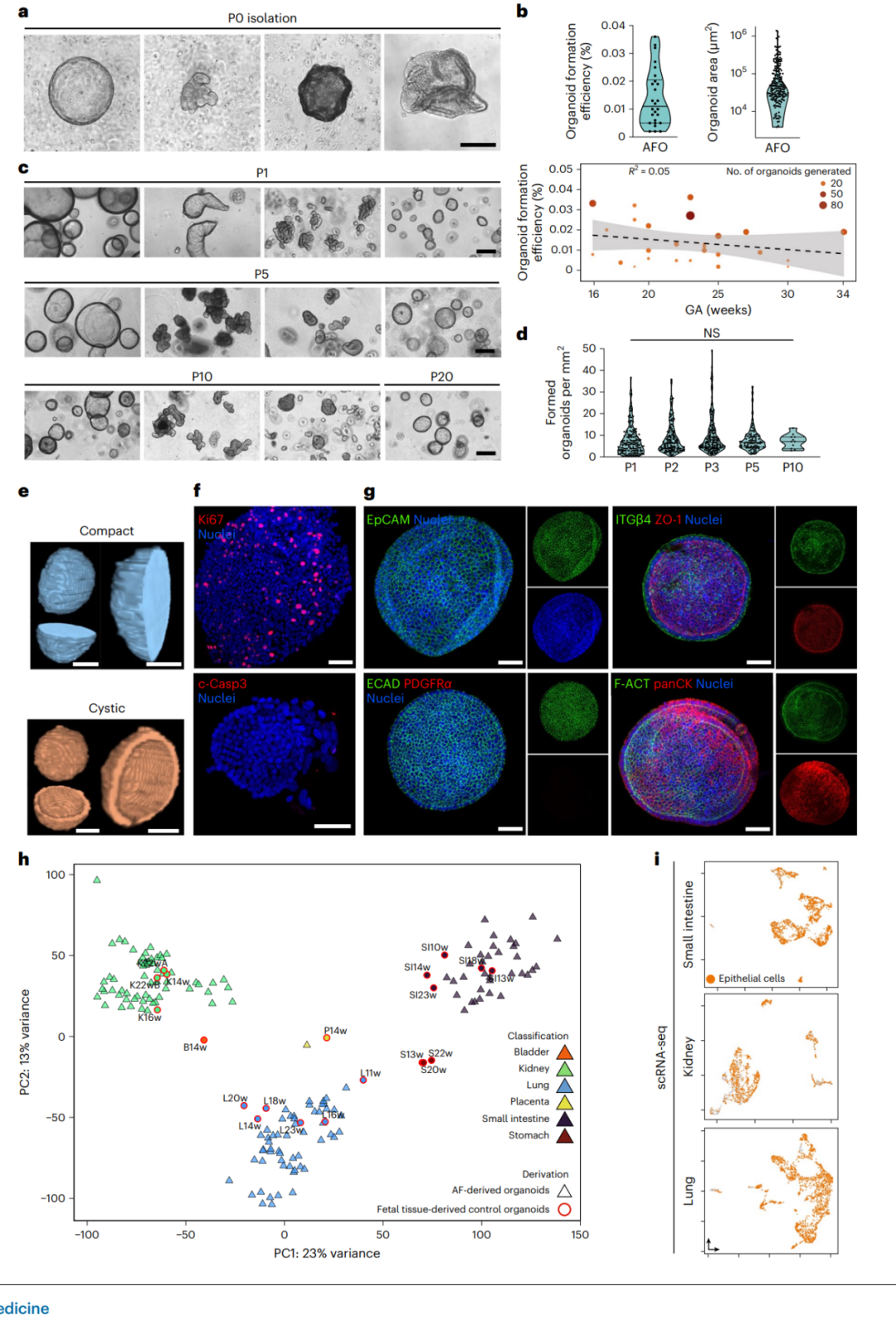
图2 | 原代胎儿上皮AFOs的生成。
【SiAFOs的特征和成熟化】
首先,小肠AFOs(SiAFOs)能够连续扩展超过十代,形成类似隐窝的结构,并且细胞增殖指标EdU的包含表明细胞在SiAFO的隐窝底部进行增殖。通过对23个SiAFOs的批量RNA测序发现,它们表达了典型的肠道干/前体细胞、潘氏细胞、杯状细胞、内分泌细胞和肠细胞标记物。接着,研究人员将SiAFOs培养在肠道特异性培养基中14天。成熟后,SiAFOs展现出更突出的分枝结构,类似于小肠隐窝的组织结构。最后,为了评估SiAFOs的功能能力,研究人员评估了其对两种小肠刷状缘酶的消化活性,并进行了肠环形成实验,结果显示SiAFOs具有良好的消化活性和自我组织形成能力,显示出其在组织工程中的潜力。
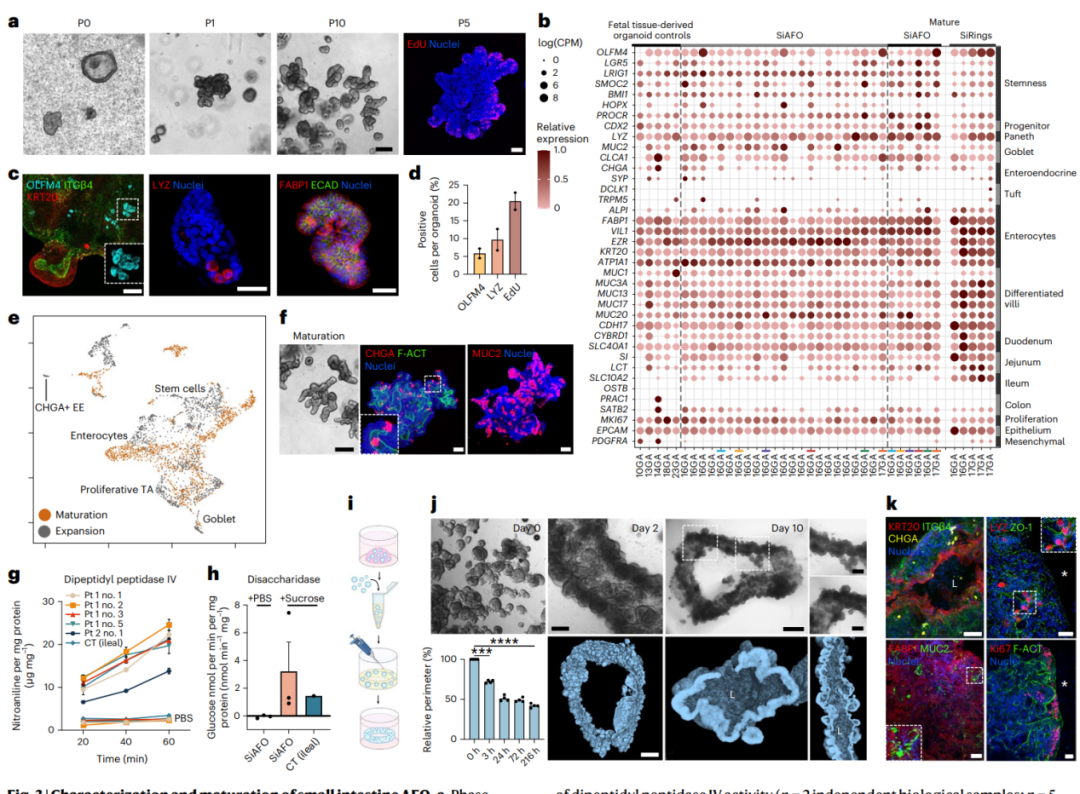
图3 | 小肠AFO的表征和成熟化
【KAFOs的特征和分化】
肾小管AFOs(KAFOs)长期扩展(长达10代),同时保持细胞增殖,并大多表现出囊性结构。通过对54个KAFOs进行批量RNA测序,发现它们表达典型的发育性肾上皮和肾单位前体基因,同时缺乏帽状间质标记物。此外,KAFOs表达了不同肾小管段的标记物,证实了它们具有类似肾小管的表型,并表达了不同肾小管段的标记物。另外,KAFOs表现出功能性上皮紧密连接和完整的屏障完整性。进一步的单细胞RNA测序表征进一步确认了KAFOs中存在多种肾小管细胞。最后,研究人员将KAFOs分化为远曲小管/集合管表型。经过14天的抗利尿激素和精氨酸-醛固酮刺激,KAFOs表现出集合管和远曲小管的标记物,而这些在扩增培养基中较低。
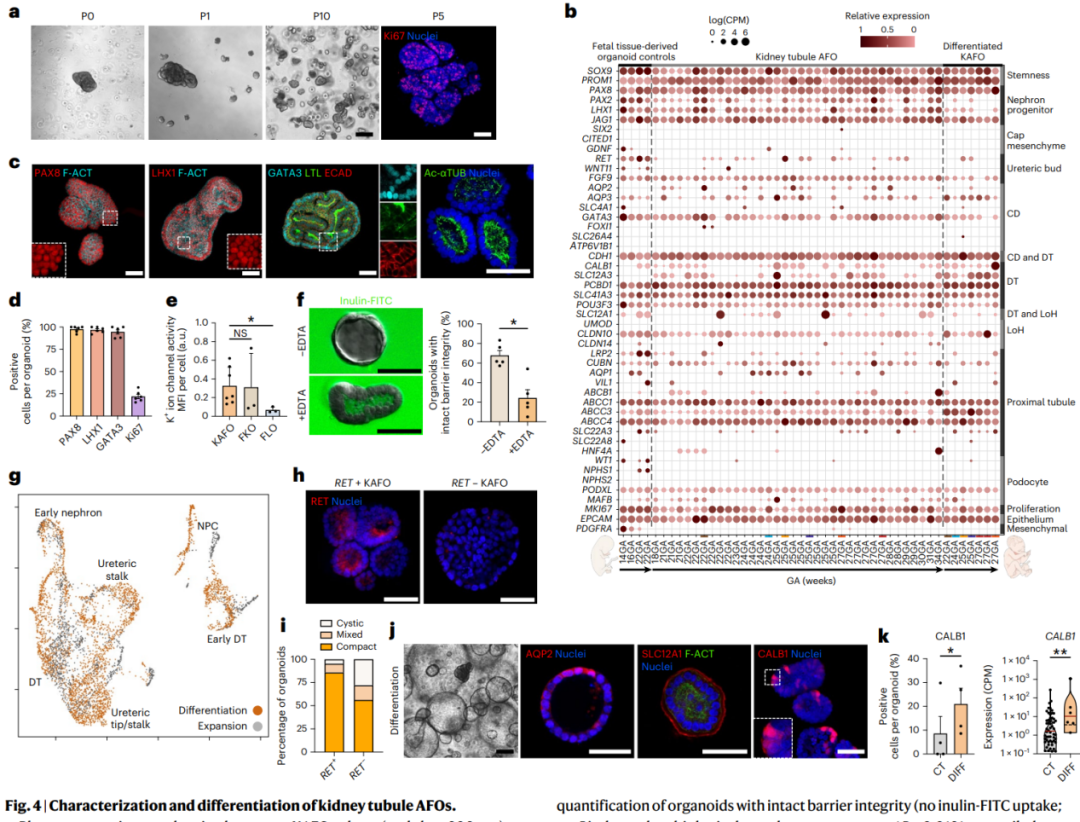
图4 | 肾小管AFOs的表征和分化
【LAFOs的特征和分化】
从胎盘膜的氨基羟丁酸中分离出来的肺AFOs(LAFOs)表现出高度的增殖能力,并且可以长时间进行培养。通过大量RNA测序,确定了LAFOs中表达的多种肺部标记物,并且显示了成功的近端和远端分化。近端分化的LAFOs形成了特化的细胞群集,如纤毛细胞和次生体细胞,与分泌细胞数量的增加相关。进一步的研究确认了在分化的LAFOs上表面存在具有运动纤毛的极性上皮,并且显示了成熟基底细胞标记物和分泌标记物的同时存在,证实了其近端肺分化。而将LAFOs定向向远端表型时,显示了更多成熟的肺表型特征,如AT2标记物SFTPB的增加表达,显示了不同细胞位置的SFTPB蛋白表达,可能指示了更成熟的状态。通过超微结构分析揭示了远端LAFOs含有正常结构的片层体,这是典型的分泌肺表面活性物质的细胞特征。总体来说,这表明LAFOs朝着更成熟的肺表型的发展。
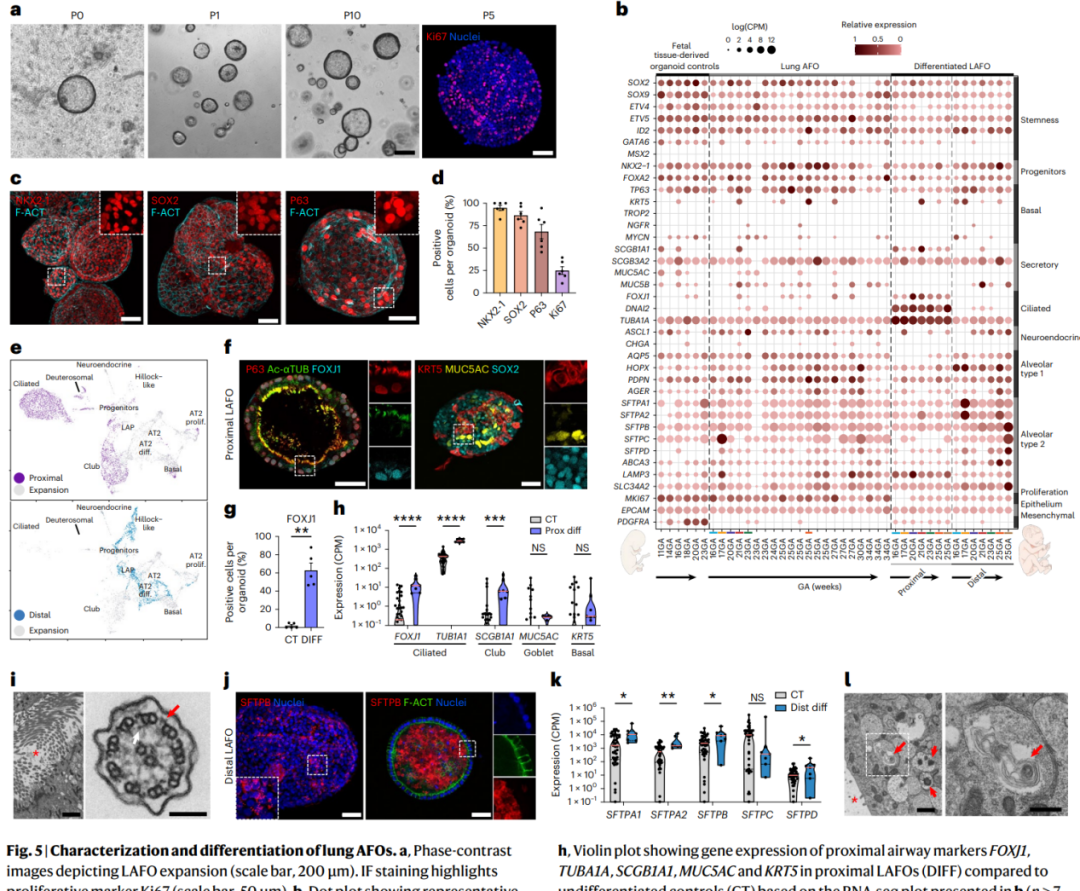
图5 | 肺部AFOs的表征和分化
【CDH胎儿的AF和TF器官样体的表征】
CDH(先天性膈疝)是一种罕见的先天性畸形,表现为膈肌未闭合,导致腹部器官突出至胸腔。因此,胎儿肺部受到机械性压迫,限制了呼吸和血管组织的生长。为了测试这个疾病建模平台,研究人员从严重/中度CDH相关肺发育不全的胎儿的AF和TF中分离、扩增和测序了肺器官样体。他们成功地从多个样本中生成了CDH肺器官样体,这些器官样体在形态学上与对照组肺器官样体一致,并且在细胞学特征和基因表达方面显示出肺特异性。他们进一步对这些器官样体进行了分化实验,发现CDH肺器官样体在细胞成分和功能上显示出明显的差异,表明CDH肺器官样体具有潜在的疾病模型和研究价值。
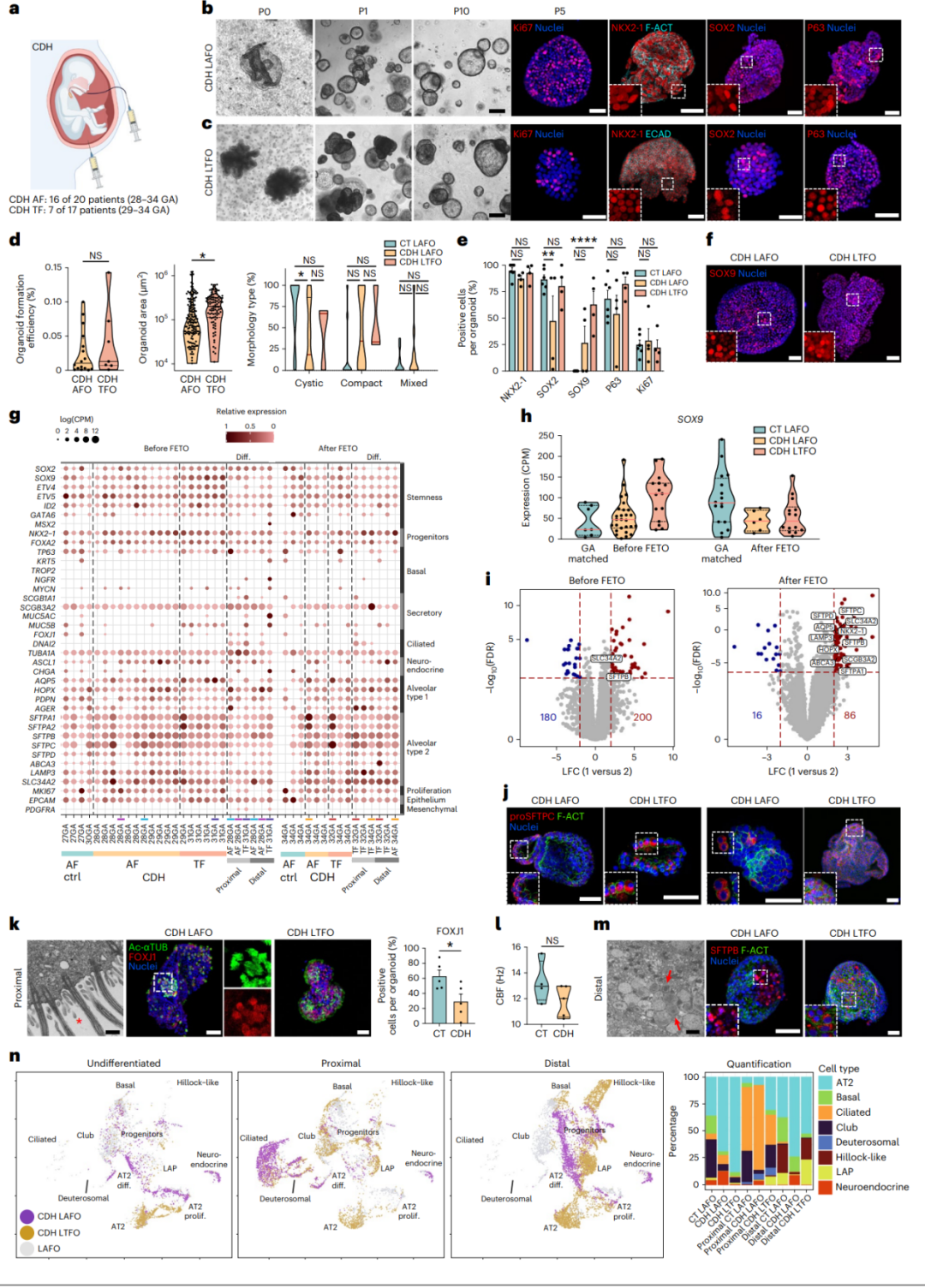
图6 | 从CDH孕妇产生、分化和表征LAFOs和LTFOs
【小结】
首先,研究表明羊水中存在着来自不同发育器官的组织特异性胎儿上皮祖细胞(AFEpCs),并且在定义的培养条件下,这些细胞可以形成类似其来源组织(小肠、肾和肺)的羊水器官样体(AFOs)。其次,研究展示了从患有先天性膈疝(CDH)的胎儿的羊水和胸腔积液中衍生的肺器官样体呈现出疾病的特征。研究还指出,个性化的治疗建模必须在产前进行,而利用胎儿羊水和胸腔积液衍生自体原代胎儿器官样体可以允许继续妊娠,并为临床目的提供样本。AFO技术使用广泛可用的样本,需要最少的操作,并应用已建立的培养技术。与依赖iPS细胞的方法相比,这种流程在4-6周内完成,具有明显的优势。此外,研究还探讨了AF的单细胞图谱,强调了AFEpCs的异质性,并表明它们具有多种组织起源。研究还讨论了不同类型AFO的特性,以及它们在组织工程和疾病建模中的潜在应用。最后,研究提出了未来的研究方向和挑战,包括扩大CDH患者队列以验证平台的有效性,并探索更复杂的预产期模型的建立。
原文链接:
https://doi.org/10.1038/d41586-024-00656-x
https://doi.org/10.1038/s41591-024-02807-z
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#羊水# #组织特异性胎儿上皮祖细胞# #羊水器官样体#
47