ASCO 2020丨晚期尿路上皮癌又有新进展,Avelumab维持治疗联合BSC可使总生存期延长7.1个月!
2020-06-04 陶然 健康界
本摘要报告了晚期尿路上皮癌(UC)患者接受铂类化疗后使用抗PD-L1药物Avelumab(商品名:Bavencio)维持治疗联合最佳支持治疗(BSC),与单纯BSC比较的3期临床试验(JAVELIN
2020年美国临床肿瘤学会(ASCO)年会已经接近尾声,这场学术盛宴可谓精彩纷呈,赢得了全世界肿瘤医生的瞩目。其中最受关注的重磅研究摘要(Late-breaking Abstract,LBA)于美国东部时间5月28日下午5点正式公布,共有2篇入选oral abstract session,5篇LBA入选plenary session。快跟随小编的步伐,开启云年会模式,纵览这些重磅研究吧。
本期和大家分享的是入选plenary session的一篇LBA(摘要号为LBA1),该摘要报告了晚期尿路上皮癌(UC)患者接受铂类化疗后使用抗PD-L1药物Avelumab(商品名:Bavencio)维持治疗联合最佳支持治疗(BSC),与单纯BSC比较的3期临床试验(JAVELIN Bladder 100)的中期分析结果,本试验发现使用Avelumab维持治疗可使晚期UC患者的中位总生存期延长7.1个月。
研究背景
尿路上皮癌(UC)是最常见的膀胱癌类型,现已成为美国第6位常见癌症,2018年全球约有20万死亡病例。尽管多数晚期UC患者通过一线铂类化疗后疾病控制率(DCR)可达大概65%~75%,但由于存在化疗耐药,他们的疾病无进展生存期(PFS)及总生存期(OS)往往较短。经过一线化疗后,只有约25%~55%的患者有机会接受二线治疗,但很多二线治疗结局因疾病进展较快,而未能达到治疗标准。
PD-L1/PD-1抑制剂往往作为疾病进展期患者一线铂类化疗后的二线治疗药物,其中包括PD-L1抑制剂Avelumab。尽管PD-L1/PD-1抑制剂在UC中具有抗肿瘤活性,但只有少量患者能在二线治疗中得到持久的临床获益,Avelumab维持治疗对于那些在1线铂类诱导化疗中没有进展的患者是一种有吸引力的治疗策略。通过化疗实现的疾病控制可能为免疫治疗的抗肿瘤效果延长时间,在疾病进展之前开始免疫治疗会使更多的患者得到延长治疗。
研究方法
纳入700例有不可切除的局部晚期或转移性UC且无疾病进展的合格患者,这些患者已经进行4-6个周期的吉西他滨与顺铂或吉西他滨与卡铂治疗,按1:1比例随机分配接受Avelumab维持治疗(静脉注射10 mg/kg,每2周一次)联合BSC或单用BSC,在开始一线化疗时,根据对一线化疗的最佳反应(完全/部分反应vs.稳定的疾病)和内脏疾病vs.非内脏疾病进行分层。
主要终点是OS,通过2个主要人群的随机化评估:所有随机化患者和PD-L1+肿瘤患者(Ventana SP263分析);次要终点包括PFS、客观反应和安全性。
研究结果
Avelumab维持治疗(静脉注射10 mg/kg,每2周一次)联合BSC(n=350)和单用BSC(n=350)治疗的患者,平均随访时间分别为19.6个月和19.2个月。
 图3 入组患者基线特征
图3 入组患者基线特征
总的来说,358例(51%)患者有PD-L1+肿瘤。与单用BSC治疗相比,Avelumab+BSC联合治疗显著延长了所有随机患者的OS[风险比(HR)0.69;95% CI 0.56,0.86;单侧P=0.0005)];Avelumab+BSC与BSC单独治疗的中位OS分别为21.4个月和14.3个月。Avelumab+BSC也显著延长了PD-L1+肿瘤患者的OS(HR 0.56;95%CI 0.40,0.79;单侧P=0.0003),中位OS分别为未达到和17.1个月。在所有预先指定的亚组中也观察到OS获益。
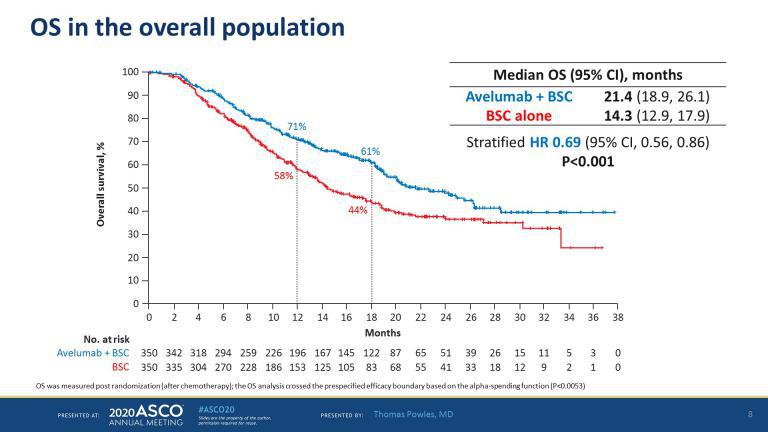
图4 总体人群的总生存期分析
基于Avelumab+BSC与单独使用BSC的盲法独立中心评估得出所有随机患者的PFS HR为0.62(95% CI 0.52,0.75),在PD-L1+肿瘤患者中为0.56(95% CI 0.43,0.73)。
Avelumab+BSC联合治疗组(n=344)与BSC单独治疗组(n=345)的患者中,所有级别的全因不良事件(AEs)分别为98.0% vs. 77.7%以及47.4% vs. 25.2%,且最常见的3级不良事件为尿路感染(4.4% vs. 2.6%)、贫血(3.8% vs. 2.9%)、血尿(1.7% vs. 1.4%),疲劳(1.7% vs. 0.6%)和背痛(1.2% vs. 2.3%)。
拓展思考
通过以上试验可以看出,这项JAVELIN Bladder 100试验达到了其主要研究终点,即在所有随机的和PD-L1阳性的晚期UC患者中,一线化疗后使用Avelumab维持治疗联合BSC与单用BSC相比可以显著延长OS,并且Avelumab的安全性与以前的单药治疗研究一致。
Avelumab于2017年3月23日经FDA批准上市,用于治疗转移性默克尔细胞癌,Avelumab由此成为第4个获批上市的PD-1/PD-L1抗体。Avelumab是唯一一个强ADCC活性的PD-1/PD-L1抗体,因此可以在解除癌细胞免疫逃逸的同时,利用强ADCC活性介导NK细胞杀伤癌细胞。
本试验通过对比分析证实了Avelumab维持治疗的在免疫治疗中的优势,然而在既往癌肿中Avelumab治疗的研究却连连失利。
2017年底,Avelumab的胃癌III期JAVELIN Gastric 300研究失败,研究发现相比医生选择的化疗药物,单独使用Avelumab三线治疗胃癌不能显著改善患者的总生存期。2018年2月,Avelumab治疗肺癌三期的研究JAVELIN Lung 200结果显示,相比多西他赛,Avelumab作为二线疗法未能显著改善PD-L1阳性(PD-L1表达水平≥1%)患者的OS。2018年12月,Avelumab联合/或铂类化疗用于治疗未经治疗的局部进展或转移的III期或IV期上皮性卵巢癌患者的维持治疗试验被终止,因为该研究(JAVELIN Ovarian 100)的中期分析数据发现不支持初始假设。
尽管曾经遭遇滑铁卢,但对Avelumab的探索不止,本次ASCO大会报道的晚期UC中的治疗效果令人鼓舞,相信Avelumab仍是可期待的未来之星。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#ASC#
55
#mAb#
57
#ASCO 2020#
66
#avelumab#
52
#生存期#
47
#晚期尿路上皮癌#
60
#总生存期#
63
#上皮癌#
67