Leukemia:髓外骨髓瘤最全面二代测序,揭示关键分子学特征和肿瘤微环境
2024-03-26 聊聊血液 聊聊血液 发表于威斯康星
捷克学者进行了 EMM细胞最全面的研究,结合14例 EMM 患者FISH、全外显子测序、bulk RNA 测序、单细胞 RNA 测序和流式细胞术的数据。
髓外骨髓瘤的分子学特征
髓外多发性骨髓瘤 (EMM) 是多发性骨髓瘤 (MM) 的一种侵袭性形式,容易发生治疗耐药和生存期较短。据报道,EMM的发生率在诊断时为1.7-4.5%(原发性EMM),复发时则高达43%(继发性EMM),三类暴露MM中的EMM发生率也远高于既往。由于新药以及现代成像技术(如PET/CT)的可用性改善,MM 患者的生存期也得以延长。因此,EMM正在成为临床重要的问题,但介导 EMM 发生的分子机制,以及肿瘤微环境的组成,仍知之甚少,而它们对新型免疫治疗的疗效至关重要。
尚无研究对 EMM 进行详细的基因组或转录组学分析。关注染色体畸变的研究样本有限且存在偏倚,例如使用预选的 FISH 靶标,且小的体细胞突变多使用靶向 panel 进行分析,排除了绝大多数的人类基因。也几乎没有直接从 EMM 肿瘤细胞获得的转录组学数据。
捷克学者进行了 EMM细胞最全面的研究,结合14例 EMM 患者FISH、全外显子测序 (WES)、bulk RNA 测序 (RNA-seq)、单细胞 RNA 测序 (scRNA-seq) 和流式细胞术的数据。重要的是,还获得了8对骨髓异常 PC 样本的基因组和转录组学数据(从诊断到复发),这也是 EMM 的首次纵向研究。研究结果近日发表于《Leukemia》。

研究结果
该研究纳入14例EMM患者并收集样本,包括14份来自软组织肿瘤活检的 EMM 样本和14份来自新诊断MM(NDMM) 的 BM 样本,其中包括8份配对样本和6份未配对,此外14例复发性/难治性MM(RRMM) 患者未配对 BM 样本(无 EMM 证据)。所有样本均用于 RNA 测序 (n=42),EMM和配对的NDMM样本也用于WES(n=22),部分EMM样本处理后进行单细胞测序 (n=5)(图1)。

临床特征和EMM复发
RRMM 患者中共14例(男性10例,女性4例)行软组织肿瘤活检并确诊为EMM(图2)。
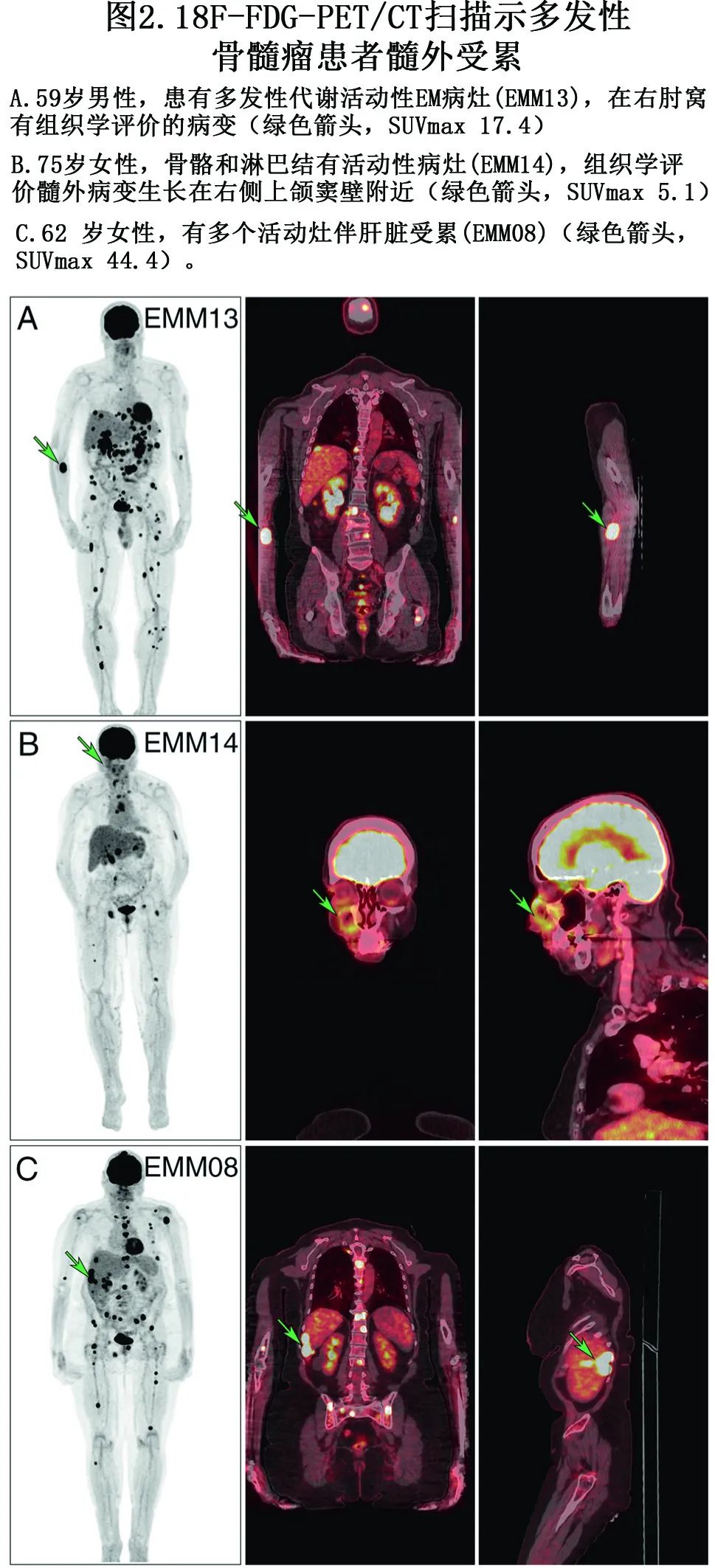
EMM复发时的中位年龄为59岁,距诊断的中位时间为22.2个月,距 EMM 复发时的中位总生存期仅为3.6个月(图1)。既往治疗线的中位数为3,大多数患者接受过PI、IMiD、皮质类固醇和烷化剂联合治疗。14例患者中的6例在 EMM 复发前接受过达雷妥尤单抗治疗。EMM 复发患者在复发时血清电泳定义的 M 蛋白水平与非 EMM 复发患者相比显著下降(中位数5.8 g/L vs. 14.4 g/L;p=0.011),但游离轻链水平无差异。通过细胞学 (2.8% vs. 14.4%;p=0.023) 或流式细胞术 (0.5% vs. 8.3%;p=0.05) 评估,EMM复发患者的 BM PC 浸润显著较低。在几乎所有 EMM 复发患者中,恶性 PC 的轻微 BM 浸润均转化为正常血细胞计数(中位白细胞计数5.1×109/L;中位中性粒细胞绝对计数2.4×109/L;中位血红蛋白水平12.0 g/dL;中位血小板计数168×109/L)。
1q21gain/amp是 EMM中最常见的染色体畸变
14例 EMM 样本中,在12/14例样本(86%;5例gain和7例amplification)中检测到(通过 FISH 和/或WES)跨越 CKS1B 基因的 1q21 gain或amplification(≥4拷贝)(图3A)。包括RB1在内的13q缺失8例(57%),包括TP53在内的17p缺失6例(43%)。令人惊讶的是,高危t(4;14)仅存在于2例患者(14%)。通过RNA-seq数据验证了这一发现,显示FGFR3表达升高和/或FGFR3-IGH融合转录本的存在。利用WES数据进行的详细拷贝数分析进一步发现,在14例EMM样本中,有4例存在癌基因扩增、抑癌基因(tsg)缺失和CD38缺失。

几乎所有EMM样本中MAPK通路成员均发生突变
在几乎所有的 EMM 样本中均鉴定出 MAPK 信号通路中至少有一个突变基因(13/14,93%;3B),其中 KRAS是最常发生突变的基因(10/14,71%;图3B);此外在2例 (14%) 样本中发现 NF1 和 NRAS 突变,在1例 (7%) 样本中发现 BRAF 和 HRAS 突变。MAPK 通路的突变总是克隆性的,癌细胞片段携带比例> 0.8,表明它们在髓外肿瘤形成之前出现。57%的 EMM 样本存在与基因组完整性相关的基因突变,其中 TP53 是最常见的突变TSG(5/14;36%)。EMM 中经常突变的最后一组基因为属于 MAPK 通路上游受体酪氨酸激酶 (RTK) 信号通路的基因。
使用 RNA-seq 数据证明,上述突变中至少80%转录为mRNA,并推测翻译成最终的蛋白产物。值得注意的是,所有 TP53 突变的 EMM 样本均转录突变等位基因,变异等位基因频率 (VAF)≥0.9作为双等位基因失活的标志。在 RNA-seq 数据中,K/N/HRAS的所有突变的 VAF 至少为0.3。值得注意的是,仅在3/9(33%) 接受 ASCT 的患者中检测到美法仑标签(signature)。
NDMM患者中1q21 gain/amp和突变KRAS的组合预示着EMM发生的风险更高
由于 EMM 中 1q21 gain/amp 和 KRAS 突变频率较高,假设携带这两种异常组合的 NDMM 患者发生 EMM 的风险较高。在3/8(38%) 配对 NDMM 样本中,MM 诊断时已经观察到该组合(图3)。因此使用CoMMpass 研究中收集的数据(N=699),以支持该假设,即仅 1q21 gain/amp 与 KRAS 突变联合(7.6%的患者),而非任何一个的单独(仅 1q21 gain/amp 或 KRAS 分别为29.8%和17.7%),结果单因素分析 (HR=2.7;p=0.002) 和多因素 Cox 分析 (HR=2.4;p=0.011) 中软组织浆细胞瘤发生的风险显著较高。此外,使用 FineGray 模型对竞争风险(软组织浆细胞瘤发展与死亡,HR=2.4;p=0.011)进行生存分析,观察到几乎相同的结果。KRAS 突变或 1q21 gain/amp 与 del(13q) 或 del(17p) 之间均无相互作用。
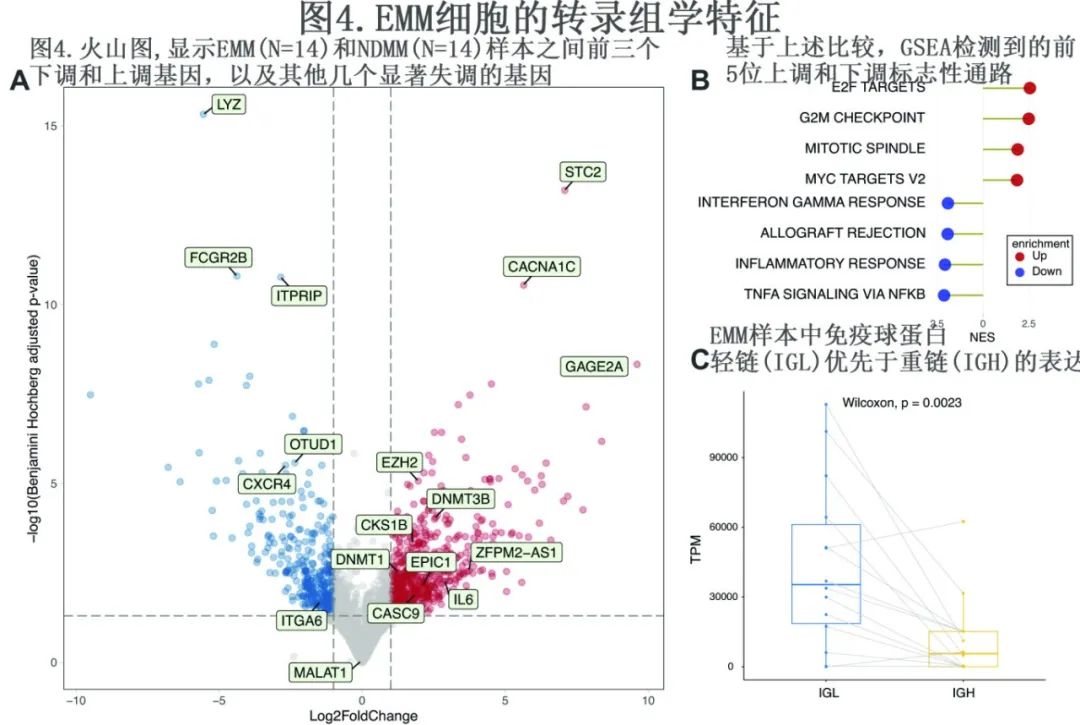
EMM细胞的转录组学分析提示更高的增殖和减少归巢到BM
为进一步探索 EMM 的生物学特征,使用 RNAs测序 将14例 EMM 样本与8例样本配对的14例 NDMM 样本进行比较。共确定799个显著失调的蛋白编码基因(绝对 log2 倍数变化>1,Benjamini–Hochberg调整p<0.05),其中290个下调,509个上调(图4A)。通路富集分析发现,与 NDMM 相比,EMM中与细胞增殖相关的通路明显上调,与免疫反应相关的通路下调(图4B)。在最显著上调的基因中确定了人类癌症中常见的生物标志物:STC2、CACNA1C和GAGE2A;下调最多的基因为FCGR2B,它与 BM 中 PC 持续存在有关,对细胞凋亡、LYZ和 ITPRIP 的易感性更高。此外,去泛素化酶基因 OTUD1 的表达降低,与 MM 患者较差的预后相关。重要的是还检测到CXCR4(编码 PC 归巢至 BM 的关键分子)和整合素基因ITGA6(其下调与从 MM 进展为浆细胞白血病有关)的低表达。同样,CKS1B的表达增加可能是由于 1q21 gain。值得注意的是,PC的强效生长因子白细胞介素 6(IL6) 的表达上调,表明 EMM 肿瘤生长的自分泌调节。在几乎所有样品中观察到与重链相比,轻链 (IGL) 的产量更高(图4C)。与既往研究一致,检测到 EMM 中重要的表观遗传介质的表达显著高于MM:组蛋白甲基转移酶 (EZH2) 和三种人类 DNA 甲基转移酶中的两种(DNMT1和DNMT3B)。此外检测到33个下调和62个上调的lncRNA,其中与肿瘤进展相关的多种 lncRNA 上调,包括EPIC1、CASC9和 ZFPM2AS1。
EMM细胞中治疗相关靶标下调
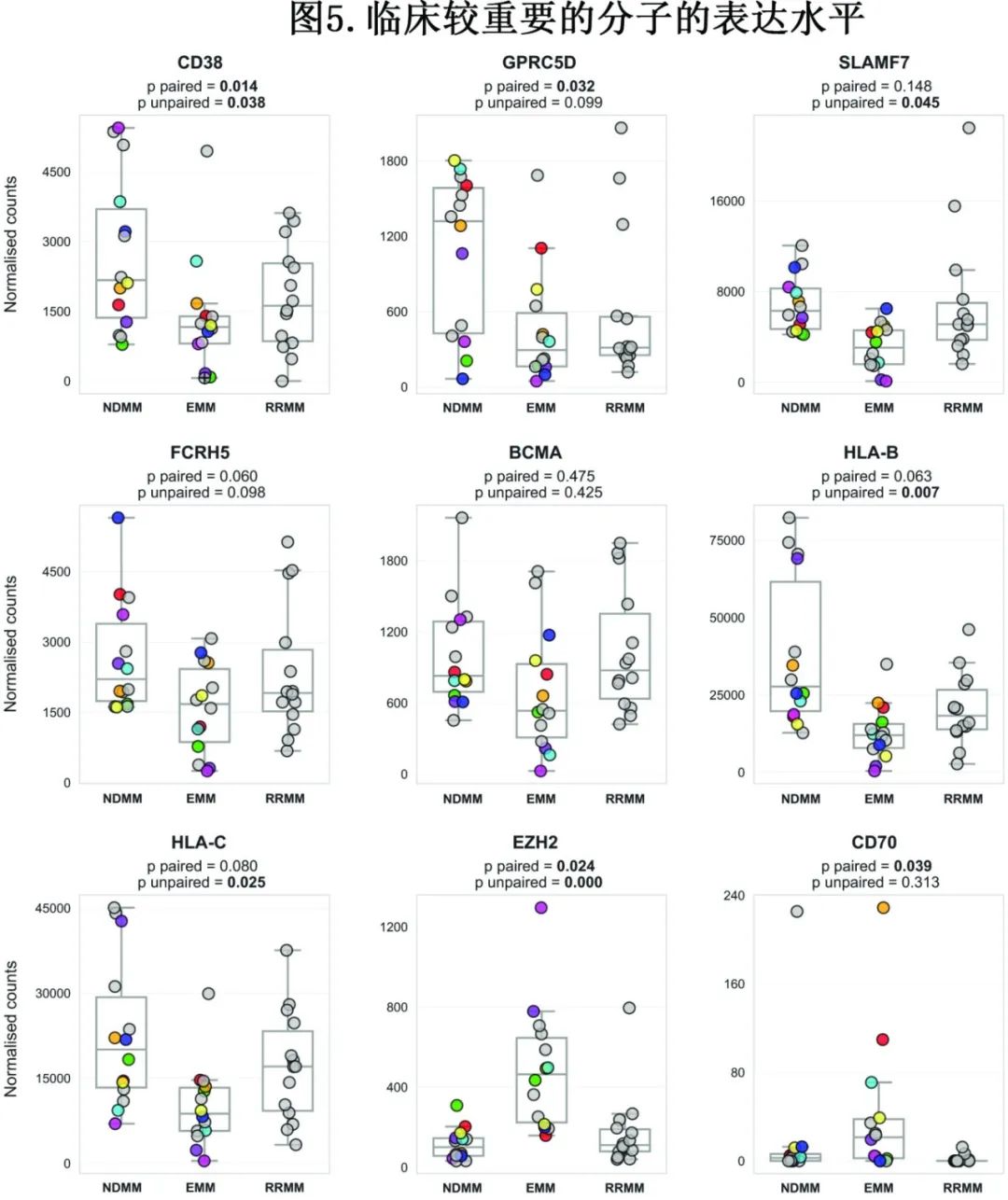
由于抗骨髓瘤治疗(包括新型免疫治疗)在 EMM 中的疗效欠佳,重点研究了免疫治疗靶标的表达,其可预测治疗疗效。为了比较 MM 治疗关键分子靶标的表达,使用了与之前实验相同的 RNA-seq 数据(图4),且仅使用配对样本 (N=8) 进行差异表达分析,以更好地捕获纵向变化。
此外纳入14例不相关的 RRMM 样本,与无 EMM 的晚期 MM 进行比较,结果发现,目前用于 MM 治疗的重要分子靶点(CD38、SLAMF7和GPRC5D)的表达在EMM中显著下降,且FCRH5的表达有较低的强烈趋势(图5)。值得注意的是,未观察到 BCMA 下调。有趣的是EZH2 和 CD70 为高表达,这是其他恶性肿瘤中有希望的靶点。此外,EMM 细胞中 MHC-I 分子 HLA-B 和 HLA-C 的表达下降,其与其他癌症对免疫治疗的反应较差有关;但可能无临床相关性,因为这些基因仍属于最高表达基因。
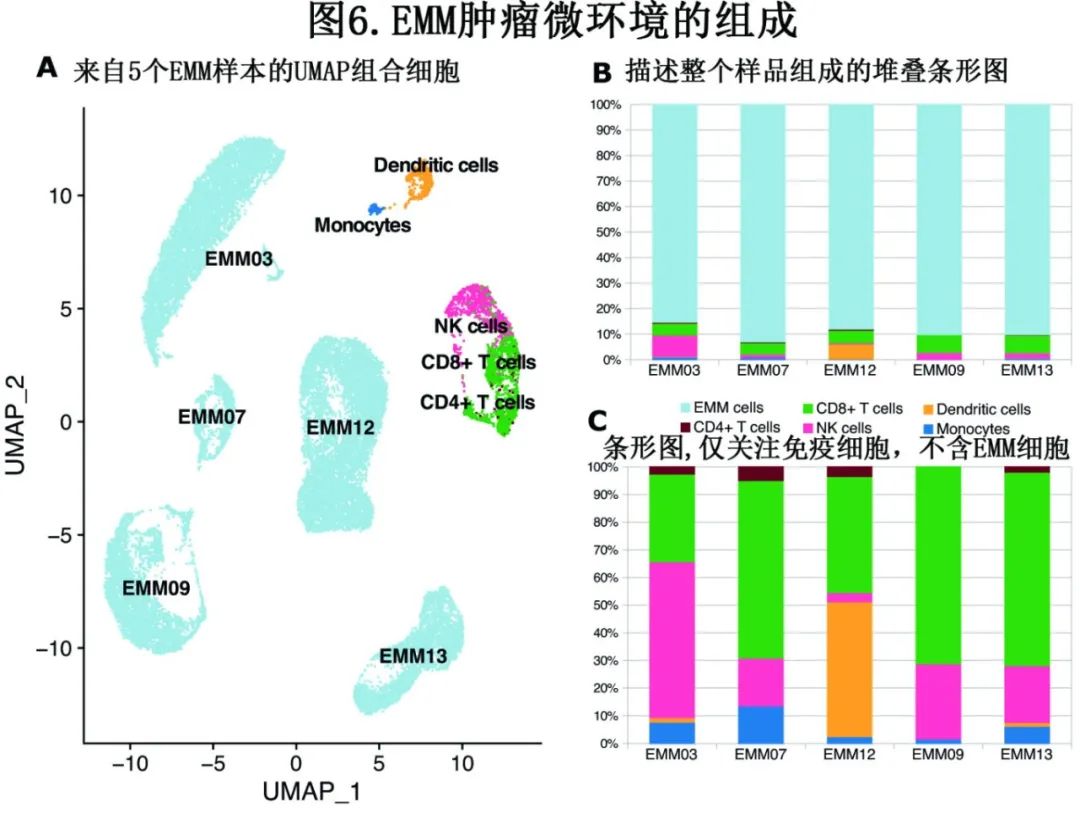
CD8+ T和NK细胞是EMM肿瘤微环境中主要的免疫效应细胞
为更好地理解 EMM 肿瘤的生物学和组成,首次利用 scRNA-seq 对5例 EMM 患者的软组织肿瘤进行测序,获得了每个样本中位3916个细胞。大多数细胞为异常PC(中位数90.5%),其余主要是CD8+ T细胞、NK细胞、单核细胞和CD4+ T细胞(中位数分别为7%、1.8%、0.5%和0.2%;图6)。重要的是,CD8+ T和 NK 细胞是最丰富的免疫细胞,在流式细胞术中具有相当的比例。此外,EMM 细胞具有高度异质性 (图6),可在典型的 PC 分子上进一步证明:例如,1例患者的 EMM 细胞几乎失去 CD38 的表达,另1例患者的肿瘤细胞 CD138 表达非常低。重要的是,这些数据与bulk RNA-seq 和流式细胞术数据一致。
总结
本研究介绍了迄今为止最大、最全面的 EMM 肿瘤细胞 NGS 研究(N=14),描述了 EMM 的关键分子特征,包括重要治疗靶点的表达水平(图7),还利用 scRNA-seq 数据首次提供了对 EMM 肿瘤微环境组成的见解。
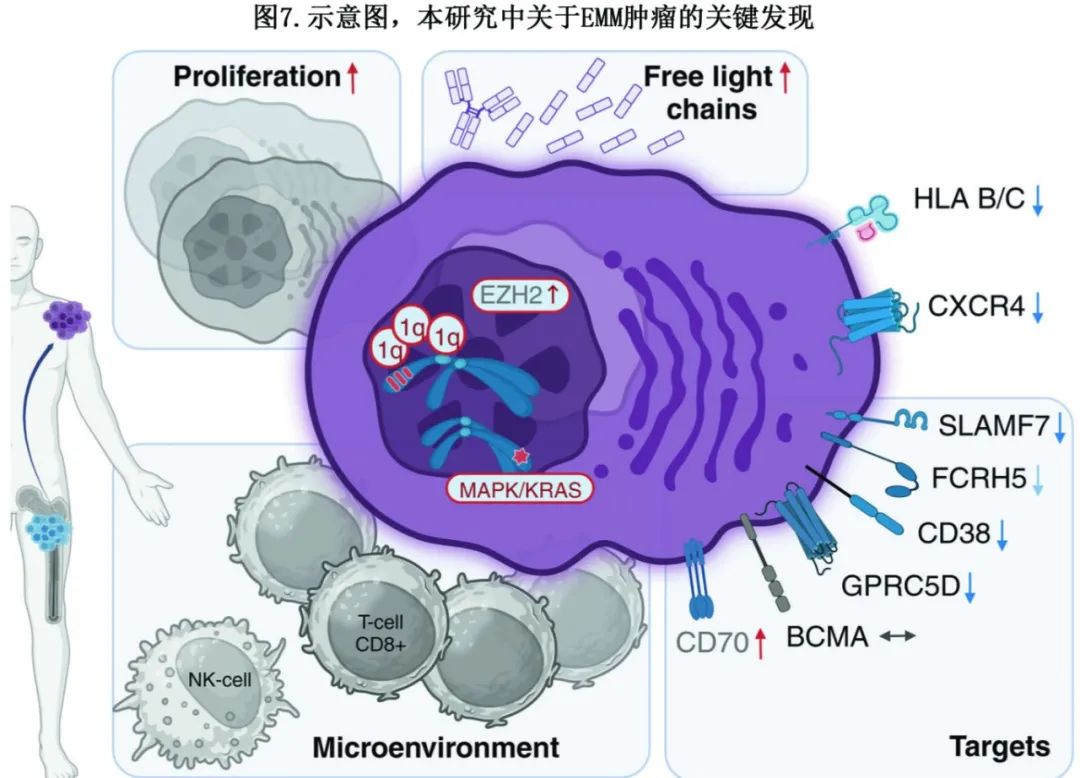
研究发现79%的 EMM 样本中同时存在1q21 gain/amp和 MAPK 通路突变,表明这些是 EMM 发生中至关重要的突变事件。还使用来自大型 CoMMpass 数据集的数据证明,诊断时 KRAS 突变和 1q21 gain/amp的患者发生 EMM 的风险显著更高 (HR=2.4,p=0.011)。CXCR4 下调和细胞增殖增强,以及治疗靶标 (CD38、SLAMF7、GPRC5D、FCRH5) 表达减少,或可解释免疫治疗疗效降低的原因;而EZH2 和 CD70 显著上调,是未来潜在的治疗选择。还首次报道 EMM 的肿瘤微环境,利用单细胞测序揭示了CD8+ T细胞和 NK 细胞是主要的免疫效应细胞。最后,该研究是首次在 EMM 中纵向研究揭示从诊断到 EMM 复发的分子学变化。
参考文献
Jelinek, T., Zihala, D., Sevcikova, T. et al. Beyond the marrow: insights from comprehensive next-generation sequencing of extramedullary multiple myeloma tumors. Leukemia (2024). https://doi.org/10.1038/s41375-024-02206-w
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#多发性骨髓瘤# #二代测序# #髓外骨髓瘤#
109