原发性中枢神经系统淋巴瘤(PCNSL)1例报道及病例分析
2013-07-19 刘元波 李扬 孙雪飞 中国医学论坛报
原发性中枢神经系统淋巴瘤(PCNSL)较少见,但近年来发病率逐年上升,因病变部位特殊,诊断困难,容易误诊,疗效较差,患者预后不良。本文将通过一例典型的病例介绍,对PCNSL的临床特点和诊治要点进行阐述。 病例简介 患者,男,37岁,主因“头晕,头痛,走路不稳4个月,失明失聪1个月”入院。 患者4个月前无明显诱因出现头晕,间断头痛,颞部为主,逐渐加重,并出现走路不稳、耳
原发性中枢神经系统淋巴瘤(PCNSL)较少见,但近年来发病率逐年上升,因病变部位特殊,诊断困难,容易误诊,疗效较差,患者预后不良。本文将通过一例典型的病例介绍,对PCNSL的临床特点和诊治要点进行阐述。
病例简介
患者,男,37岁,主因“头晕,头痛,走路不稳4个月,失明失聪1个月”入院。
患者4个月前无明显诱因出现头晕,间断头痛,颞部为主,逐渐加重,并出现走路不稳、耳鸣、右耳听力下降。1个月前右眼失明,右耳失聪,左耳听力明显下降,颜面麻木,遂来我院就诊。
体格检查
神清,语利,浅表淋巴结未触及,双肺未闻及音,心率60次/分,律齐,腹软,肝脾肋下未触及,双下肢不肿。神经专科查体示右眼颞下视野缺损, 右侧瞳孔直径5 mm,右侧直接、间接对光反射迟钝,右眼眼动受限,双耳粗测听力下降,右耳听力为0,伸舌居中。四肢肌力、肌张力正常,右侧面部针刺觉减退,双侧巴氏征阴性,步态蹒跚。
影像学检查
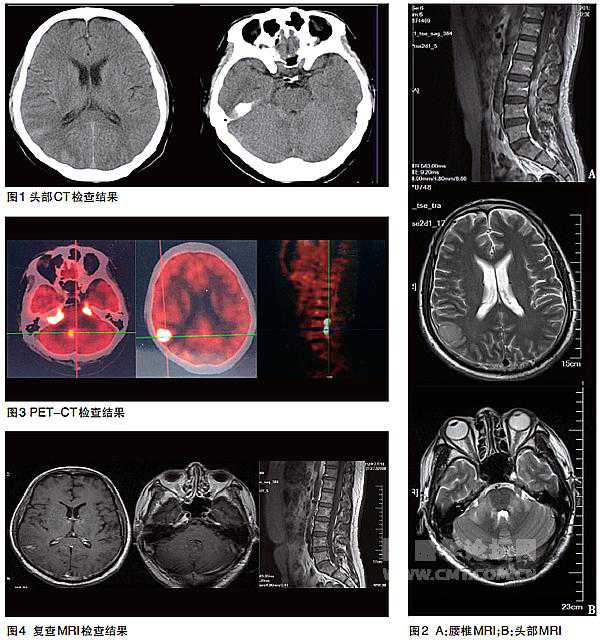
CT示右颞皮层、右侧环池内密度增高(图1);磁共振成像(MRI)示右颞、双侧桥臂可见片状稍长T1、长T2信号影,累及脑干,L1~5椎体水平圆锥可见片状长T2异常信号影(图2),注药后右颞、双侧桥臂、双侧内听道内、第四脑室出口可见片状强化影,边界模糊,脑干表面可见线样强化影,L1~5椎体水平椎管内可见片状强化影;正电子发射体层摄影(PET-CT)示右侧顶叶、双侧颞叶、大脑脚、垂体、小脑见多发片状及结节状高密度区,放射性浓聚明显,腰3~4段水平脊位见放射性浓聚(图3)。
初步诊断
颅内多发性占位,性质待查,中枢神经系统淋巴瘤?
确诊检查
颅内占位通常需要手术或立体定向活检取得病理学证据,再确定诊断,指导下一步治疗。由于该患者一般情况较差,无法耐受神经外科手术及立体定向活检,不能确诊,对家属及医生来说,贸然化疗风险过大。如何进行下一步诊疗成为摆在医生面前的难题,我们决定先行脑脊液细胞学及免疫分型检查,以最大限度减少损伤,降低风险。
脑脊液涂片见恶性淋巴细胞,免疫组化见大量白细胞,淋巴细胞比例99%,单核细胞比例1%,肿瘤细胞阳性。激活淋巴细胞、激活单核细胞、浆细胞均为阴性。免疫组化示CD20++、CD79a++、CD4-、Ki67阳性比例大于50%。符合B细胞型淋巴瘤诊断,免疫分型支持弥漫大B细胞淋巴瘤(DLBCL)。另外,未发现其他部位淋巴瘤证据。
确诊为“原发性中枢神经系统淋巴瘤(PCNSL)”。
治疗
经大剂量甲氨蝶呤(HD-MTX,3.5 g/m2)化疗2个疗程及多次MTX及阿糖胞苷(Ara-C)鞘内注射治疗,患者听力及视力基本恢复,脑脊液细胞涂片及免疫分型未见淋巴瘤细胞,MRI检查颅内占位明显缩小(图4)。
PCNSL的临床表现与诊断
PCNSL是指发生于脑、脊髓、眼或软脑膜的高度恶性淋巴瘤,约95%为成熟的非霍奇金B细胞淋巴瘤。流行病学数据显示,近年来PCNSL的发病率明显上升,而发病率的增长并不能完全归因于诊断技术的发展及人群平均寿命的延长,可能是病例数真正增多所致。PCNSL经治疗后完全缓解(CR)率和长期生存率均较低、预后欠佳。为了提高PCNSL的诊治水平,近年来对其临床特征、影像学表现、组织病理、免疫表型、分子标志及治疗等诸多方面的研究均有很大进展。
临床特征
PCNSL占脑肿瘤的3%,好发于50~70岁,起病较快,起病至就诊时间多在3个月以内。PCNSL主要表现为精神状态的改变,颅内压增高如头痛、恶心呕吐及视乳头水肿以及局部压迫症状,包括癫痫、记忆力减退、行走不稳、视物模糊、视野障碍、言语模糊及轻偏瘫。除了脑部受累,还有10%~20%患者眼部受累,表现为视物模糊或诉有“漂浮物”。
影像学表现
MRI 病变特点为T1WI呈等或稍低信号,T2WI 呈稍低、等或高信号,病变局限,边缘不规则,90%病变周围伴有不同程度的水肿,增强后肿瘤明显均匀一致增强是本病的特点,这是因为血脑屏障的破坏使对比剂渗透到细胞外间隙所致。
60%~70%患者的肿瘤为单发病灶,80%~90%患者的病灶位于幕上。免疫缺陷患者的表现与免疫功能正常患者有所不同,前者MRI可见多发病灶呈环状强化,且几乎均伴有多系统损害。
灌注加权成像(PWI) PWI可准确反映肿瘤血管生成的程度。淋巴瘤是一类缺乏血管的肿瘤,故PWI特征性的表现为肿瘤对比增强明显,但血流灌注量却不明显增加,而通透性明显增加,可与高级别神经上皮肿瘤相鉴别。
弥散加权成像(DWI)和表观弥散系数(ADC) DWI和ADC受肿瘤细胞特性影响,如核浆比大及肿瘤细胞密集、细胞外间隙小等原因使弥散减少,DWI呈高信号影,ADC为等信号或低信号。PCNSL的ADC值低于高级别神经胶质肿瘤。
磁共振波谱(MRS) MRS可以半定量检测到活体组织器官的能量代谢,在显示组织的生化特征方面优于传统MRI。原发性中枢神经系统淋巴瘤(PCNSL)患者N-乙酰天冬氨酸(NAA)下降,脂质、乳酸和胆碱峰增高,虽不具特异性,但对预后评估有一定意义。
18-氟-脱氧葡萄糖PET(FDG-PET) FDG-PET对脑部损伤具有良好的敏感性,但对小病变的诊断不及MRI。对于MRI和CT未发现的脊髓和神经浸润,FDG-PET具有较高敏感性(80%),但对眼内浸润的敏感性较差(20%)。
立体定向活检及组织病理
立体定向活检是明确诊断最有效的方法。值得注意的是,检查前应避免使用糖皮质激素,以免干扰PCNSL组织病理诊断,降低检出率。PCNSL起源于B细胞,绝大多数为DLBCL,可表达B细胞表面标志物如CD19、CD20、CD79a。另外,多数肿瘤还表达MUM-1和BCL-6,但并不表达浆细胞标志物如CD38、CD138。 有研究还证实PCNSL细胞表面表达CD10。
PCNSL具有较高的增殖活性,MIB1染色指数为50%~70%,甚至超过90%。肿瘤细胞一般呈弥漫性生长,瘤细胞浸润周围正常脑组织,也可见在正常脑组织的小血管周围形成袖套,该征象为PCNSL所特有。瘤细胞周围常混有反应性炎症渗出物如CD4、CD8 T细胞、非瘤性B细胞、巨噬细胞、活化的小神经胶质细胞及星形胶质细胞。
脑脊液分析
由于PCNSL是一种高侵袭性肿瘤,鉴别脑脊液中的标志物成为尽快明确诊断的手段之一。
细胞病理分析 脑脊液细胞病理分析是诊断脑膜恶性肿瘤的金标准,80%的PCNSL有软脑膜受累,帕彭海姆(pappenheim)染色检查的敏感性和特异性均较低,需反复腰穿才可能获得诊断。因此,多数患者仍需免疫细胞化学方法如检测B细胞表面标志物来辅助诊断。
流式细胞检测 流式细胞检测是目前诊断很多血液系统恶性肿瘤的重要方法,该方法的优点还在于需要的样本细胞数较少,根据细胞大小、胞内颗粒复杂程度及表面抗原分析,能够区分淋巴瘤细胞和反应性淋巴细胞。
一项回顾性研究显示,对于累及中枢神经系统的淋巴细胞增殖性疾病患者,与单纯应用细胞病理检查的方法相比,结合流式细胞免疫表型分析后,脑脊液检出率增加50%。近期一项研究对30例PCNSL患者脑脊液进行检测,发现流式细胞法敏感性为23.3%,而细胞病理学方法为13.3%。
蛋白分析 包括抗凝血酶、可溶性CD27、免疫球蛋白轻链在内的脑脊液蛋白分析可辅助诊断PCNSL。
微小RNA(miRNA)miRNA是一类由20~22个寡核苷酸构成的非编码RNA,可在转录后水平抑制靶信使RNA(mRNA)的表达,从而抑制蛋白质的合成,达到调控基因表达的目的,在很多肿瘤包括白血病和淋巴瘤中都发现了miRNA的异常表达,在脑脊液中也发现了miRNA,但其稳定性比肿瘤细胞中的miRNA更高。
研究显示,与炎性中枢神经系统疾病或其他神经性疾病相比,PCNSL患者脑脊液中miRNA 21/19B1/92A1显著增高,可作为鉴别诊断的方法之一。
PCNSL的治疗
由于PCNSL对化疗和放疗均敏感,因此患者接受治疗后有可能获得阶段性的完全缓解(CR),但与其他淋巴瘤相比,疗效仍不尽如人意。目前,针对PCNSL的疗效评估主要是基于回顾性研究、病例分析及无对照的Ⅱ期临床试验数据。
外科手术
手术摘除肿瘤并不能缓解神经症状,无益于预后。立体定向活检是确诊方法,术中行神经病理分析能够明确肿瘤性质。对于可能危及生命的颅内高压等情况,可在立体定向活检前使用激素。
放疗
上世纪90年代,单纯全脑放射治疗(WBRT)作为PCNSL的基本治疗,CR率达80%~90%,然而,即便照射剂量达60 Gy,几乎所有患者均会复发,中位总生存(OS)期为12~16个月, 5年生存率为10%~29%。随后,临床研究发现,全脑放疗后HD-MTX化疗可获得良好的反应并能延长患者生存期。放化疗结合治疗后患者CR率为69%~87%,中位无进展生存(PFS)期为24~40个月。因此,临床上广泛采用联合治疗的方法,然而长期随访发现,老年患者联合治疗后会出现严重的神经损害如痴呆和死亡。
一项包括551例患者的随机Ⅲ期研究表明,HD-MTX治疗后,无论是否给予WBRT,OS并无显著差异,但WBRT可将PFS期从11.9个月提高至18.3个月(P=0.13),提示对于控制病情具有重要作用。
化疗
化疗在PCNSL的治疗中具有重要的地位,但由于中枢神经系统存在血-脑脊液屏障(BBB),使得化疗的效果受到一定限制,根据能否通过BBB,可将药物分为三组:①几乎无法通过BBB,效果十分有限,如蒽环类、环磷酰胺;②具有中等能力通过BBB,大剂量使用后可以在中枢神经系统达到治疗浓度,如甲氨蝶呤(MTX)、阿糖胞苷(Ara-C);③使用常规浓度即可在中枢神经系统达到治疗浓度,如糖皮质激素和替莫唑胺。
{nextpage}CHOP(环磷酰胺+多柔比星+长春新碱+泼尼松)方案对PCNSL几乎无效,与单独使用HD-MTX相比,加用CHOP并不能改善预后。因此,目前多选择较易通过BBB的化疗药物联合治疗。化疗过程中要注意检测肝肾功能及血清乳酸脱氢酶(LDH)浓度。
HD-MTX是PCNSL治疗的主要手段,既往有3项临床研究探讨了不同剂量MTX的疗效:WBRT前给予MTX(1 g/m2)治疗后3年OS率为45%~50%;WBRT前每2~3周给予MTX(3.5 g/m2)治疗后3年OS率为32%~47%;WBRT前每2周给予MTX(8 g/m2)治疗后3年OS率为33%~35%。值得注意的是,使用8 g/m2 的患者中,45%由于肌酐清除功能受损须减少剂量,而3.5g/m2 MTX组几乎没有患者需要减少剂量。因此,权衡用药安全性及疗效,3.5 g/m2是最好的选择。
大剂量Ara-C联合MTX使用可以增加疗效,改善预后。近期发表的一项随机试验纳入79例确诊PCNSL的患者,给予单独HD-MTX(3.5 g/m2)或联合大剂量Ara-C治疗,随后均给予WBRT,CR率分别为18%和46%(P=0.006),3年OS率分别为32%和46%(P=0.07)。
利妥昔单抗是治疗B细胞肿瘤的重要靶向药物,但作为一种大分子蛋白,很难进入中枢神经系统。德国一项入组1222例DLBCL患者的回顾性研究显示,利妥昔单抗联合CHOP能够抑制DLBCL的中枢浸润,但在法国一项包括399例患者的研究中并没有获得一致的结论。有研究显示,利妥昔单抗与HD-MTX联合治疗PCNSL的CR率达78%,2年OS率为67%。利妥昔单抗在PCNSL中的确切作用还有待商榷。
其他具有良好中枢神经系统渗透的糖皮质激素和烷化剂如替莫唑胺、塞替派、异环磷酰胺、亚硝基脲、丙卡巴肼已被纳入到PCNSL联合化疗方案中。
活检前应避免使用类固醇激素,只有当患者有脑疝可能立即威胁生命时才可使用。另外,还需要注意预防长期使用类固醇激素而导致的免疫抑制。替莫唑胺具有良好的安全性并可通过BBB,能够诱导25%的复发/难治性PCNSL患者CR,且可以与HD-MTX联合应用于老年患者。异环磷酰胺可提高CR率,抑制肿瘤进展,但毒性较高,尤其不适用于老年患者。
塞替派可与HD-MTX、HD-Ara-C、去甲氧基柔红霉素及WBRT联合使用,Ⅱ期临床研究显示,中位PFS期为13个月,5年OS率为41%,但对10%的患者有致死毒性。丙卡巴肼联合HD-MTX及长春新碱后给予WBRT及HD-Ara-C治疗的5年生存率为32%。双氯乙基亚硝脲(BCNU)可作为联合化疗的一部分或自体干细胞移植的预处理。
拓扑替康与替莫唑胺一样,均具有良好的中枢神经系统生物利用率,在复发/难治性PCNSL治疗中具有较好的前景,CR率为19%,1年OS率为39%。
PCNSL的预后
患者年龄和体能状态是影响PCNSL预后的重要因素, 一项多中心回顾性研究提示,与预后不良相关的5项因素包括:①年龄>60岁;②美国东部肿瘤协作组(ECOG)评分为2~4;③血清LDH浓度增高;④脑脊液蛋白质含量增高;⑤脑实质深部受累。也有研究认为,只有年龄和体能状态对预后判断有意义。
在形态学方面,血管增生提示预后不良,反应性血管周围T细胞浸润提示预后良好。分子标志研究发现,BCL-6的表达提示预后良好。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








完整+前沿,6年后拜读也有帮助
125
拜读了
111
颅内占位压迫听神经!
105
片子很清楚!
121
学习了,分享一下!
109
#中枢神经系统淋巴瘤#
73
#PCNSL#
85
#原发性#
80
#CNS#
77
#神经系统#
66