急性呼吸窘迫综合征(ARDS),表现为弥漫性肺损伤、炎症和肺泡萎陷,影响患者的气体交换,导致低氧血症,死亡率超过40%。脂质体已经在临床上用于治疗肺部疾病和损伤。Journal of Controlled Release杂志的一项研究设计了大小为100nm的脂质体,比较气管内滴注(ET)和静脉内(IV)给药,或同时两种给药途径对肺部损伤的治疗效果。

该脂质体是通过肺部给药治疗ARDS,作为肺部疾病的模型。优化脂质体脂质成分(主要是DPPC),模拟肺表面活性物质,甲强龙(MPS)和化痰药乙酰半胱氨酸(NAC)脂质体中的药物浓度分别达到了4.3mg/mL和1.1mg/mL,包封率分别为98%和92%。
研究检测了DPPC脂质体药物在开始暴露于脂多糖(LPS)后对RAW264.7巨噬细胞的影响。与未处理的LPS诱导细胞相比,经DPPC脂质体药物、MPS脂质体、游离MPS加NAC混合物、游离MPS处理后,TNFα和一氧化氮(NO)水平显著降低。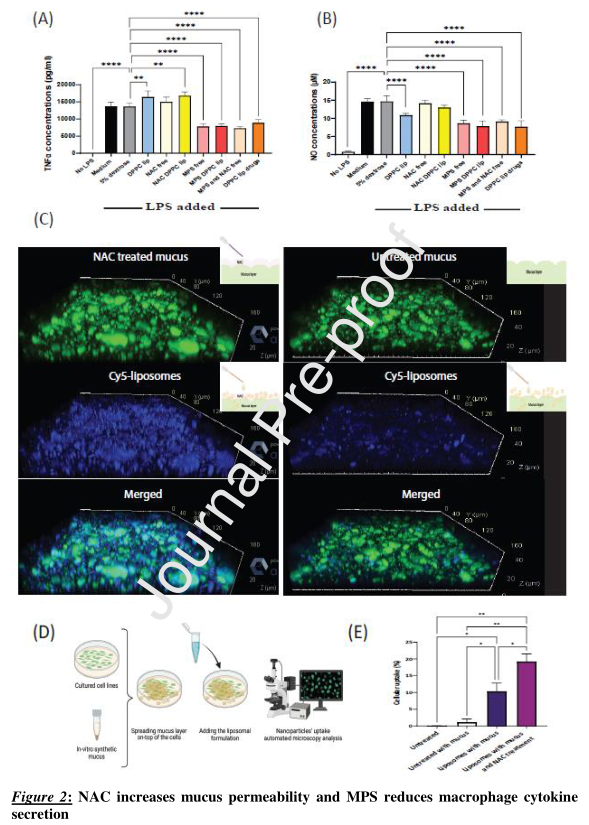
研究检测了NAC对脂质体粘液渗透的影响。与未经处理的粘液相比,NAC处理改善了脂质体粘液渗透。
在体内,使用LPS诱导的肺部炎症模型,通过静脉(IV)、气管内(ET)或IV+ET纳米颗粒给药,评估脂质体在C57BL/6小鼠体内的累积和疗效。使用两种给药方法,脂质体在炎症肺部的累积曲线在48小时内增加。脂质体在炎症肺中的累积增强表明脂质体靶向ARDS的关键潜力。
有趣的是,虽然IV给药脂质体广泛分布于整个肺部,但ET给药脂质体存在于肺实质中,但在肺的一些远端区域未检测到,可能是由于这些部位的通气功能受损。
为了进一步确定脂质体治疗的效果,研究人员测定了支气管肺泡灌洗(BAL)液中TNF-α、IL-1β和IL-6细胞因子的水平。与未经治疗的小鼠相比,IV和ET治疗后,IL-6水平显著降低(分别为664 pg/ml和2962 pg/ml)。在游离ET或联合ET加IV药物治疗26小时后,未观察到细胞因子水平的显著降低。与未经治疗的炎症小鼠(1459 pg/ml)或接受游离药物的小鼠相比,注射DPPC脂质体、脂质体药物IV和IV加ET给药后,TNF-α水平显著降低(分别为322pg/ml和540 pg/ml)。同样,与其他途径相比,接受ET+IV治疗途径小鼠的IL-1β水平最低(下降5倍)。
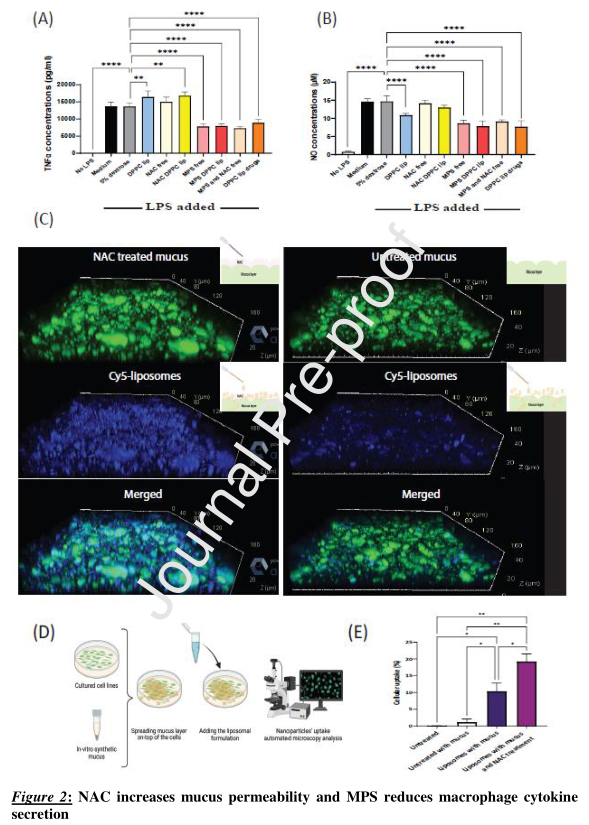
结果表明,DPPC脂质体系统具有治疗肺部疾病的潜力,虽然经过所有治疗方式后,炎症标志物(TNF-α、IL-1β和IL-6)都有所减少,但在ET加IV联合用药中观察到的减少程度最高。
原文出处:
S.A. Raviv, M. Alyan, E. Egorov, et al., Lung targeted liposomes for treating ARDS, Journal of Controlled Release (2021), https://doi.org/10.1016/j.jconrel.2022.03.028.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#RDS#
98
#脂质体#
118
#ARDS#
128
#JCR#
89