Nature Cancer:重磅发现!Nature子刊连发两文:癌细胞“休眠”数年不死 或是导致癌症转移/复发的关键因素
2021-12-22 生物探索 生物探索
白血病,一种令人谈虎色变的癌症。在我国,白血病的发病率在各类肿瘤中占据第六位,而患病人群中又以低龄儿童为多。白血病是一类造血干细胞恶性克隆性疾病,因为增殖失控、分化障碍、凋亡受阻等机制在骨髓和其他造血
白血病,一种令人谈虎色变的癌症。在我国,白血病的发病率在各类肿瘤中占据第六位,而患病人群中又以低龄儿童为多。白血病是一类造血干细胞恶性克隆性疾病,因为增殖失控、分化障碍、凋亡受阻等机制在骨髓和其他造血组织中大量增殖累积抑制了正常的造血功能。临床可见不同程度的贫血、出血、感染发热以及肝、脾、淋巴结肿大和骨骼疼痛。
几年前,伦敦大学学院的科学家们发现,一些患有常见儿童癌症类型的患者对治疗没有反应,这是由一种罕见且未曾被识别的癌细胞在化疗期间“休眠”并抵抗其作用所造成的。
而最近的一项发表于Nature Cancer的研究首次揭示了为什么少数白血病细胞能够在B细胞前体急性淋巴细胞白血病 (BCP-ALL) 化疗的关键前 28 天中存活下来。由于约20%的BCP-ALL患者死于这种疾病,许多幸存患者因治疗时间过长和强度过大而遭受长期并发症,迫切需要更有效且毒性更小的疗法,而这项开创性的研究为如何设计此类治疗提供了新的思路。

与所有癌症一样,当正常细胞获得多个基因突变时,就会发生 BCP-ALL。迄今为止,普遍持有的观点是,癌细胞中突变的精确组合决定了它在治疗后是否会保留下来,并可能导致疾病复发。
该研究团队希望通过分析那些在患者完成初始治疗后残留的细胞来探索BCP-ALL治疗抵抗的机制,但是这种细胞稀少且难以直接分离。为了克服这个问题他们开发了一种创新的小鼠模型,将 BCP-ALL 患者的细胞移植到小鼠体内然后接受化疗。

小鼠模型
令研究人员惊讶的是,化疗没有对耐药癌细胞进行基因选择,同时也并没有出现像人们预判的那样共享任何特定的突变组合。此外,他们还发现抗性细胞确实具有一类特性——抗性细胞状态。这种状态的特征包括骨髓干细胞的基因表达模式以及表明抗性细胞处于 “睡眠模式”。这是首次在未经治疗的白血病中观察到休眠细胞。
在解释这项研究时,主要作者Virginia Turati博士(来自伦敦大学学院癌症研究所)说:“我们想了解为什么BCP-ALL在一些患者中复发,而在其他患者中没有。当我们发现这种疾病由携带不同组合的多种细胞类型产生基因突变时,我们假设某些突变组合会比其他突变更糟糕,并使某些细胞能够通过治疗持续存在,这将成为疾病复发理论支撑。”
研究团队下一步将考虑如何利用这一特性治疗BCP-ALL。伦敦癌症研究所的Mel Greaves教授同样参与了这项研究,他认为可以先确定休眠细胞具有哪些特殊的标志物,然后患者在经过化疗之后就能进行对应追踪测试,看看是否还存在休眠的癌细胞。
还有一种方式,就是在化疗之前激活全部的休眠细胞,然后再集体杀灭。“癌细胞会一直设法在休眠和清醒的状态中切换,而化疗期间碰巧处于休眠的细胞则能逃过一劫”。Greaves教授表示,这种先激活再杀灭的方式或许能解决众多成人和儿童白血病患者的复发问题。
同样是在近日刊登的Nature Cancer上,来自西奈山医学院的研究团队发表了题为:“A tumor-derived type III collagen-rich ECM niche regulates tumor cell dormancy”的研究成果,进一步明确了癌细胞“休眠”的信号通路。研究表明休眠癌细胞通过在其周围的细胞外基质中(ECM)分泌一种称为 III 型胶原蛋白的蛋白来保持自己处于休眠/激活状态。III 型胶原蛋白如同“开关”一样,当癌细胞ECM中这种胶原蛋白丰富时,可以迫使其保持休眠状态并防止肿瘤复发,而当胶原蛋白水平逐渐下降时才会逐渐变成恶性肿瘤。
最终研究人员确定了III型胶原/DDR1/STAT1信号通路作为构建富含III型胶原蛋白的ECM微环境所需的信号节点。
首先,为了确定休眠期和增殖期肿瘤细胞周围ECM的三维结构组织,研究人员利用多光子二次谐波成像(SHG),分析了几个细胞休眠模型及其增殖对应物的胶原纤维方向:增殖型(T-HEp3)和休眠型(D-HEp3)头颈部鳞癌(HNSCC),以及两个增殖型和休眠型乳腺肿瘤模型(4T1和D2.1A肿瘤和各自的休眠对应物4T07和D2.OR)。研究结果显示,休眠期肿瘤的ECM具有波浪形的胶原纤维,与增殖期肿瘤相比,其胶原纤维的排列和方向有所减少。
鉴于在休眠期和增殖期肿瘤的ECM组织之间观察到的结构差异,研究人员决定进一步探索体内休眠期癌细胞周围的ECM组织。原发肿瘤切除后,残留癌细胞的多光子SHG成像显示,单个肿瘤细胞周围的胶原纤维排列不整齐且高度卷曲。
为了进一步确认含有这些排列不整齐且高度卷曲胶原纤维的残留癌细胞是否处于休眠状态,研究人员使用了一种CDK2生物传感器,可以用荧光显微镜识别细胞内细胞周期的每个阶段。研究结果显示,肺部残留癌细胞和独立的休眠癌细胞(DTC)的图像分析显示,DTC细胞在细胞核中有很强的传感器积累,表明这些细胞确实是在细胞周期G0/G1中,处于休眠和阻滞状态。另一方面,细胞簇显示了在细胞周期不同阶段的癌细胞的混合种群,证实了它们的增殖状态。此外,研究人员进一步研究发现增殖性原发肿瘤和转移性肿瘤细胞周围胶原纤维排列增加,表明休眠激活的增殖癌细胞能够重塑有利于排列的胶原纤维ECM。
以上这些结果表明,休眠细胞周围的胶原纤维具有非线性排列和波浪形结构的特点,并能在癌细胞重新激活时转换为高度的线性方向。
由于休眠期和增殖期的肿瘤ECM在结构上是不同的,研究接下来试图确定它们的组成或“基质体”是否有差异。研究人员对脱细胞的T-HEp3生长的肿瘤和D-HEp3休眠结节进行了质谱分析。结果显示,休眠期癌细胞的基质体高度富集胶原蛋白。进一步的肿瘤切片的免疫荧光染色显示,与增殖期的T-HEp3相比,D-HEp3中胶原蛋白(I、III、IV、V和VI型)的丰度更高。此外,研究人员利用人-鼠异种移植瘤模型进一步确定了肿瘤细胞(人类蛋白序列)和基质细胞(小鼠蛋白序列)对基质体生产的相对贡献。数据表明,休眠期肿瘤的ECM富含胶原蛋白,其中III型胶原蛋白是休眠期癌细胞产生的最丰富的胶原ECM蛋白质。
以上这些结果表明,休眠期癌细胞衍生的ECM富含III型胶原蛋白。
鉴于III型胶原蛋白在休眠肿瘤中的高度富集,研究人员进一步探索在高度增殖的肿瘤微环境中增加III型胶原蛋白的浓度是否能促使癌细胞进入休眠状态并阻止其生长。首先研究人员使用鸡胚尿囊膜(CAM)实验进行了一系列体内实验,将T-HEp3细胞接种到有或没有I型、III型或IV型胶原蛋白的CAM上。结果显示,只有与III型胶原蛋白共同注射的肿瘤细胞生长的肿瘤明显较小。此外,进一步的研究显示,体内肿瘤生长的抑制是胶原蛋白诱导肿瘤休眠所致,而不是细胞凋亡的结果。浓度等于或大于1mg/ml的III型胶原蛋白抑制了体外和体内的细胞增殖,同时III型胶原蛋白没有表现出细胞毒性的增加、细胞凋亡或活力下降。
接下来,研究人员试图确定用含III型胶原蛋白的生物工程支架处理局部残留的癌细胞(原发肿瘤切除后观察到的)是否能防止残留的休眠癌细胞的苏醒。研究结果显示,用含III型胶原蛋白的支架治疗的小鼠中只有20%在肿瘤手术后出现复发,而对照组中出现80%的肿瘤复发。
以上这些结果表明,III型胶原蛋白诱导肿瘤休眠。
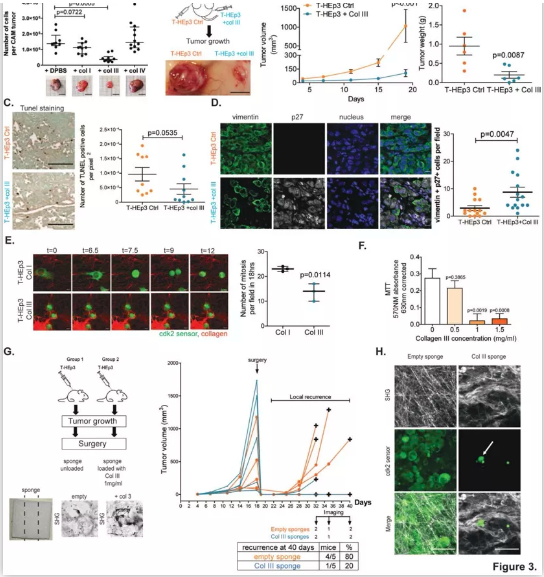
图. 富含III型胶原蛋白的微环境诱导休眠
在休眠肿瘤细胞的ECM中观察到III型胶原蛋白丰度的增加与休眠模型中的COL3A1基因在mRNA水平和蛋白水平的高表达相关,表明COL3A1是在癌细胞休眠期间操纵的基因网络的一部分。
为了确定COL3A1在维持癌细胞休眠中的作用,研究人员使用siRNA敲除了D-HEp3休眠细胞中的COL3A1,并进行体内生长实验。研究表明,COL3A1的缺失会中断D-HEp3的休眠并恢复其生长。同时,肿瘤细胞中COL3A1缺失后III型胶原蛋白含量的发生了变化,伴随着胶原蛋白纤维排列的明显增加,表明III型胶原蛋白对休眠细胞中观察到的波浪形ECM组织有重要作用。最后,III型胶原蛋白在T-HEp3细胞周围积累,并自发扩散到肺部,在肺微转移中显着减少,表明休眠肿瘤细胞沉积III型胶原蛋白可能是建立休眠微环境的一个关键步骤。
以上这些结果表明,癌细胞衍生的III型胶原蛋白决定了ECM的结构并维持癌细胞休眠状态。
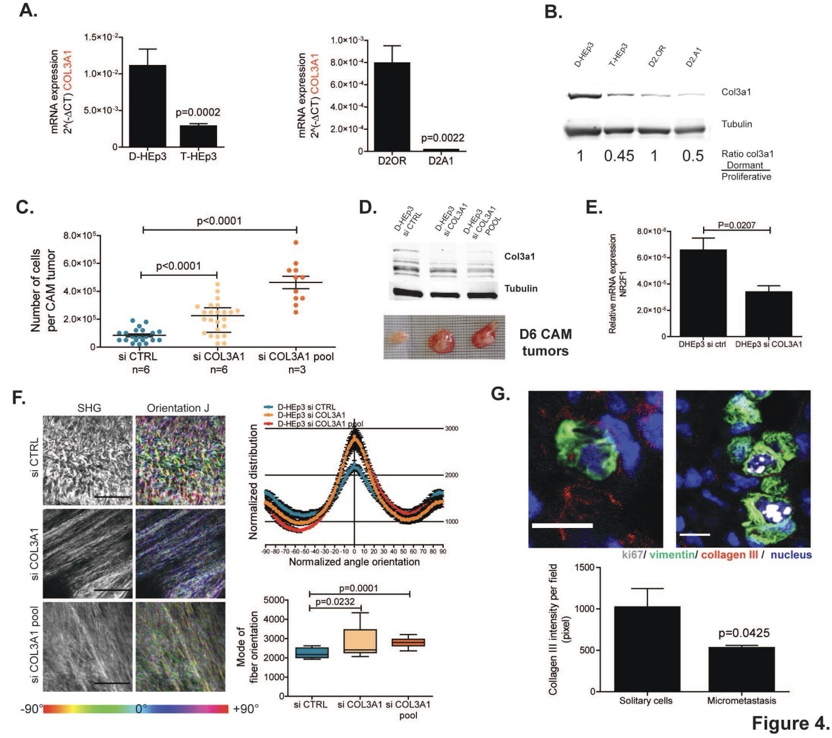
图. 肿瘤细胞分泌的III型胶原蛋白调节休眠状态
为了探索哪些胶原蛋白受体将与III型胶原蛋白结合,来维持癌细胞休眠状态。研究人员进行RNA序列和转录组分析确定胶原蛋白受体在休眠细胞中特异表达与增殖。研究发现,在休眠的D-HEp3和T-HEp3中整合素α1、α2、α,β1和DDR1受体明显特异表达。
接下来,研究人员在D-HEp3细胞中进行了体内siRNA筛选,以确定哪些受体是使癌细胞保持休眠所必需的。研究结果显示,敲除DDR1后休眠癌细胞发生了转移。细胞周期分析显示,DDR1敲除后处于G0的细胞数量明显减少,进一步证实了DDR1在细胞休眠中的作用。在鸡胚尿囊膜CAM模型体内实验中,研究人员使用未敲除的DDR1结构,从侧面进一步证实了DDR1是维持休眠的必要条件。
研究人员发现,在头颈鳞癌和乳腺肿瘤模型中,与相对应增殖期相比,休眠细胞具有较高的DDR1蛋白水平。为了进一步验证,在增殖期低含量DDR1的细胞中增加DDR1水平是否会诱发休眠。研究人员在T-HEp3细胞中过量表达DDR1,并在体内测量肿瘤的生长。研究结果显示,在无诱导细胞死亡的情况下,肿瘤生长下降。更重要的是,细胞粘附试验显示,休眠细胞与III型胶原(而非I型或IV型胶原)的结合依赖于DDR1。总之,这些结果表明DDR1与III型胶原的结合是进入休眠的原因。
接下来研究人员进一步设计了实验,探索DDR1驱动的休眠是否可以通过调节休眠细胞的基质体来调节。研究结果显示,DDR1缺失的肿瘤胶原蛋白ECM的纤维排列明显增加。有趣的是,DDR1缺失的细胞显示COL3A1 mRNA表达减少。此外,蛋白质组学和免疫染色分析证实,DDR1缺失后III型胶原蛋白的表达受到影响,以及DDR1敲除对基质体基因组的表达有显着影响。
以上这些结果表明,DDR1通过调节III型胶原蛋白和基质体来维持癌细胞休眠状态。

图. DDR1是维持癌细胞休眠所必需的
由于DDR1调节COL3A1基因的表达,研究人员分析了RNA测序数据,以确定可能调节COL3A1水平和休眠的DDR1下游的转录因子。研究结果显示,STAT1调节COL3A1基因表达。此外,STAT1的缺失恢复了休眠癌细胞的生长,并在蛋白水平上降低了DDR1的丰度。
由于了解Janus激酶(JAK)在STATs磷酸化过程中的作用,研究人员测试了JAK 1、2和3激酶在肿瘤细胞休眠中的作用。结果显示,使用选择性抑制剂抑制JAK2能够恢复体内休眠细胞的增殖。
有趣的是,在STAT1下调后,可以观察到ECM组织从波浪形转变为直线,并增加了排列,类似于以前在COL3A1和DDR1敲除后观察到的情况。共同免疫沉淀实验表明,当暴露于III型胶原蛋白时,DDR1和STAT1在休眠癌细胞中是复合的。此外,对镀在玻璃上或III型胶原上的D-HEp3的免疫荧光分析显示,III型胶原蛋白上的磷酸STAT1的核定位增加。DDR1受体或COL3A1的下调会诱导STAT1在RNA水平的表达下调。这表明形成了反馈回路,休眠细胞中的DDR1/III型胶原蛋白可能调节STAT1的表达,以维持癌细胞的休眠状态。
以上这些结果表明, DDR1/STAT1的激活触发了III型胶原蛋白的表达以维持休眠状态。

图. DDR1/STAT1通路调控癌细胞休眠和COL3A1表达
总之,这篇文章中研究人员描述了癌细胞如何构建III型胶原蛋白细胞外基质体来诱导和维持休眠,防止其立即生长。研究人员表示,该研究结果具有潜在的临床意义,可能会产生一种新的生物标志物来预测肿瘤复发,以及一种减少局部和远处复发的治疗干预措施。这种旨在防止休眠细胞觉醒的干预措施已被建议作为防止转移性生长的治疗策略。
原始出处:
Virginia A. Turati et al, Chemotherapy induces canalization of cell state in childhood B-cell precursor acute lymphoblastic leukemia, Nature Cancer (2021). DOI: 10.1038/s43018-021-00219-3.
Martino JD, Nobre AR, Mondal C, et al. A tumor-derived type III collagen-rich ECM niche regulates tumor cell dormancy [J]. Nature Cancer 2021.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#休眠#
112
#Nat#
85
#癌细胞#
96
#致癌#
78
#癌症转移#
85
#重磅#
53