CAR-T治疗实体瘤设计策略解析
2019-10-09 挑食的免疫喵 闲谈Immunology
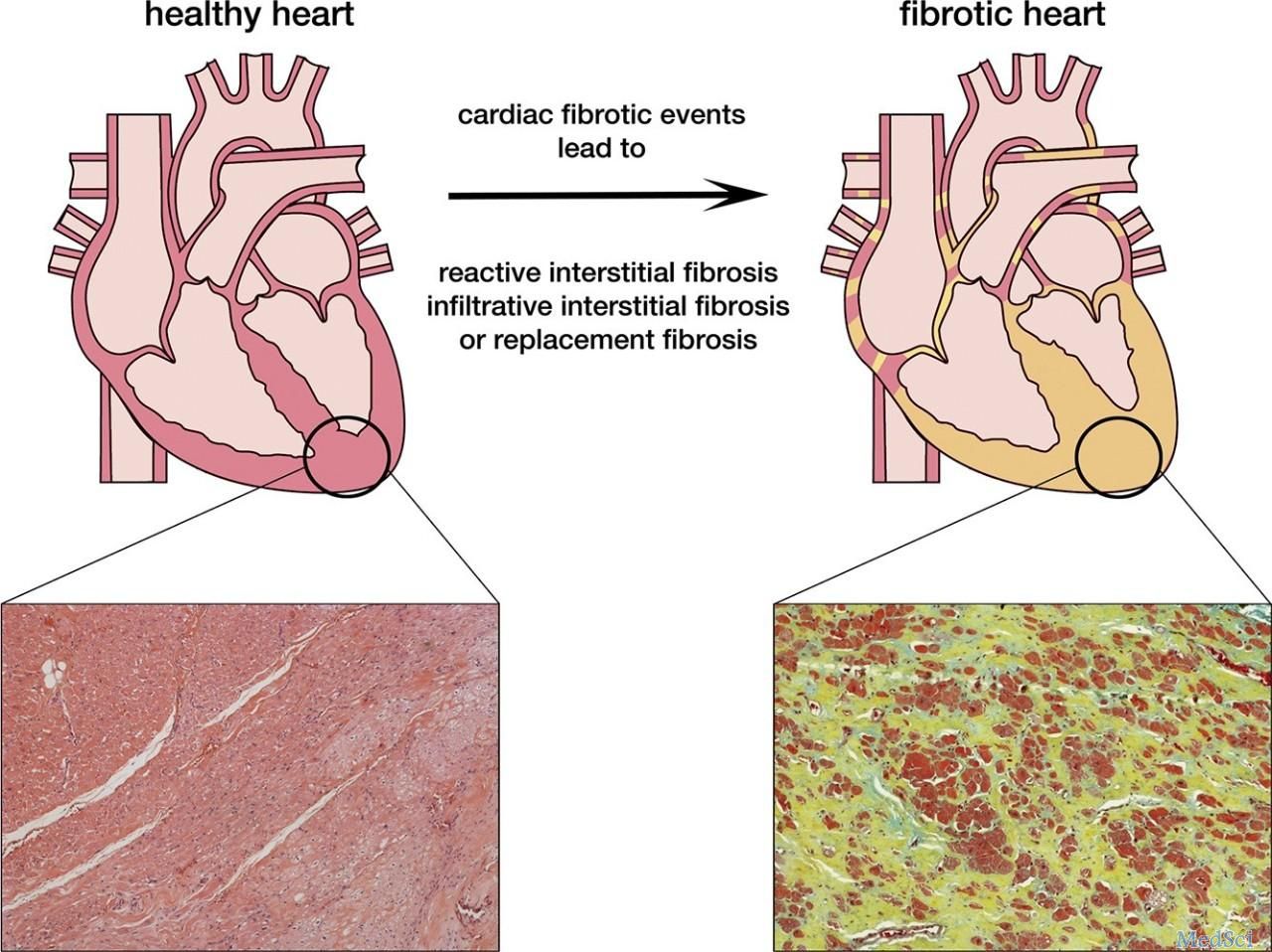
免疫蛋白质组学发现肿瘤相关抗原(TAAs)。这些抗原可能是完全未知的蛋白质(新抗原)或从野生型突变的肽(新表位)。利用蛋白质组学鉴定的TAAs的几个例子包括PSMA1、PAP3、ANXA3和MASPIN,这几个标记被一组鉴定为结肠癌的生物标志物。其他具有潜在靶向性的TAAS包括olfactomedin4、CD11b和整合素α-2,它们在结直肠癌肝转移中被发现过度表达。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#解析#
67
#CAR-#
86