【论着】| 癌相关纤维细胞介导直肠相关作用的机制研究
2024-01-21 中国癌症杂志 中国癌症杂志 发表于陕西省
本研究以iCAF无血清培养抚育iCAF如何进行免疫调节因子,再以iCAF条件培养基(iCAF条件培养基,iCAF-CM)刺激CRC细胞,探讨iCAF与CRC细胞的关系。
[摘要] 背景与目的:结直肠癌(结直肠癌,CRC)是常见的消化系统恶性肿瘤之一,但其产生的仍然是警报。肿瘤微环境(肿瘤微环境,TME),尤其是其中与癌症相关的纤维细胞(癌相关成纤维细胞,CAF),在肿瘤的发生、发展及其过程中都发挥着重要作用。本研究旨在探讨CAF(炎性CAF,iCAF)对CRC细胞的影响方法:提取自上海中医药大学附属普陀医院(2022年8月——2022年9月)诊治的CRC患者并经手术切除的CRC组织原代CAF[获得上海中医药大学附属普陀医院伦理委员会批准,编号:PTEC-A-2023-5(S)-1],按照CAF的表面标志物第一源性生长因子受体α(血小板衍生生长因子受体α,PDGFRA)对原代细胞进行分选,筛选出iCAF。使用不添加血清的培养基分别对人培养成纤维细胞(人肠成纤维细胞,HIF)和iCAF进行培养以获取HIF条件培养基(HIF-conditionedmedium,HIF) -CM)和iCAF条件培养基(iCAF-conditionedmedium,iCAF-CM)。 根据处理方式将二氧化碳分为头痛(不处理)、实验组1(加入HIF-CM)和实验组2(加入)观察HIF或iCAF刺激后CRC细胞的死亡率变化、蛋白水平、mRNA水平变化及对Wnt/β-catenin信号转导的影响。结果:经过iCAF刺激后,CRC细胞的半数抑制浓度(半数抑制浓度,IC50)较大幅度降低和HIF-CM组升高(P<0.05)。与高精度和HIF-CM组相比,iCAF-CM组肿瘤细胞的荧光表达率明显下降,荧光蛋白caspase-3的表达量下降,抗荧光蛋白Bcl-2、Bcl-xL和survivin表达量均上升(P<0.05)。iCAF-CM组Wnt/β-结论: iCAF可以介导CRC细胞产生组件,其与激活机制β-catenin信号转导已有关。
[关键词]结直肠癌;炎症相关纤维细胞;添加;Wnt/β-catenin信号转导通道
[摘要]背景与目的:结直肠癌(CRC)是常见的恶性肿瘤之一,但其产生耐药性的机制尚不清楚。肿瘤微环境(TME),特别是癌相关成纤维细胞(CAF),在肿瘤的发生、发展和耐药过程中发挥着重要作用。本研究旨在探讨炎症性癌相关成纤维细胞(iCAF)对CRC细胞耐药的影响及其可能机制。方法:采集2022年8月至2022年9月在上海中医药大学普陀医院接受手术的结直肠癌患者的原代CAF,根据CAF表面标志物进行原代细胞分选[经普陀区伦理委员会批准]上海中医药大学附属医院:PTEC-A-2023-5(S)-1],血小板衍生生长因子受体α(PDGFRA),筛选iCAF。使用无血清培养基培养人肠成纤维细胞(HIF)和iCAF细胞以获得条件培养基。根据处理方法将结肠癌细胞分为对照组(不处理)、实验组1(用HIF-CM处理)和实验组2(用iCAF-CM处理)。我们观察CRC细胞存活率和凋亡率的变化,结果: iCAFs刺激后,CRC细胞的半数抑制浓度(IC50)高于对照组和HIF-CM组(P<0.05)。与对照组和HIF-CM组相比,iCAF-CM组肿瘤细胞凋亡率显着降低,caspase-3表达减少,Bcl-2、Bcl-xL、survivin表达增加( P<0.05)。iCAF-CM组Wnt/β-catenin信号通路被激活。结论: iCAFs能够介导CRC细胞耐药,其机制与Wnt/β-catenin信号通路的激活有关。
[关键词]结直肠癌;炎性癌症相关成纤维细胞;耐药性; Wnt/β-连环蛋白信号通路
直结肠癌(结直肠癌,CRC)是常见的消化系统恶性肿瘤[1]。尽管针对癌症进展的新药不断得到巩固,但性问题仍然是该领域的一个挑战[2]。近年来,肿瘤微环境(肿瘤微环境,TME)在化疗中的重要性已广受关注[3]。癌症相关成纤维(细胞癌相关成纤维细胞,CAF)是TME的主要成分,其细胞因子、趋化因子组成CAF具有异质性,分成肌纤维CAF(肌成纤维细胞CAF,myCAF)、炎症CAF(炎症CAF,iCAF)并提示呈CAF(抗原提呈CAF,apCAF)[4]。CAF继承了独特的细胞状态和多种介导机制的肿瘤促功能,成为分析TME在化疗中发挥中作用的重要靶点[5]。iCAF作为CAF的细胞亚型,通过产生细胞因子等物质参与的肿瘤环境过程[6]。然而,iCAF对CRC相关的影响尚待确定。本研究以iCAF无血清培养抚育iCAF如何进行免疫调节因子,再以iCAF条件培养基(iCAF条件培养基,iCAF-CM)刺激CRC细胞,探讨iCAF与CRC细胞的关系。
1 材料和方法
1.1 材料
1.1.1 细胞系
人导管癌RKO细胞、HCT116细胞购自美国典型培养物保藏中心(American Type Culture Collection,ATCC)细胞库,人肠成纤维细胞(人肠成纤维细胞,HIF)购自美国ScienCell Research,CRC组织来源的CAF是从患者CRC(于2022年8月—2022年9月在上海中医药大学附属普陀医院经手术切除)的癌组织中分离得到的。细胞培养条件为37℃、CO 2体积分数为5%。组织标本的使用均征得患者知情同意。本研究获得上海中医药大学附属普陀医院伦理委员会批准[伦理批件编号:PTEC-A-2023-5(S)-1]。
1.1.2 试剂
DMEM培养基、RPMI-1640培养基、双抗、胰酶均购自美国Gibco公司,上样缓冲液、RIPA溶液液均购自美国CST公司,细胞计数试剂盒-8(cellcountingkit-8, CCK-8)购自日本同仁化学研究所;Annexin Ⅴ-EGFP/PI细胞消毒检测试剂盒购自北京全式金生物技术有限公司,TritonX-100、4',6-二脒基-2-十二烷基硫酸钠(十二烷基硫酸钠,SDS)、十二烷基硫酸钠(十二烷基硫酸钠,SDS)、免疫染色固定液、细胞核蛋白抽提试剂盒均购自上海碧云天公司,实时荧光定量聚合酶链反应(实时荧光定量聚合酶链反应,RTFQ-PCR)试剂盒购自美国EZBioscience公司。
1.1.3 仪器
酶标仪、PCR仪均购自美国Thermo Fisher公司,玻璃偏振仪购自美国Bio-Rad公司,集中小组购自德国Zeiss公司,CytoFLEX流式细胞仪购自美国Beckman公司。
1.2 实验方法
1.2.1 细胞培养
分别用RPMI-1640和DMEM培养基[加入100 U/L青霉素+链霉素,10%胎牛血清(胎牛血清,FBS)]对冻存的HCT116、RKO和HIF细胞进行复苏,以1× 10 5个/cm 2进行培养,找到细胞培养箱中(37℃、CO 2体积分数为5%)。待细胞数量长至对数期时,进行传代。
1.2.2 提取原代CAF
取新鲜患者CRC组织标本,采用组织块培养法分离培养CAF。
1.2.3 免疫荧光
CAF(2×10 4)在显微镜玻片上培养过夜。用PBS洗涤2次,甲醇固定15 min,0.2% TritonX-100渗透5 min,在接下来使用5%牛血清白蛋白(牛血清白蛋白, BSA)封闭1 h后,4 ℃下一步[FAP(1∶100盐水,兔源)、径向源性生长因子受体α(血小板源性生长因子受体α,PDGFRA)(1∶500盐水,兔源) )]温育过夜,然后与二抗[山羊抗兔IgGH&L(AlexaFluor®488)]和[山羊抗兔IgGH&L(AlexaFluor®594)]温育2 h。用DAPI进行核定位评估。
1.2.4 筛选iCAF并获得iCAF-CM
从参考文献[7]可知,PDGFRA是iCAF的标志物,因此本研究采用PDGFRA作为筛选iCAF的标志物,通过免疫荧光,从CAF中筛选出高表达PDGFRA的CAF,即为iCAF。
1.2.5获得条件培养基
另外培养HIF和iCAF,当细胞生长至80%时,将细胞培养基更换为净化FBS的培养基。处理48小时后,收集悬液作为条件培养基。高速离心后收集条件培养基,用0.22 μm微孔膜过滤,于-20℃冰箱保存。
1.2.6 实验包
将肿瘤细胞分成对照组(仅加入培养基)、实验组1[加入HIF条件培养基(HIF-conditionedmedium,HIF-CM)]和实验组2(加入iCAF-CM)。每组均设置HCT116和RKO两种肿瘤细胞。
1.2.7 CCK-8法检测细胞肿瘤率
以2×10 4个/孔分别指定HCT116和RKO细胞到96孔板中培养24 h,然后分别使用奥沙利铂(oxaliplatin,OXA)和5-FU药物作用24 h,以每孔100 μL CCK -8溶液加入孔中,培养温育30分钟,于450 nm波长处检测吸光度(D)值。实验重复3次,取主机。
1.2.8 流式细胞术检测肿瘤肿瘤率
各组中的1/2半数抑制浓度(半数抑制浓度,IC 50)作为荧光染料的药物浓度,制剂选择24 h后,使用Annexin Ⅴ/PI双染法检测细胞,根据两个种染料不同的激发波长,分别使用流式细胞仪所带的异硫氰酸荧光素(异硫氰酸荧光素,FITC)和PE通道对样品进行检验。
1.2.9 蛋白质印迹法(Western blot)检测caspase-3、Bcl-2、Bcl-xL和survivin蛋白水平
分别用HIF-CM和iCAF-CM对肿瘤细胞进行刺激。48小时后,用朝鲜IC50浓度的OXA和5-FU分别对肿瘤细胞进行处理。24小时后,PBS冲洗且在冰上通道后, 4℃超速离心,提取上清液,定量。沸腾水中煮5分钟,经SDS-酰胺酰胺凝胶(聚丙烯酰胺凝胶电泳,PAGE)凝胶分离,转移到聚偏二氟乙烯(聚偏二氟乙烯, PVDF)膜上,在5%脱脂奶粉中封闭1.5 h后加入一抗鼠抗β-actin(1∶5 000)、兔抗caspase-3(1∶1 000)、鼠抗Bcl-2(1∶1 000)、鼠抗Bcl-2(1∶5 000) 1 000)、兔抗Bcl-xL(1∶1 000)、兔抗survivin(1∶500)于4 ℃摇床温育过夜,用含吐温-20三乙醇胺缓冲盐溶液(tris-buffered saline Tween) ,TBST)漂洗后,加入辣根过氧化物酶(辣根过氧化物酶,HRP)标记的山羊抗鼠免疫球蛋白G(免疫球蛋白G,IgG)(1∶20 000)和山羊抗兔IgG(1∶20 000) )之前温育1 h,另外用TBST漂洗,采用电化学发光(ECL)法,在微波成像系统中曝光检测,用Image J软件对Western blot结果进行定量分析。
1.2.10 利用RTFQ-PCR法检测caspase-3、Bcl-2、Bcl-xL和survivin的mRNA表达水平
透析液中细胞后,使用快速RNA提取试剂盒提取细胞总RNA,反转录合成cDNA,然后用RTFQ-PCR检测caspase-3、Bcl-2、Bcl-xL和survivin的mRNA表达,满足条件为:95℃预变性5min进入循环,95℃变性45s,54℃退火45s,72℃1min,共30个循环,72℃延伸5min,以β-actin为内参基因。用2- ΔΔ Ct法计算目的基因的表达量,Δ Ct = Ct目的基因-Ct 内参基因。引物设计时,β-actin的上游引物序列为5'-CCC AGCACAATGAAGATCAAGATCAT-3',下游引物序列为5'-ATCTGCTGGAAGGTGGACAG CGA -3' ;Caspase -3的上游引物序列为5'-CCAAAGATCATACATGGAAGCG-3',下游引物序列为5'-CTGAATGTTTCCCTGAGGTTTG-3';Bcl -2的上游引物序列为5'-GACTTCGCCGAGATG TCCAG-3',下游引物序列为5'-GAACT CAAAGAAGGCCACAATC-3';Bcl-xL的上游引物序列为5'-GCATATCAGAGCTTT GAACAGG-3',下游引物序列为5'-GAAGGAGAAAAAGGC CACAATG-3';Survivin的上游引物序列为5'-CCGCATCTTCTACATTCAAGAAC-3',下游引物序列为5'-CTCCTTGAAGCAGAAGAAACAC-3'。
1.2.11通过Western blot观察iCAF对Wnt/β-catenin信号转导的影响
采用条件培养基和磁场IC 50浓度的OXA和5-FU处理细胞,使用细胞核蛋白抽提试剂盒提取核内蛋白。采用Western blot检测肿瘤细胞总蛋白的表达水平以及细胞核中β-catenin和Lamin B1蛋白的表达水平。
1.3 统计学处理
数据用GraphPad Prism 7和SPSS 25.0软件进行统计分析。实验结果用x±s表示,用单因素方差分析(one-way ANOVA)和Tukey's多重比较检验进行组间比较,P<0.05为差异有统计学意义。
2 结果
2.1代CAF提取及亚原型鉴定
首先利用CRC组织标本提取原代CAF,对细胞株命名为CAF-71和CAF-95。镜下观察其形态呈长梭形(图1)。提取的原代细胞表达CAF常见表面标志物FAP和PDGFRA,表明提取的原代细胞是成纤维细胞,其中CAF-95对PDGFRA高表达,为iCAF,因此采用CAF-95细胞进行培养并获得条件培养基(95-CM),便于后续实验的进行。
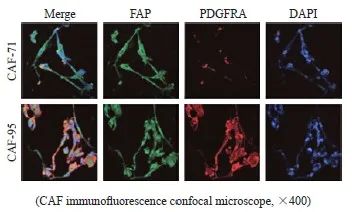
图1 原代CAF验证及筛选
图1 初级CAF验证和筛选
2.2 CRC细胞的IC 50升高
随着OXA和5-FU药物浓度的上升,HCT116细胞和RKO细胞的死亡率不断下降。结果显示,HCT116中,素描OXA的IC 50为10.701 4 μmol/L,HIF-CM组OXA的IC 50为12.972 2 μmol/L,95-CM组OXA的IC50为30.380 4 μmol/L,差异有统计学意义(P<0.000 1);RKO细胞中,素描OXA的IC50为29.785 5 μmol/L,HIF -CM组OXA的IC 50为32.536 8 μmol/L,95-CM组OXA的IC 50为55.690 8 μmol/L,差异具有统计学意义(P<0.000 1)。HCT116细胞中,中部5-FU的IC 50为87.531 2 μmol/L,HIF-CM组5-FU的IC 50为86.861 9 μmol/L,95-CM组5-FU的IC 50为135.781 0 μmol/L,差异具有统计学意义(P<0.01);RKO细胞中,化妆品5-FU的IC 50为18.235 5 μmol/L,HIF-CM组5-FU的IC 50为21.732 0 μmol/L,95-CM组5-FU的IC 50为21.732 0 μmol/L 50为36.817 9 μmol/L,差异有统计学意义(P <0.001,图2)。95-CM培养后,HCT116和RKO细胞对OXA和5-FU的IC50明显升高,发病率升高,说明经iCAF刺激后,CRC细胞可能产生了产品。
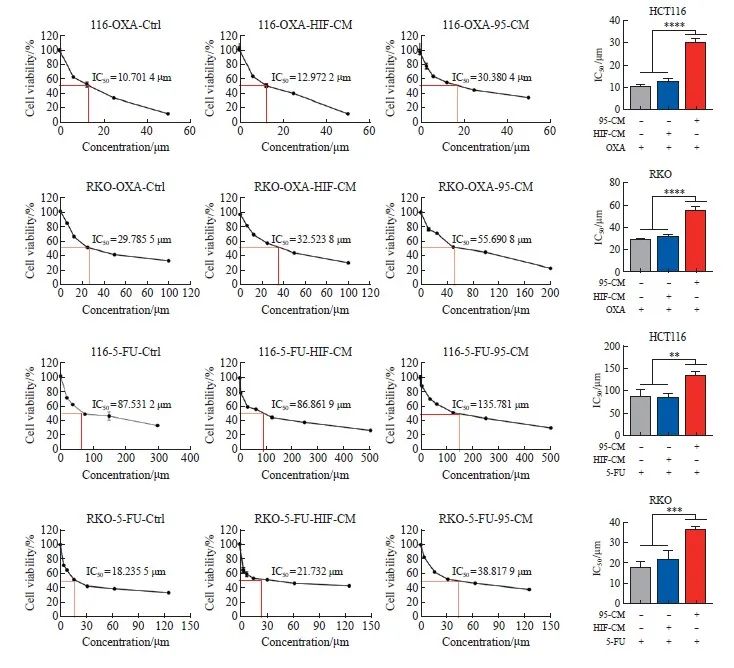
图2 CCK-8检测加入95-CM对照细胞的肿瘤发生率变化
图2 CCK-8检测经95-CM处理或未经95-CM处理的肿瘤细胞的细胞活力
**:P<0.01,与对照组(Ctrl)和HIF-CM组相比;***:P<0.001,与对照组(Ctrl)和HIF-CM组相比;****:与对照组(Ctrl)和HIF-CM组相比,P <0.000 1。
2.3 iCAF 抑制 CRC 细胞
两种杏仁在两种抗肿瘤药物的各自作用下,首先出现在模具和HIF-CM组中,95-CM组中的细胞水平明显下降(图3)。
为了验证以上结果,我们进一步检测了iCAF刺激的肿瘤细胞中的大豆蛋白与抗大豆蛋白的表达水平变化(图4)。与心脏和HIF-CM组相比,95-CM组中,图片凋亡蛋白caspase-3的表达水平明显下降,而抗表达蛋白Bcl-2、Bcl-xL和survivin的表达水平均有所上升(P <0.05)。采用RTFQ-PCR检测多种蛋白的mRNA所得结果与Western blot一致,差异具有统计学意义(P<0.05,图5)。上述结果说明经iCAF刺激后,肿瘤细胞的筛查,充分证明iCAF能够介导CRC细胞导入。

图3 流式细胞术检测加入95-CM对照肿瘤细胞的水平变化
图3 流式细胞术检测经或未经95-CM处理的肿瘤细胞凋亡率
**:P<0.01,与对照组(Ctrl)和HIF-CM组相比;***:与对照组(Ctrl)和HIF-CM组相比,P <0.001。
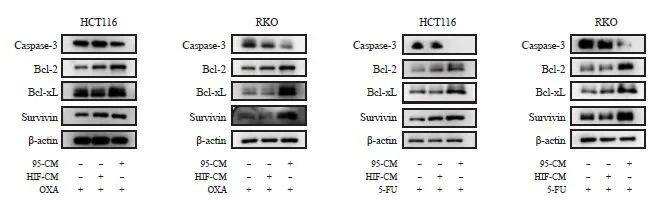
图4 Western blot检测β-actin、caspase-3、Bcl-2、Bcl-xL和survivin的表达
图4 Western blot检测β-actin、caspase-3、Bcl-2、Bcl-xL、survivin表达情况
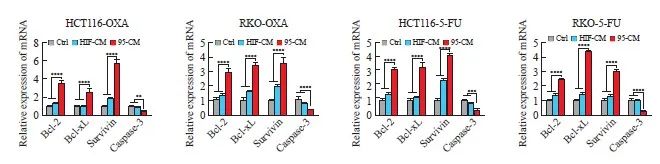
图5 RTFQ-PCR检测caspase-3、Bcl-2、Bcl-xL和survivin的mRNA水平
图5 RTFQ-PCR检测caspase-3、Bcl-2、Bcl-xL和survivin mRNA表达情况
**:P<0.01,与对照组(Ctrl)和HIF-CM组相比;***:P<0.001,与对照组(Ctrl)和HIF-CM组相比;****:与对照组(Ctrl)和HIF-CM组相比,P <0.000 1。
2.4 iCAF激活Wnt/β-catenin信号转导支持
本研究进一步探索了Wnt/β-catenin信号转导的变化。结果显示,3组肿瘤细胞内β-catenin蛋白的表达水平相比较,总蛋白未见明显差异,核内蛋白表达产生明显差异(P<0.05,图6)。从上图中可以看出,95-CM组中,β-catenin发生转移,在β-catenin总蛋白不变的情况下,细胞核中的β-catenin增多,说明经iCAF刺激后,Wnt/β-catenin信号转导被激活,从而导致CRC细胞的产生。
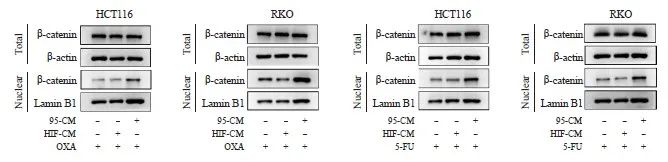
图6 经95-CM刺激后CRC细胞内Wnt/β-catenin信号转导载体的表达变化
图6 95-CM刺激CRC细胞Wnt/β-catenin信号通路的变化
3 讨论
CRC发病率在恶性肿瘤中重高居第3位,病死率高居第2位[8]。
近来,TME在肿瘤中的作用逐渐引起人们重视并被广泛研究[9]。其中,CAF是TME的重要组成部分,在肿瘤中发挥重要作用[10] 。CAF可以通过多种方式发挥重要作用[10] 。途径介导肿瘤细胞成分[11]:①抑制肿瘤细胞窗口;②肿瘤细胞外基质;③促进细胞上皮间质转化(上皮间质转化,EMT);④免疫驱动抑制;⑤增强肿瘤利用;⑥ 调控肿瘤干细胞。
本研究通过免疫荧光,从原代CAF中筛选出iCAF即CAF-95后,使用95-CM刺激CRC细胞,运用CCK-8法检测到经刺激后,CRC细胞抗癌药物OXA作用的死亡率本研究进一步发现,经CAF-95刺激后,抗氧化剂caspase-3及其mRNA的水平明显上升,抗氧化剂Bcl-2、Bcl-xL和survivin及其mRNA的水平均出现上升,确认iCAF能够促进CRC引入。
Wnt/β-catenin信号转导染料对细胞的肿瘤荧光有一定作用,同时也参与EMT的过程。有研究[12]发现,CAF激活Wnt/β-catenin信号转导染料,通过荧光细胞因子转导调节1和含F框WD重复域蛋白7阻滞线粒体,增强CRC细胞抗癌剂5-FU的增强性。另外有研究[13]发现,与对照组相比,CAF上清液培养的肺癌E-诱导表达蛋白的表达水平邻近,且CAF的CXCL12可以激活肿瘤细胞中的CXCR4/Wnt/β-catenin信号转导诱导EMT,导致顺铂抗性增强。
Wnt/β-catenin信号转导在多种肿瘤中均被高度激活,有许多对癌症具有潜在治疗效果的Wnt信号转导互补药物的研究激发[14]。有研究[15]显示,Wnt/β-catenin信号转导在CRC间质的CAF中高表达。我们因此推测iCAF介导CRC细胞可能与Wnt/β-catenin信号转导完全有关。本研究通过Western blot对95- CM刺激下的CRC细胞内β-catenin表达进行检测,观察到细胞质中β-catenin减少,细胞进入核增加,Wnt/β-catenin信号转导不能被激活,参与了整个过程。
本研究仍存在一定的局限性。首先,CAF具有异质性,不同表型具有不同的功能,本研究仅研究iCAF对CRC的影响,但CAF的其他表型(如myCAF)也是否具备同样具备其次,本研究论证了iCAF通过激活Wnt/β-catenin信号转导恭促进一系列的圣诞老人的变化,从而介导CRC以此,研究还不够深入,具体机制待探索。之后的研究可重点放在Wnt/β-catenin信号转导如何参与这一过程,如发现可能的结合位点和转运蛋白上。另外,Wnt信号转导与癌症发生密切相关,但既往研究[14]表明,Bublic Wnt信号往往会伴随着不良反应的发生,如组织破坏和再生等。
综上所述,iCAF可能是通过Wnt/β-catenin信号转导阻断肿瘤细胞的炎症,并促进细胞的EMT过程,进而诱导CRC细胞参与。因此未来将iCAF视作设计抗癌药物的潜在靶点。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1]周昌明,王泽洲,郑莹. 2023年美国癌症数据解读及对中国癌症防治的启示[J]. 中国癌症杂志, 2023, 33(2): 117-125.
周春明, 王志忠, 郑勇. 2023年美国癌症统计数据解读及其对我国癌症防治的启示[J]. 中国肿瘤, 2023, 33(2): 117-125..
[2]NIKOLAOU M,PAVLOPOULOU A,GEORGAKILAS AG,等。癌症治疗中耐药性的挑战:现状综述[J]. 临床实验转移,2018,35(4):309-318。
[3]孙勇.肿瘤微环境与癌症治疗耐药[J]. 癌症通讯,2016,380(1):205-215。
[4]ELYADA E,BOLISETTY M,LAISE P,等。胰腺导管腺癌跨物种单细胞分析揭示抗原呈递癌相关成纤维细胞[J]. 癌症发现,2019,9(8):1102-1123。
[5]BU LK,BABA H,YASUDA T,等。癌症相关成纤维细胞调节耐药性的功能多样性[J].癌症科学, 2020, 111(10): 3468-3477.
[6]YOSHIDA G J.异质性癌症相关成纤维细胞的调控:激活信号通路的分子病理学[J]. 实验临床癌症研究杂志,2020,39(1):112。
[7]陈志,周丽君,刘丽丽,等。单细胞RNA测序揭示炎性癌相关成纤维细胞在膀胱尿路上皮癌中的作用[J]. 自然通讯,2020,11(1):5077。
[8]SUNG H,FERLAY J,SIEGEL RL,等。2020年全球癌症统计:GLOBOCAN估计全球185个国家36种癌症的发病率和死亡率[J]. 加州癌症临床杂志, 2021, 71(3): 209-249。
[9]KADEL D,张Y,孙HR,等。癌症相关成纤维细胞耐药性的研究现状:潜在机制与未来策略[J]. 细胞生物学毒理学, 2019, 35(5): 407-421.
[10]SAHAI E,ASTSATUROV I,CUKIERMAN E,等。推进我们对癌症相关成纤维细胞认识的框架[J]. 癌症杂志,2020,20(3):174-186。
[11]李学勤,徐克. 肿瘤相关纤维细胞促进肿瘤最小转移的作用机制[J].王志强, 王志强, 王志强, 王文. 中国生物化学与分子生物学报, 2019, 35(4): 386-392.
李新庆,徐坤. 癌相关成纤维细胞促进肿瘤转移和侵袭的机制[J]. 生化分子生物学杂志, 2019, 35(4): 386-392.
[12]胡金良,王伟,兰新林,等。CAFs分泌的外泌体通过增强结直肠癌细胞干性和上皮间质转化促进转移和化疗耐药[J]. 摩尔癌症,2019,18(1):91。
[13]张峰,崔金玉,高华富,等。癌相关成纤维细胞通过CXCL12/CXCR4轴诱导卵巢癌上皮间质转化及顺铂耐药[J]. 未来Oncol, 2020, 16(32): 2619-2633。
[14]JUNG YS,PARK J I.癌症中的Wnt信号传导:超越β-连环蛋白和破坏复合物的Wnt信号传导治疗靶向[J]。实验分子医学, 2020, 52(2): 183-191.
[15]FERRARI N,RANFTL R,CHICHEROVA I,等。Dickkopf-3 连接 HSF1 和 YAP/TAZ 信号控制癌症相关成纤维细胞的攻击行为[J]. 自然通讯,2019,10(1):130。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#结直肠癌# #炎性癌症相关成纤维细胞# #Wnt/β-连环蛋白信号通路#
61