ADC药物管线成功的关键指标
2023-02-06 小药说药 小药说药 发表于安徽省
在过去的几十年里,靶标选择、连接子稳定性和有效载荷毒性一直是ADC药物设计的主要考量。然而即便如此,由于毒性和/或治疗窗口不佳,许多在临床前研究中看起来很有前途的ADC最终在临床试验中失败。
前言
抗体药物偶联物(ADC)疗法近几十年来发展迅速,目前全球已有14种产品获得批准,140多种ADC正在临床试验中。到2030年,ADC市场将达到150亿美元以上。ADC的基本原理:通过将单克隆抗体的特异性与有效小分子药物的细胞毒性相结合,ADC可以精确地向肿瘤输送毒素。
然而,尽管FDA已经批准了多种ADC药物,但在临床开发过程中,ADC的失败率仍然很高。ADC固有的复杂性是一把双刃剑,它为提供更好的治疗提供了机会,同时也增加了治疗失败的混杂因素。ADC设计驱动其药代动力学和药效学,并且需要比常用的Cmax和曲线下面积(AUC)指标更深入的分析,以获得最佳剂量应用到临床。目前FDA批准的靶向实体肿瘤的ADC具有一些共同特征,包括人源化IgG1抗体结构域、高表达肿瘤受体和大剂量抗体。这些共同特征对于临床药代动力学和作用机制具有潜在影响,并为所有临床开发阶段的ADC设计提供了参考。
最近批准的ADC遵循的3个设计标准
最近批准的三种实体瘤ADC强调了重要的设计标准。尽管ADC的几个组件显示出显著的不同,但其共有特性值得注意。FDA批准的四种用于实体瘤ADC的结构非常不同,包括不同的连接子类型(可裂解与不可裂解、不同的释放机制、不同的稳定性)、特异性和非特异性结合、不同的靶点、癌症类型和药物抗体比(DAR)。有趣的是,这些ADC具有三个共同特征:(i)高表达靶点(105–106个受体/细胞),(ii)高抗体剂量(3周内3.6 mg/kg或更大剂量),以及(iii)IgG1同种型抗体骨架
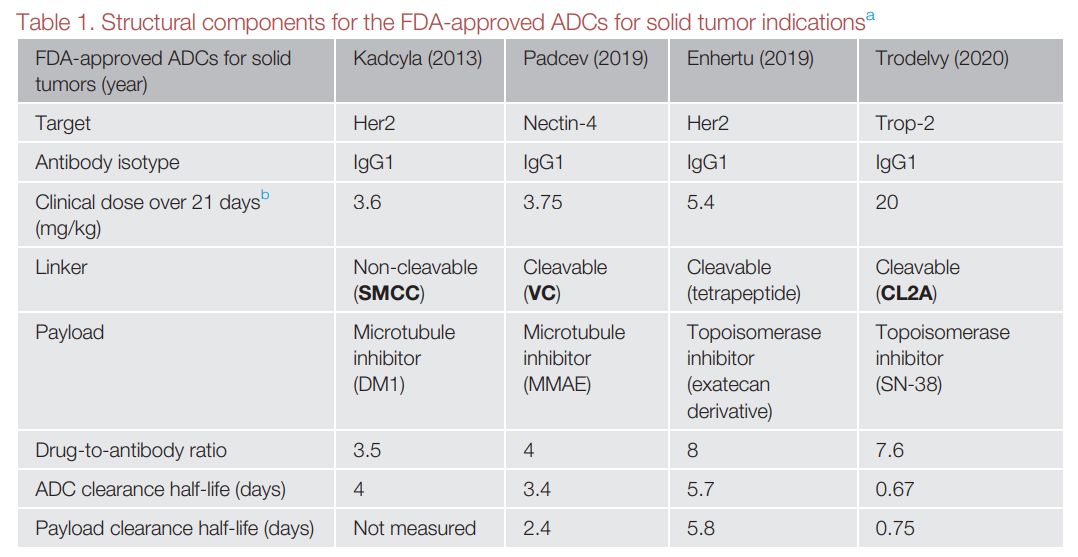
这三个共同特点对药物的递送和分配有重大影响。事实上,由于ADC使用已知的细胞毒性有效载荷(如微管抑制剂)和已知的靶向抗体,因此其临床成功的一个关键特征就是递送——以可耐受的剂量靶向每个肿瘤细胞的有效载荷。这些共有的设计特征对有效载荷的肿瘤靶向递送具有各自的影响。
高表达靶点
HER2、Nectin-4和Trop-2是高表达的肿瘤抗原,每个肿瘤细胞有超过105个受体,在健康组织中的表达显著降低。由于巨大的表达差异,高表达靶点可以提供更大的治疗窗口。因为药物递送到健康组织通常比递送到肿瘤更有效,高抗体剂量和高表达肿瘤靶点可以快速饱和低表达健康组织中的摄取,同时仍然最大化肿瘤的摄取。然后可以修改有效载荷毒性和/或DAR以确保以高于治疗阈值递送至肿瘤细胞,同时保持健康组织中的亚治疗阈值(以避免靶向介导的健康组织毒性)。相比之下,靶向表达较低的肿瘤抗原需要更有效的有效载荷才能在靶向细胞中达到治疗浓度。增加有效载荷效力通常会导致更高的毒性,降低ADC耐受剂量。而较低的ADC剂量会减少肿瘤摄取,但可能不会以相同的量减少健康组织摄取(例如,如果靶向介导的健康组织摄取保持饱和),从而可能降低治疗指数。值得注意的是,这种权衡与小分子药物非常不同,小分子药物通常与血浆浓度平衡,因此低剂量会导致健康组织的暴露量降低。与小分子形成鲜明对比的是,低剂量更有效的ADC可以限制肿瘤的渗透,从而降低疗效而不是毒性。
高抗体剂量
开发针对实体瘤的ADC具有很大难度,因为实体肿瘤的血管渗漏、弯曲和淋巴引流不良,导致对流不畅和间质压力升高。这些特征结合在一起,形成了递送ADC药物的不利环境。增加抗体递送和组织渗透的最直接方法是给予更高剂量的抗体,这是当前批准的ADC之间的第二个共有特征。
Kadcyla是多年来第一个获得FDA批准用于实体瘤的ADC,2013年通过使用人IgG1骨架、中等DAR(3.5)、不可裂解连接子和强效微管抑制剂获得了FDA批准。目前的许多针对实体瘤的ADC在3周内比Kadcyla具有更高的剂量(3.75-20mg/kg),显著超过许多经批准的针对血液瘤的ADC(例如,Besponsa和Zynlonta的剂量分别为约0.02和0.15 mg/kg)。这些剂量是克服高表达和有效内化所必需,从而将有效载荷递送到细胞。
其他设计标准
有效载荷的选择对于ADC开发至关重要。如今,大多数有效载荷属于三类之一:(i)DNA损伤诱导剂、(ii)微管抑制剂和(iii)拓扑异构酶抑制剂。DNA损伤有效载荷通常是非常有效的(如PBD),而微管(DM4,MMAE)和拓扑异构酶(exatecan,SN-38)抑制剂则更温和。确定最佳有效载荷需要逐一分析。较低的有效载荷提供更大的最大耐受剂量(MTD)。然而,对于抗原呈递量较低的适应症,有效载荷的递送量可能不会超过治疗阈值,因此需要更高效力的有效载荷。除了效力外,最近的研究还确定了多种有效载荷是免疫原性细胞死亡(ICD)的诱导剂。一些有效载荷在细胞死亡后引起免疫反应的能力是一种新的研究途径,可能会对下一代ADC有效载荷选择产生广泛影响。
连接子的选择也非常关键,不可裂解连接子在血浆中通常更稳定。目前,连接子化学也取得了显著的进步。例如,Kadcyla不可裂解连接子在4天内损失18.4%的有效载荷,而Enhertu可裂解连接子在21天内损失2.1%的有效载荷。然而,即使连接子可以减少循环中的ADC有效载荷损失,在ADC自身的全身吸收和降解之后,也会遇到更困难的挑战。由于大多数ADC剂量未到达肿瘤,ADC将在体内其他地方代谢,在不希望的位置释放有效载荷。有效载荷、连接子和结合位点都可以影响体内发生非特异性释放的位置和剂量限制毒性(DLT)。
目前FDA批准的药物在这些设计特征中表现出明显的可变性,表明需要针对其特定靶点个性化设计ADC。然而,高剂量抗体和高表达靶点的相似性,结合临床前证据表明,组织渗透和肿瘤饱和度是实体瘤疗效的关键组成部分。因此,我们需要超越Cmax和AUC,考虑肿瘤组织渗透和肿瘤饱和度,以设计下一代ADC。
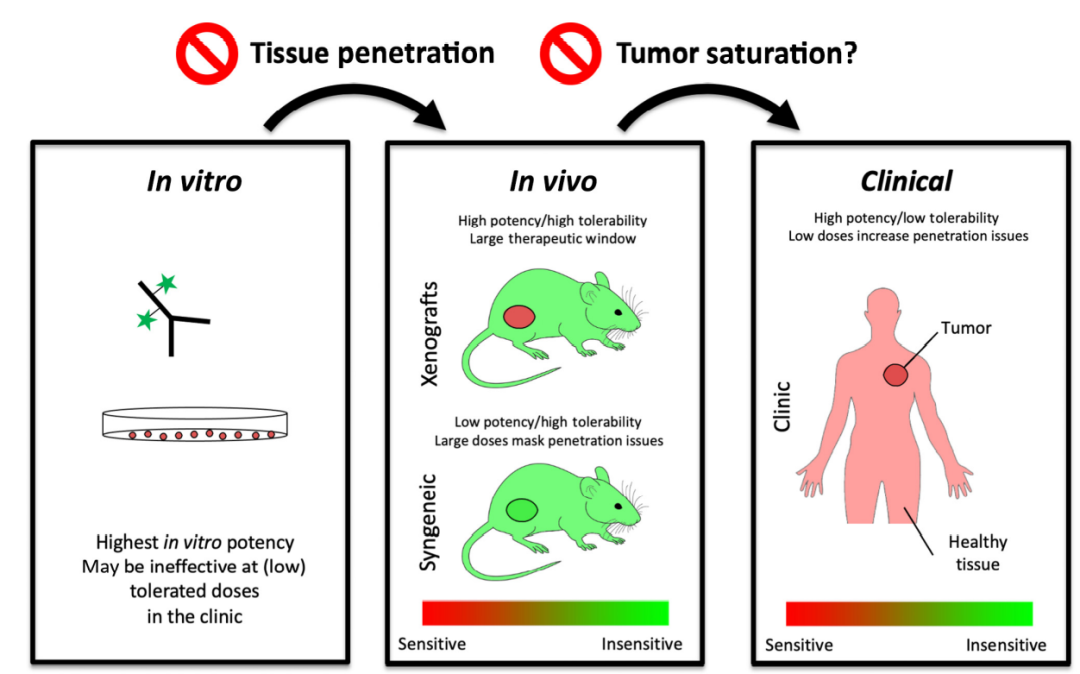 肿瘤渗透性
肿瘤渗透性
全身药代动力学、毒性和疗效是药物开发过程中测量的关键指标。毒性和药代动力学可以在早期快速筛除掉一些不好的候选药物。相比之下,测试疗效需要更大的努力,组织渗透在这个过程中发挥重要作用。
影响疗效的肿瘤组织渗透性不能单独考虑,毒性同样重要。例如,在临床剂量为3.6mg/kg的情况下,43.1%的Kadcyla治疗患者显示出≥3级的不良反应。研究者正在研究使用ADC的替代给药方法,以潜在地增加耐受性,如分批次给药。然而,当审查单次给药与分批次给药的Kadcyla疗效时,分批次给药的临床益处降低。因此,减少给药剂量和增加频率可能更容易耐受,但较小的剂量通常会导致较低的血浆浓度、降低的肿瘤穿透力和较低的肿瘤细胞靶向。
肿瘤饱和度
另一个关键的方面是肿瘤饱和度。这取决于多种条件,包括剂量(Cmax)、表达(受体/细胞)、内化率和血浆清除率等。肿瘤饱和度的重要性体现在两个方面:在临床前模型中使用饱和剂量的可能性更大;而饱和剂量与亚饱和剂量的结果可能相反。首先,给予小鼠的剂量并不总是与临床耐受剂量相对应。有时会增加剂量,以应对小鼠体内更快的清除率或反应较低的肿瘤模型,或者因为它们在小鼠体内的耐受性更好。这可能导致临床前模型中的饱和,而临床耐受剂量可能是亚饱和的。由于小鼠细胞对ADC有效载荷的反应通常不如人类细胞,需要大剂量的反应,这些大剂量可能会掩盖临床中的递送问题。
第二,饱和剂量下的临床前研究结果可能会产生与临床中的亚饱和剂量下相反的结果。例如,如果给予饱和剂量,则增加DAR更有效,而当给予过饱和剂量时,降低DAR可能更有效。通常,剂量受有效载荷毒性的限制,因此在恒定有效载荷剂量下进行比较。当肿瘤过饱和时,癌细胞接收到最大量的抗体,因此每个抗体具有更多有效载荷将产生更大的疗效。对于过饱和剂量,情况正好相反。在这种情况下,ADC不能到达所有的癌细胞,增加DAR(以恒定的有效载荷剂量)将降低所递送的抗体量,从而减少靶向和杀死的细胞数量。相反,在这些条件下降低DAR和/或增加总抗体剂量可以提高组织渗透性和总体疗效。因此,有效载荷MTD应与抗体的饱和剂量相关联,以实现最大的组织渗透和功效。
此外,最近批准的三种用于实体瘤的ADC都使用能具有旁观者效应的有效载荷。旁观者有效效应可以使有效载荷在释放后扩散出靶细胞并进入相邻细胞。理论上,旁观者有效载荷还能够提高组织穿透力,超过抗体本身所能达到的水平。这可以解释Enhertu与Kadcyla相比在NCI-N87小鼠模型中表现出的疗效增加,尽管细胞效力相似。然而,即使在使用具有旁观者有效载荷的ADC时,较高抗体剂量增加的组织渗透仍会提高疗效。尽管旁观者有效载荷可以改善分布,但抗体直接递送的效率高于旁观者杀伤,这解释了即使有旁观者有效载荷,较高的抗体剂量也会产生更大的效果。
小结
在过去的几十年里,靶标选择、连接子稳定性和有效载荷毒性一直是ADC药物设计的主要考量。然而即便如此,由于毒性和/或治疗窗口不佳,许多在临床前研究中看起来很有前途的ADC最终在临床试验中失败。
通过分析最近FDA批准的ADC药物的共有特征,可以发现组织渗透和肿瘤饱和度同样是ADC成功设计的关键。因此,在临床前研究中需要特别关注有关疗效最重要参数的数据,包括肿瘤渗透和饱和度。在一个理想的设计方案中,至少有两条信息是已知的:人体内可耐受的有效载荷剂量和使肿瘤靶点饱和所需的抗体剂量。有了这些信息,我们就可以通过修改DAR来为所有肿瘤细胞提供最高耐受量的有效载荷,从而在临床耐受剂量下最大限度地提高疗效。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






