Cell子刊:解释为何HIV不被免疫系统清除
2016-04-20 生物谷 梅斯医学
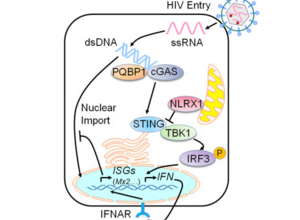
在一项新的研究中,来自美国北卡罗来纳大学(UNC)医学院和桑福德-伯纳姆-普利贝斯医学探索研究所(Sanford Burnham Prebys Medical Discovery Institute, SBP)的研究人员鉴定出人(宿主)蛋白削弱人体对HIV和其他病毒作出的免疫反应。这一发现对改变HIV抗病毒疗法、构建有效的病毒疫苗和开发治疗癌症的新方法产生重要影响。相关研究结果发表在2016年

Haitao Guo13, Renate König13, Meng Deng, Maximilian Riess,et al,NLRX1 Sequesters STING to Negatively Regulate the Interferon Response, Thereby Facilitating the Replication of HIV-1 and DNA Viruses,cell,2016
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#Cell#
58
#CEL#
65