术后MRD监测为啥要先同时检测肿瘤组织+对照白细胞?这项研究回答你
2023-12-08 苏州绘真医学 苏州绘真医学 发表于上海
本研究结果表明,肿瘤DNA和配对WBC测序,不仅可以扩大符合血浆MRD监测条件的患者群体,还可以降低假阳性率。
在局限性结肠癌(CC)中,血浆循环肿瘤 DNA(ctDNA)监测显示出检测微小残留病灶(MRD)和预测较高复发风险的潜力。然而,使用仅肿瘤测序方法,体细胞变异可能会被误识别为胚系变异,导致多达 11% 的患者由于缺乏已知的体细胞突变,无法进行跟踪。本研究评估了在肿瘤组织测序中添加白细胞(WBC)以提高测序结果准确性的潜在价值。前瞻性纳入了 148 例诊断为局限性 CC 的患者。使用 29 基因panel,对肿瘤组织、血浆和相应的WBC进行测序。对术后血浆样本进行微滴式数字 PCR 和基于扩增子的 NGS 检测,跟踪 MRD。通过查询 COSMIC、OncoKB 和内部致病性突变数据库来鉴定致癌体细胞变异。进行变异优先级分析,主要是将致癌突变与OncoKB证据水平相匹配,来选择特定的靶向治疗。使用配对的肿瘤和WBC测序,在所有患者(100%)中识别了体细胞突变,而仅使用肿瘤组织则为89%。血浆监测的突变频率最高的10个基因发生变化。WBC测序发现9%的患者携带胚系致病性突变,其中APC和TP53突变最常见。此外,27%的患者存在潜能未定的克隆造血相关基因突变,其中TP53、KRAS和KMT2C突变最常见。使用ddPCR或基于扩增子的NGS监测MRD的灵敏度没有差异(p = 1)。41%的患者在诊断时具有潜在可靶向变异。胚系检测方法不仅改善了测序结果,提高了符合血浆监测条件的患者比例,还揭示了致病性胚系变异的存在,有助于识别遗传性癌症综合征风险较高的患者。
研究背景
结肠癌(CC)是一种异质性疾病,是全球癌症相关死亡的第二大原因。在局限性 CC 中,手术标本的手术病理学分析可以最好地估计复发风险,指导辅助化疗(ACT)决策。然而,如果仅考虑 TNM 分期,一些患者可能会误接受 ACT,提示需要更准确的预后和预测标志物。近年来,几项研究表明,在诊断为局限性 CC 的患者中,手术后立即进行循环肿瘤 DNA(ctDNA)检测可以提供微小残留病灶(MRD)的直接证据,识别复发风险高的患者。II 期随机 DYNAMIC 研究的结果表明,ctDNA 有助于改善临床医生对可能获益于 ACT 的 II 期 CC 患者的选择,避免对未出现 ctDNA 的患者进行过度治疗。
监测MRD的最重要的问题之一是如何识别血浆中要连续跟踪的基因变异。在我们之前的研究中,高达 11% 的局限性 CC 患者由于肿瘤样本中缺乏病理性体细胞突变,无法进行血浆监测。几项研究表明,测序伪影、胚系变异和克隆造血可能会混淆对测序结果的解读,使后续疾病监测复杂化。准确检测 ctDNA 中肿瘤来源的突变需要结合集成数字错误抑制方法,如唯一分子标识、恰当的变异鉴定、多基因分析和高深度测序。此外,在许多肿瘤中,ctDNA 分数极低,可能导致∼18% 的病例假阴性。ctDNA 检测方法应具有高灵敏度和特异性。对肿瘤 DNA 和匹配的白细胞(WBC)进行测序可以过滤变异,将 ctDNA 变异与潜能未定的克隆性造血(CHIP)相关游离 DNA(cfDNA)变异区分开来,从而改善测序分析解读。本研究不仅跟踪致病性变异,还跟踪任何存在的体细胞突变,以增加血浆监测的候选基因突变数量,提高检测MRD的灵敏度。此外,这种新的胚系方法不仅能够识别CHIP相关突变,还能够识别临床相关遗传变异。
研究结果
局限性CC原发肿瘤和匹配WBC测序
对连续148例局限性CC(I-III期)患者从原发性肿瘤手术组织样本和WBC中提取的DNA在NextSeq平台进行测序,中位测序深度分别为769×和837×。使用CC 29个高频突变基因panel检测肿瘤组织体细胞突变。对于肿瘤组织检出的突变,根据在外周血中是否检出,归类为胚系突变或体细胞突变。
使用优化的内部生物信息学分析流程来降低变异鉴定的背景噪音,在所有患者中检测到体细胞突变(n = 148;图 1A)。正如预期,突变频率最高的10个基因包括APC(86.45%)、TP53(66.22%)、KRAS(45.27%)、PIK3CA(31.76%)、BRAF(23.65%)这些驱动基因。在我们之前的研究中,仅 132 例患者检出致病性突变(89.2%;中位2;范围0-6),而本研究通过添加 WBC 检测,所有患者均检出体细胞突变(中位11;范围1-234)。突变频率最高的10个基因发生变化(图1B)。
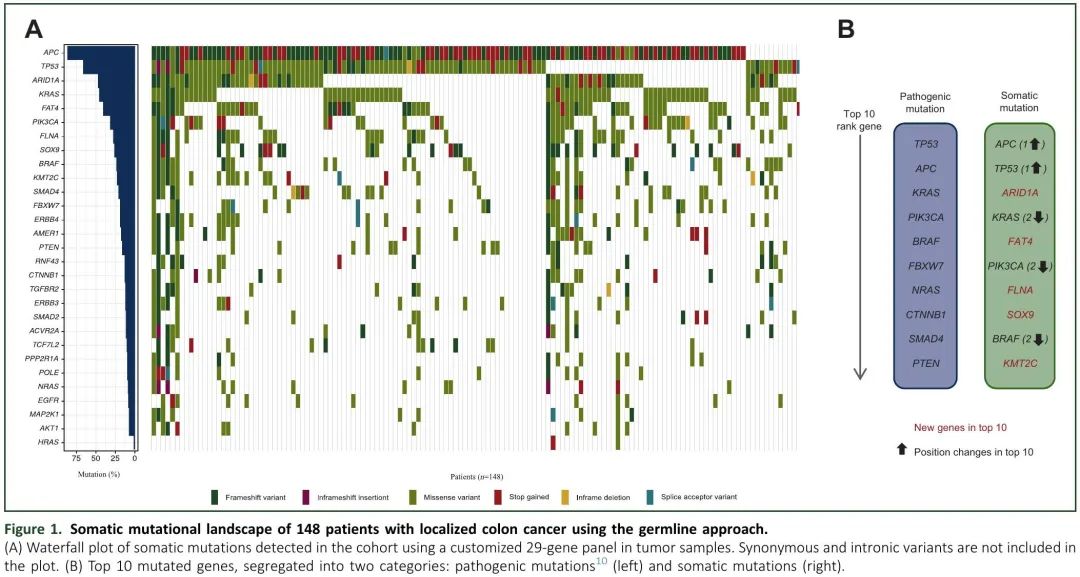
图1. 使用胚系方法,148例局限性结肠癌患者的体细胞突变谱。(A) 队列肿瘤样本29基因panel检测到的体细胞突变瀑布图;(B) 突变频率最高的10 个基因,分为两类:致病性突变(左)和体细胞突变(右)。
肿瘤组织和配对WBC测序的额外价值
监测MRD的主要问题包括如何识别要跟踪的诊断时的血浆分子变异,以及假阳性结果较常见。因此,我们评估了与依赖公共基因组数据库(仅使用肿瘤数据)相比,纳入WBC测序数据,将突变分类为体细胞或胚系变异是否准确度更高,有助于降低假阳性率。图1A和2A分别展示了胚系检测和仅肿瘤测序方法的突变检测情况。在本研究队列中,采用胚系检测和仅肿瘤检测,突变频率最高的10个基因结果有所不同。根据仅肿瘤数据,突变频率最高的基因是KMT2C(146/148,98.65%),而使用胚系检测,KMT2C的突变频率仅为23%(34/148)。分析TGFBR2突变时,也观察到类似的结果。值得注意的是,在分析仅肿瘤数据时,APC(86.49%)、TP53(68.92%)、KRAS(45.95%)和PIK3CA(31.76%)等确立的CC驱动基因较少观察到突变。此外,与胚系检测相比,分析仅肿瘤数据时,识别的体细胞突变数量显著较高(Wilcoxon 检验,P 值 = 2.2 × 10-16;图2B)。正如预期的那样,使用仅肿瘤数据时,胚系突变数目显著较低(Wilcoxon检验,P值= 2.2×10-16;图2C)。这些发现提示,进行胚系测序有助于防止错误识别重要突变,从而实现更准确的监测。
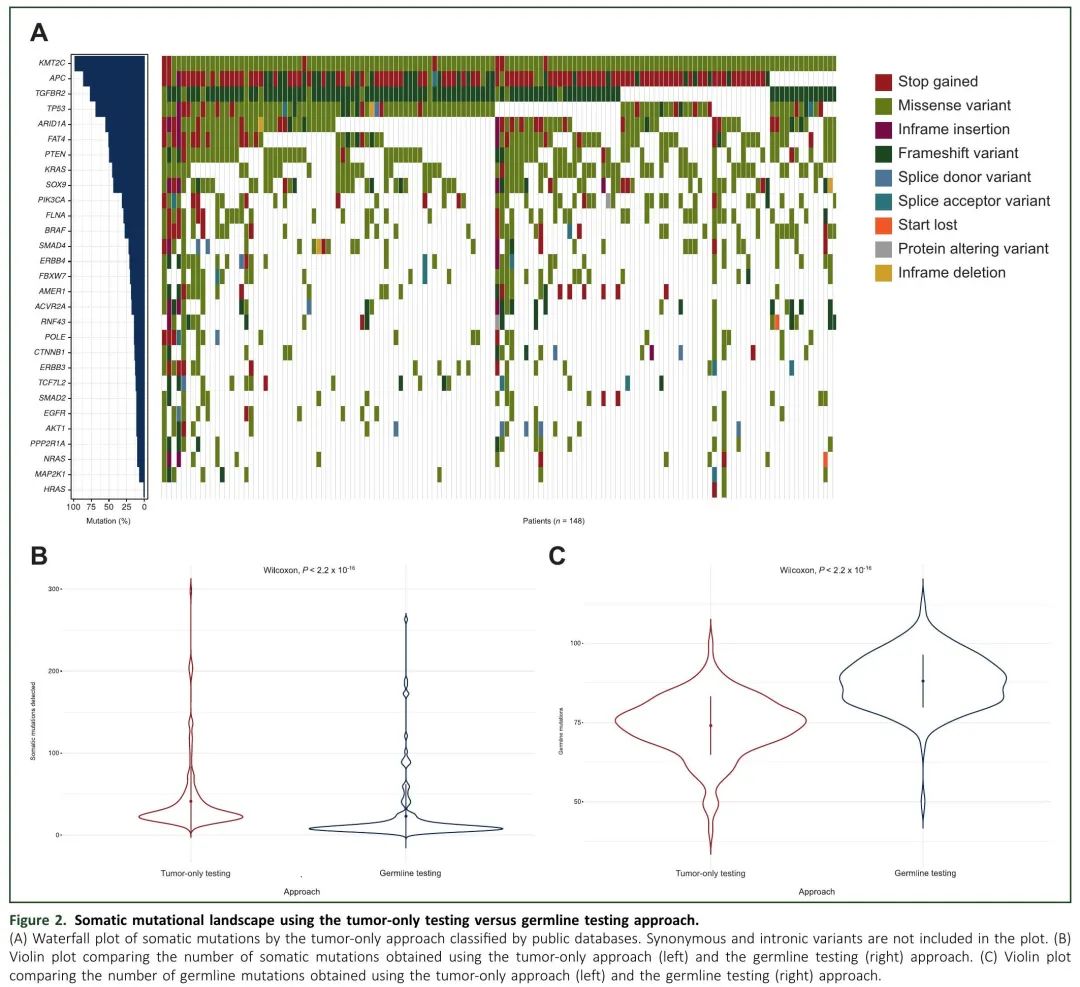
图2.使用仅肿瘤检测与胚系检测方法的体细胞突变谱。(A) 仅肿瘤方法的体细胞突变瀑布图;(B) 比较仅肿瘤方法(左)和胚系方法(右)获得的体细胞突变数量的小提琴图;(C) 比较仅肿瘤方法(左)和胚系方法(右)获得的胚系突变数量的小提琴图。
胚系变异和克隆性造血
虽然肿瘤检测的主要目的是辅助治疗决策,但也可以揭示胚系变异的存在,这对患者及其亲属都具有重要的临床意义。在本研究中,肿瘤组织和配对WBC测序使我们能够区分体细胞和胚系突变。在148例患者中,65例(43.92%)患者检测到非沉默胚系突变(图3A),其中FAT4(11.49%)、APC(9.46%)和KMT2C(6.08%)最常见。观察到5个不同的APC致病性变异,发生率为0.67%至2.68%,1个TP53变异,发生率为1.34%。在所有患者中,VAF在WBC和肿瘤中保持一致(表1)。这些发现对患者来说是值得注意的,因为可能与遗传性癌症综合征有关。
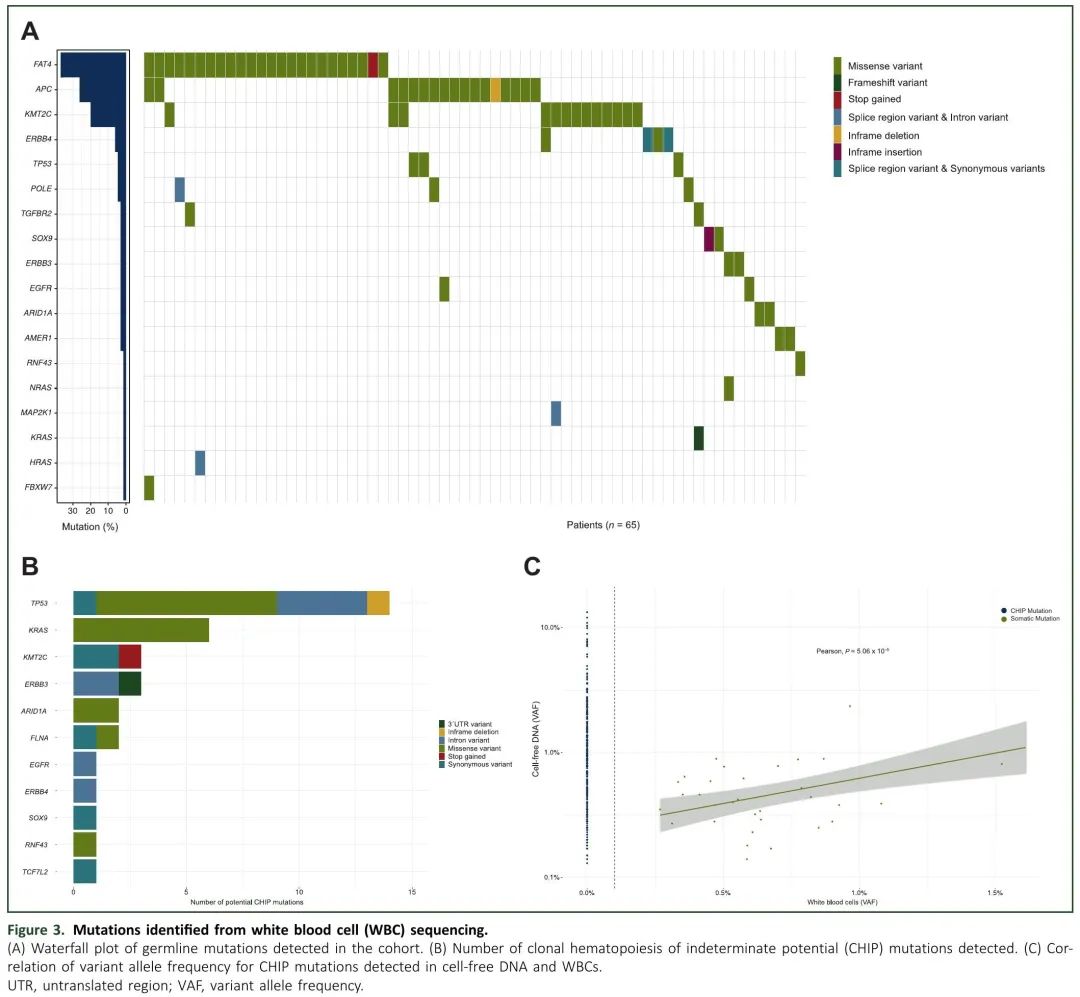
图3. 白细胞(WBC)测序识别的突变。(A) 队列检测到的胚系突变瀑布图;(B) 检测到的CHIP突变数量;(C) cfDNA和WBC检测到的CHIP突变VAF的相关性。
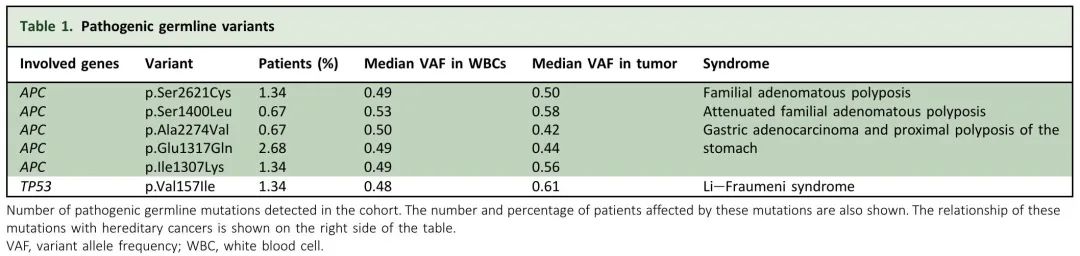
表1. 致病性胚系变异
我们队列中检测到的大多数 APC 变异(包括 p.Ser2621Cys、p.Ala2274Val 和 Glu1317Gln)在公共数据库中被列为良性,归类为罕见的胚系致病性变异。p.Ser1400Leu 和 p.Ile1307Lys 等变异(3/4例患者检出)已被确定为 CC 的主要因素。p.Val157Ile TP53 变异(2例患者检出)已在多种肿瘤类型的患者中观察到,包括肉瘤和乳腺癌,在 ClinVar 等数据库中与遗传性癌症有关。
胚系检测降低了CHIP相关突变的假阳性率。我们对118份诊断时血浆和匹配WBC样本的分析显示,27%的患者存在CHIP相关突变,其中TP53(11.02%),KRAS(5.08%)和KMT2C(2.54%)突变频率最高(图3B)。与先前的研究一致,WBC来源的 27 个变异的中位VAF为 0.62%(范围 0.26%-1.83%),与在 cfDNA 中鉴定的 CHIP 变异的中位VAF相似(中位 0.44;范围 0.14%-2.35%,P = 0.07,Wilcoxon 秩和检验)。WBC和cfDNA中CHIP相关突变水平的相关性(Pearson相关系数= 0.63)如图3C所示。
潜在可操作突变
我们分析了肿瘤组织和配对WBC测序结果,显示潜在可操作突变,随后查询了 OncoKB 来确定每个突变的分子匹配方法的证据水平(表 2)。在 148 例患者中,60 例(40.54%)具有一个或多个可操作靶点,其中 KRAS 突变频率最高(39.19%), 其次是PIK3CA(21.62%)。ARID1A(9.46%)、NRAS(6.08%)、BRAF(5.41%)和PTEN(3.38%)突变频率较低,与先前发表的研究相符。这突出了KRASG12C突变(2.7%)作为驱动因素和新药靶点的重要性。
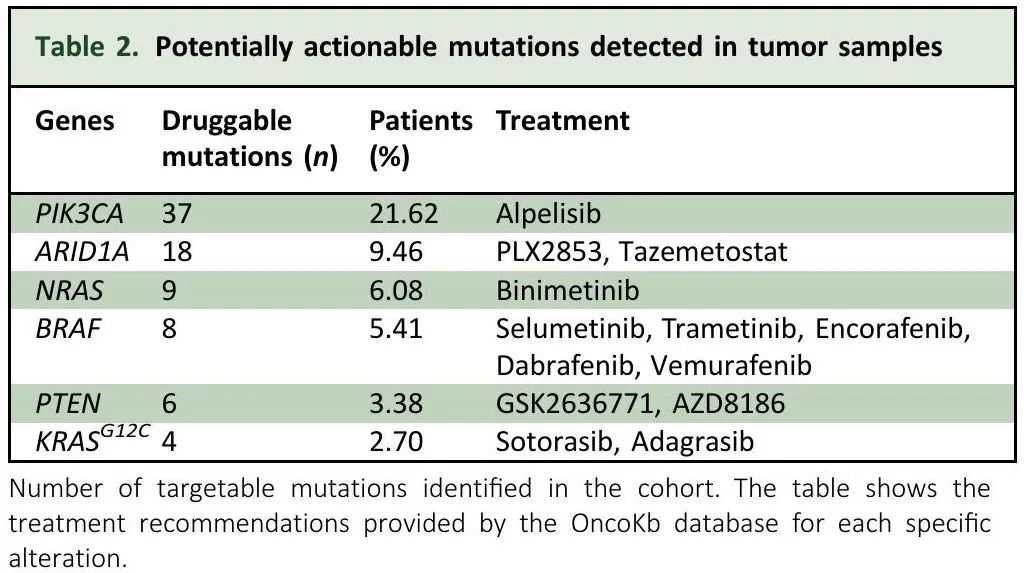
表2. 肿瘤样本检测到的潜在可操作突变
ctDNA监测,仅肿瘤变异vs添加WBC
过滤WBC变异后,所有个体血浆中都至少有一个需要跟踪的体细胞突变,相比之下,仅接受肿瘤测序的患者中只有89%。
基于患者特异性突变,使用 ddPCR,对 68 例患者进行术后 ctDNA 分析,选择2个最常见的体细胞突变,比较仅肿瘤方法和胚系方法的监测性能。尽管胚系方法使更多患者能够随访,但两种技术的性能没有显著差异(比例检验,P 值 = 0.43)。为了确定监测更多的突变(除了VAF最高的两个体细胞突变之外)是否可以提高MRD检测的准确性,评估了所有ddPCR探针可及的体细胞突变。后一种方法提高了准确性,但同样地,在术后MRD检测方面没有观察到显著差异(比例检验,P值= 0.56)。
还分析了基于扩增子的NGS能否提高MRD检测的灵敏度。然而,与ddPCR技术相比,没有观察到显著差异(比例检验,P = 1)。
讨 论
结直肠癌是重大的公共卫生问题,是全球癌症相关死亡的第二大原因。据估计,到2030 年,该癌症在50岁以下人群中的发病率将翻一番。这凸显了更准确地识别复发风险较高的患者并开发更好的辅助治疗的必要性。目前,病理分期帮助临床医生识别有复发风险的患者。~15%-30%的患者尽管接受了最佳初始治疗,仍会出现复发。
ctDNA已成为局限性CRC患者管理中一种有前途的预后标志物和潜在的预测标志物。ctDNA有各种潜在的应用,包括MRD检测,早期复发监测,分子检测和治疗反应预测。尽管如此,液体活检具有一定的局限性,如ctDNA假阳性和假阴性结果,给检测MRD带来了挑战。
本研究的目的是通过配对肿瘤组织和WBC测序,降低MRD检测的假阳性率,并识别新的变异。在我们之前的研究中,仅对原发肿瘤组织进行了测序,只有 89% 的患者在随访期间至少有一个可以跟踪的血浆突变。由于没有白细胞来确保可靠的 NGS 结果,只选择了致病性变异。结果,11%的患者缺乏可监测的血浆突变,无法进行MRD评估。相比之下,匹配的肿瘤组织和白细胞测序(以下简称胚系检测)不仅可以检测任何体细胞突变,无论是致病性还是其他突变,还可以将其与胚系突变区分开来。这种方法使所有(100%)患者血浆检测到至少一个用于监测的体细胞突变,增加了符合 MRD 跟踪条件的患者数量。
与文献一致,突变频率最高的 10 个基因包括 CC 驱动基因,如 TP53、APC、KRAS、PIK3CA 和 BRAF,无论是否仅考虑致病性变异或任何体细胞突变。然而,考虑后一个数据时,突变频率最高的 10 个基因发生变化,出现最初未识别的五个新基因(ARID1A、FAT4、FLNA、SOX9 和 KMT2C)。这表明胚系检测对于检测进一步体细胞突变的重要性。
应该注意的是,在本研究中,我们使用了CRC 29个高频突变基因panel,这种方法具有固有的局限性。为了评估该测序方法在 CC 中的理论检测灵敏度,我们确定了癌症基因组图谱数据库中,CC患者29 个分析基因中的一个或多个发生变异的比例。分析显示,435/528 例CC至少存在一个这些基因变异,因此,我们的靶向panel的灵敏度为 ∼82.4%。此外,我们队列中,所有患者诊断时都检测到至少一个突变,这与乳腺癌等其他肿瘤形成对比,在这些肿瘤中,较低的分子变异检出率减少了符合血浆监测资格的患者数量,降低了MRD检出率。此外,使用我们的CC驱动基因panel在术后立即检测ctDNA的灵敏度为53%,略低于其他检测。由于肿瘤负荷随时间推移而增加,因此在整个突变跟踪过程中,灵敏度会增加。
最近,ESMO和ASCO的两组专家推荐,检测MRD的首选方法是基于NGS的多基因检测,而不是基于ddPCR的检测。因此,我们比较了ddPCR和基于扩增子的NGS对检测MRD的灵敏度。不幸的是,使用基于扩增子的NGS没有观察到MRD准确性的改善,可能是由于分析的患者数量较少。
CHIP突变的发生率随着个体年龄的增长而增加,这些突变在高达95%的50-60岁非癌症患者中处于低水平。最初的研究主要集中在已知与血液系统恶性肿瘤相关的基因的CHIP突变,如TET2,DNMT3,JAK2和ASXL1,这些基因突变在实体瘤(如CC)中的相关性有限。随后的研究还发现了其他基因突变,包括 TP53 和 KRAS,可能导致 CC 患者检测 MRD 时出现假阳性结果。为了降低假阳性率,我们进行了配对 cfDNA 和 WBC 测序,在 27% 的患者中发现了 CHIP 相关基因突变,根据文献,其中 TP53、KRAS 和 KMT2C 是突变频率最高的基因。因此,使用WBC能够精确解读基因变异,准确检测 MRD。
胚系检测可能有遗传学意义。 在我们的队列中,9.2% 的个体携带携带 TP53 或 APC 等基因致病性或可能致病性突变,与遗传性癌症综合征有关,如李-佛美尼综合征、家族性腺瘤性息肉病、衰减型家族性腺瘤性息肉病以及胃腺癌伴近端多发息肉。
同样,使用胚系测序,可以识别可能改善MRD管理的可操作突变,与晚期患者靶向治疗试验一致。我们观察到40%的患者在诊断时具有可靶向变异,包括RAS/RAF,PI3K和WNT通路以及肿瘤抑制通路致癌突变。对于具有可操作分子变异的患者,与标准治疗相比,可能从精准治疗中获益更多。基于分子变异准确选择靶向药物可以显著改善治疗决策和整体管理,尤其是在晚期癌症患者中。
本研究使用的检测基于肿瘤知情方法。目前用于MRD评估的两种技术是肿瘤知情方法和肿瘤不知情方法。关于MRD检测灵敏度,没有关于这两种检测的比较数据,正在进行的前瞻性试验将提供更多这方面信息。
本研究结果表明,肿瘤DNA和配对WBC测序,不仅可以扩大符合血浆MRD监测条件的患者群体,还可以降低假阳性率。
参考文献:
Gimeno-Valiente F, Martín-Arana J, Tébar-Martínez R, Gambardella V, Martínez-Ciarpaglini C, García-Micó B, Martínez-Castedo B, Palomar B, García-Bartolomé M, Seguí V, Huerta M, Moro-Valdezate D, Pla-Martí V, Pérez-Santiago L, Roselló S, Roda D, Cervantes A, Tarazona N. Sequencing paired tumor DNA and white blood cells improves circulating tumor DNA tracking and detects pathogenic germline variants in localized colon cancer. ESMO Open. 2023 Nov 9;8(6):102051. doi: 10.1016/j.esmoop.2023.102051. Epub ahead of print. PMID: 37951129.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#结肠癌# #MRD监测# #微小残留病灶#
87