同济大学胡勇ACS Nano:多聚核酸适配体驱动双磷酸盐结晶制备用于直接抑制破骨和促进成骨的无载体双药纳米组装体
2024-08-08 BioMed科技 BioMed科技 发表于上海
同济大学胡勇教授课题组提出一种基于滚环扩增反应的多聚核酸适配体驱动双磷酸盐结晶的新方法,成功将抗骨吸收药物阿仑膦酸盐和促骨形成类药物DNA适配体组装成一种新型无载体纳米药物。

随着全球人口老龄化的日益加剧,骨质疏松症已经成为影响全球数百万人的系统性疾病。在临床上,基于抗骨吸收类药物(如双磷酸盐)和促骨形成类药物(如硬骨素抑制剂)发展出两种不同的骨质疏松症治疗方法。然而,由于前者不能直接促进成骨作用而后者不能直接抑制破骨作用,导致二者对骨质疏松的治疗效果均不佳。尽管通过开发纳米递送系统能够在一定程度上提高药效,然而现有的药物载体不仅存在制备过程复杂、易引起毒副作用等问题,且不能兼顾直接抑制破骨和促进成骨的作用。因此,亟需开发一种兼具直接抑制破骨和促进成骨作用的无载体双药纳米组装体。
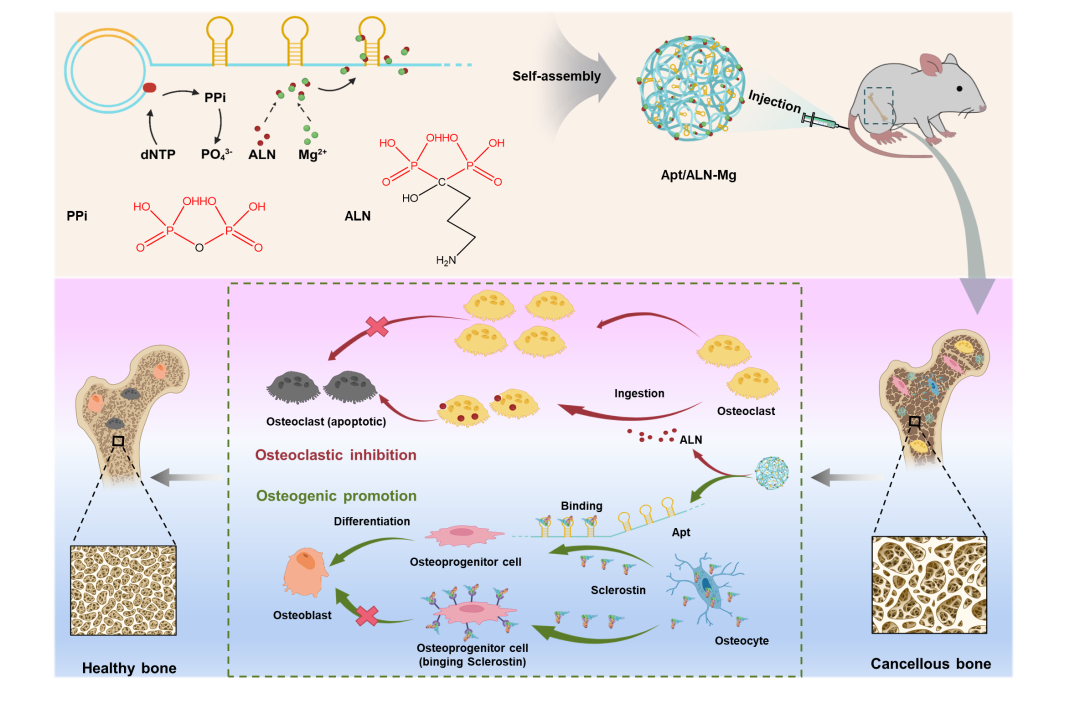
Apt/ALN-Mg纳米药物合成路线及其治疗骨质疏松症的机制示意图
为此,同济大学胡勇教授课题组提出一种基于滚环扩增反应的多聚核酸适配体驱动双磷酸盐结晶的新方法,成功将抗骨吸收药物阿仑膦酸盐和促骨形成类药物DNA适配体组装成一种新型无载体纳米药物。该复合纳米药物可以保护DNA免受核酸酶的快速降解,避免游离阿仑膦酸盐细胞毒性高的问题。此外,基于DNA和阿仑膦酸盐对骨的结合能力,纳米颗粒有效地富集在松质骨部位。更重要的是,松质骨的酸性微环境触发纳米药物的解离以实现两种药物的持续释放。其中,阿仑膦酸盐抑制破骨细胞介导的骨吸收,而DNA适配体解除硬骨素对成骨分化的抑制。此外,基于核酸序列和结构与无机晶体结构的可精准定制性,该工作提出的组装策略亦有望按需定制更多新型DNA纳米药物,以定向调节其他复杂的病理微环境。
研究成果近期以“Polyaptamer-Driven Crystallization of Alendronate for Synergistic Osteoporosis Treatment through Osteoclastic Inhibition and Osteogenic Promotion” 为题发表在《美国化学学会纳米》(ACS Nano)。同济大学材料科学与工程学院硕士生Yang Xingsen为论文的第一作者。同济大学材料科学与工程学院胡勇教授和杜建忠教授为论文的共同通讯作者。该研究得到了国家级青年人才计划、国家自然科学基金杰出青年科学基金等项目资助。
原文链接:
https://doi.org/10.1021/acsnano.4c07265
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#骨质疏松症# #纳米药物# #抑制破骨# #促进成骨#
59