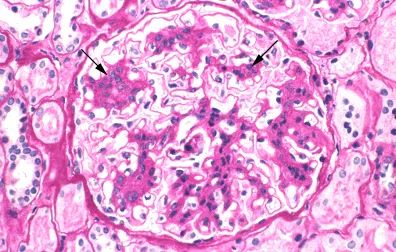
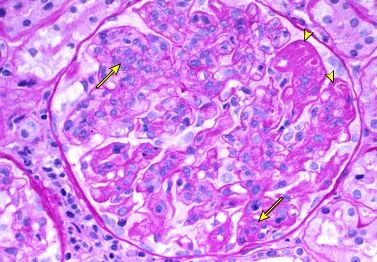
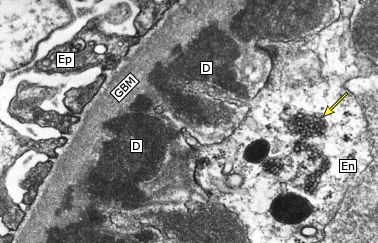
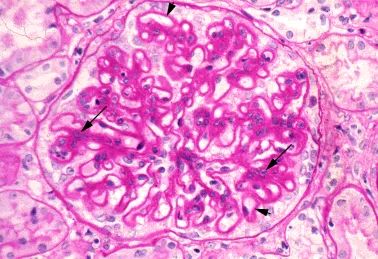
系统性红斑狼疮(systemic lupus erythematosus, SLE)常累及肾脏。患者在确诊狼疮性肾炎(lupus nephritis, LN)时(据统计,中国有约半数的 SLE 患者患有 LN),很多都存在尿液分析结果异常,伴或不伴血浆肌酐浓度升高。 PART 01 发病机制 LN的发病机制可能涉及外周血和肾脏中某些基因的表达,表现为B细胞自我耐受性丧失、自身抗体的分泌与肾脏的慢性炎症。 自身抗体的分泌是 LN 发病的基础 1.抗双链DNA(ds-DNA)抗体是最为常见的自身抗体。ds-DNA 的主要来源是细胞死亡。细胞死亡释放的ds-DNA 一般不具有免疫原性,只拥有免疫反应性。若与适当的刺激物联合作为 T 辅助细胞或 B 细胞的共刺激因子时,则产生针对自身 ds-DNA 的免疫应答,如来自病原体的 DNA 结合蛋白、多瘤病毒的T抗原、抗微生物肽LL37等。在特殊情况下,DNA 自身也可具有强免疫原性,比如紫外线直接损伤皮肤而导致细胞死亡产生的 DNA 具有很强的免疫原性,可直接被髓样树突状细胞识别,并诱导免疫反应。 正常人体中 B 细胞发育和分化的任意阶段都存在着防止自身反应性B 细胞活化的机制。若此类基因功能缺失,则可形成自身反应性 B 细胞并分泌自身抗体。 2.中性粒细胞和濒死中性粒细胞可能会释放中性粒细胞胞外诱捕网(neutrophil extracellular trap, NET),NET由中性粒细胞弹性蛋白酶、组蛋白酶G、DNA等网状结构。这是近年看来发现的中性粒细胞防御机体感染的新方式,但 NET 中也包含多种抗原,NETs生成增多或清除不及时可为自身抗原形成提供基础,与自身免疫性疾病发生密切相关。据报道,SLE患者中存在NET降解减少,LN患者尤甚。LN中的补体激活可能会损伤内皮和增加肾脏炎症,从而引起肾脏损害。 3.其他机制:抗dsDNA抗体可能不需要形成免疫复合物即可诱发肾炎。抗dsDNA抗体似乎可在体外与人系膜细胞相结合,并诱发产生促炎症物质。 自身抗体及其免疫复合物的肾脏沉积是 LN 患者肾脏损伤的基础 肾巨噬细胞通过表面 FcγR 与免疫复合物的识别并结合,摄取免疫复合物,完成免疫复合物的内皮运输,致使免疫复合物沉积于肾脏。继而激活补体系统、使炎细胞聚集、释放细胞因子及蛋白水解酶,造成系膜细胞增生、血管球上皮受损和肾间质纤维化等一系列病理改变,最终导致肾功能丧失。 免疫复合物形成的位置与抗原及抗体的特点有关,所带来的病理改变亦有不同。 •系膜和内皮下区域——大型完整免疫复合物或阴离子抗原(不能穿过肾小球毛细血管壁的阴离子电荷屏障)沉积于系膜和内皮下区域。这些沉积物在GBM近端,因而与血管腔相通。因此,补体激活(主要通过经典途径)以及趋化因子C3a和C5a的产生引起中性粒细胞及单个核细胞汇集。这些改变的组织学表现为系膜性、局灶性或弥漫性增生性肾小球肾炎,临床表现为尿沉渣镜检有活动性发现(红细胞、白细胞及细胞管型或颗粒管型)、蛋白尿及常见肾功能急性下降。 免疫复合物沉积的严重程度和性质决定了是发生局限于系膜的轻度疾病,还是更为严重的局灶性或弥漫性增生性肾小球肾炎。 •上皮下区域——实验研究提示两种主要机制可能参与了上皮下沉积物的形成:某种阳离子抗原,其可跨过GBM并固定在上皮下区域,随后与抗体形成复合物;或某种针对内源性上皮细胞抗原的自身抗体。虽然上皮下区域的沉积物也可激活补体,但GBM阻止了趋化因子进入循环,因此没有炎症细胞汇集。因此,损伤局限于肾小球上皮细胞,主要的临床表现是蛋白尿,通常为肾病范围蛋白尿。在组织学上,这些患者最常呈膜性肾病表现。 图源参考文献[3] PART 02 狼疮肾炎诊断 早期识别SLE患者肾脏情况,均推荐LN患者肾活检 何时应该怀疑LN:对于SLE患者,若尿沉渣镜检有活动性发现持续性血尿(每高倍镜视野中有至少5个红细胞且多为异形)和/或细胞管型、蛋白尿和/或血清肌酐升高(或eGFR降低),应考虑LN。抗dsDNA抗体滴度高及补体(C3和C4)水平低常提示活动性SLE,尤其是LN,不过血清学评估的实用性因人而异。 《2019年中国狼疮肾炎诊断和治疗指南》诊断标准: SLE患者出现以下临床和实验室检查异常时,即可诊断为LN,包括: 1. 蛋白尿持续>0.5g/24h,或随机尿检查尿蛋白3+,或尿蛋白/肌酐比值>500mg/g(50mg/mmol); 2. 细胞管型包括红细胞管型、血红蛋白管型、颗粒管型、管状管型或混合管型; 3.活动性尿沉渣(除外尿路感染,尿WBC>5个/HPF,尿RBC>5个/HPF),或红细胞管型,或白细胞管型。 肾活检病理显示为免疫复合物介导的肾小球肾炎则进一步确定LN的诊断。 图源参考文献[3] 图源参考文献[3] PART 03 狼疮肾炎病理分型 《2019年中国狼疮肾炎诊断和治疗指南》推荐:LN病理类型推荐2003年国际肾脏病学会/肾脏病理学会(INS/RPS)的分型标准(表1)】。并采纳2018年RPS工作组对LN病理类型和美国国立卫生研究院(NIH)肾组织活动性(AI)和慢性指数(CI)评分标准提出的部分修订意见。建议增加狼疮足细胞病和狼疮血栓性微血管病(TMA)两个特殊病理类型。对Ⅳ型LN不再区分Ⅳ-G和Ⅳ-S两个亚型,但需注意球性和节段性肾小球病变的数量和比例。同时需注意肾小管一间质的急性或慢性病变,对所有类型LN进行肾组织AI和CI评分。 《2019年中国狼疮肾炎诊断和治疗指南》 《2019年中国狼疮肾炎诊断和治疗指南》 轻微系膜性LN(Ⅰ型) —— 这类患者通常尿液分析结果正常、没有或仅有轻微蛋白尿且血清肌酐正常,故很少得到诊断。因此,通常未行肾活检。Ⅰ型LN患者仅存在系膜区免疫复合物沉积,由单纯免疫荧光或免疫荧光联合电镜发现,但此类患者光镜下无异常。Ⅰ型LN是最早期、最轻微的肾小球受累类型。 系膜增生性LN(Ⅱ型) ——此类组织学改变患者的临床表现为镜下血尿和/或蛋白尿,高血压不常见,基本不会出现肾病综合征和肾功能受损。 光镜下可见系膜区细胞增多(可以是任何程度的增多)或系膜基质扩张(图1)。 系膜增生性LN的肾脏预后很好,无需特异性治疗,除非进展为更晚期疾病或存在广泛足细胞融合和肾病综合征的证据。 图1:显微照片显示系膜增生性肾小球肾炎。系膜基质和细胞性增加的节段区域(箭头) 局灶性LN(Ⅲ型)——Ⅲ型LN患者通常有血尿及蛋白尿,一些患者还会出现高血压、GFR降低和/或肾病综合征。Ⅲ型LN的组织学定义如下: ●光镜显示受累肾小球不到50%,如果受累超过50%,则应诊断为弥漫性LN(Ⅳ型)。虽然光镜显示受累肾小球不到50%,但免疫荧光显微镜检查(针对IgG和C3)显示几乎全部受累。 ●活动性或非活动性毛细血管内或毛细血管外肾小球肾炎几乎总呈节段性(即,受累的肾小球毛细血管丛不到50%)。电镜检查通常显示肾小球毛细血管壁内皮下及系膜区存在免疫复合物沉积。 弥漫性LN(Ⅳ型) —— 这是最常见和最严重的LN组织学类型。几乎所有活动性Ⅳ型LN患者都有血尿和蛋白尿,且肾病综合征、高血压及GFR降低都很常见。这类患者通常存在明显低补体血症(尤其是C3)和抗dsDNA抗体水平升高,尤其是在疾病活动期。 Ⅳ型LN的组织学定义如下: ●光镜显示受累肾小球超过50%(图2),如果不到50%,则应归类为局灶性LN(Ⅲ型)。 ●受累肾小球表现为毛细血管内肾小球肾炎,伴或不伴毛细血管外肾小球肾炎。还可能观察到系膜区异常。电镜下可见内皮下沉积物,至少在活动期可见(图片3)。存在弥漫性白金耳样(wire loop)沉积物但几乎没有肾小球增生时,也应考虑为Ⅳ型LN。 图2:细胞增殖区域(长箭头)和肾小球毛细血管壁增厚(由于免疫沉积),其可能足够突出以形成“线环”(短箭头) 图3:显示内皮细胞(En)中有大量内皮下沉积物(D)和特征性的管网状结构(箭头) 狼疮膜性肾病(Ⅴ型) ——狼疮膜性肾病见于10%-20%的LN患者。Ⅴ型LN患者通常有肾病综合征表现,类似于原发性膜性肾病。就诊时还可能有镜下血尿及高血压,肌酐浓度通常正常或仅轻度升高。 Ⅴ型LN的特点为光镜下可见肾小球毛细血管壁弥漫性增厚(图片4),免疫荧光或电镜下可见上皮下免疫复合物沉积(可为球性或节段性受累)(图片5)。也可能存在系膜区受累。 图4:肾小球毛细血管壁的弥漫性增厚(短箭头)。局灶性系膜扩张和细胞增多(长箭头) 图5:上皮下免疫沉积物(D)是所有膜性肾病的特征,但内皮管网状包涵体(箭头)强烈提示潜在的狼疮。 晚期硬化性LN(Ⅵ型) —— 晚期硬化性肾小球肾炎患者通常表现为慢性进展性肾功能不全伴蛋白尿,尿沉渣检查相对正常。Ⅵ型LN的特征为90%以上的肾小球出现球性硬化。 狼疮足细胞病 ——一些研究者证实,狼疮中肾脏受累所致肾小球足细胞病可引起弥漫性上皮细胞足突消失但无免疫复合物沉积。这是微小病变肾病的典型组织学表现。在SLE合并肾病综合征的患者中,这类病变的发生率估计为1%-2%。此类病变称为“狼疮足细胞病”。 《2019年中国狼疮肾炎诊断和治疗指南》 狼疮血栓性微血管病(TMA)——SLE的肾脏损伤可直接由TMA所致,称为狼疮TMA。狼疮TMA的发病机制不明,可能与SLE的抗磷脂抗体(aPL)、ADAMTSl3的抗体或抑制物导致ADAMTS13酶活性缺乏(类似于血栓性血小板减少性紫癜,TTP)或补体调节蛋白功能异常等因素相关。绝大多数狼疮TMA与免疫复合物性LN并存(如Ⅳ型和Ⅳ+V型LN),少部分可仅表现为肾脏TMA而无免疫复合物性LN。TMA与LN并存时,肾功能损伤重,半数以上需要肾脏替代治疗,远期预后差,需联合血浆置换等特殊治疗才能改善肾功能,提高远期人肾存活率。 参考文献: [1].中国狼疮肾炎诊断和治疗指南[J].中华医学杂志,2019(44):3441-3455. [2]韩敬,顾津伊,刘裔,秦源,赵玲华.血清中性粒细胞胞外诱捕网水平与狼疮性肾炎的相关性[J].天津医药,2022,50(02):171-176. [3]董雅倩,卢宪媛,唐斓,刘孟华.狼疮性肾炎发病机制、生物标志物及治疗现状研究进展[J].实用医学杂志,2018,34(10):1605-1609. [4]王翔鹏,张全书,李丽丽,武璐璐,向阳.狼疮性肾炎发病机制及其与核转录因子-κB关系探讨[J].风湿病与关节炎,2018,7(08):54-57+76. [5]Almaani S, Meara A, Rovin BH. Update on Lupus Nephritis. Clin J Am Soc Nephrol 2017; 12:825. [6]Parikh SV, Rovin BH. Current and Emerging Therapies for Lupus Nephritis. J Am Soc Nephrol 2016; 27:2929. [7]Ortega LM, Schultz DR, Lenz O, et al. Review: Lupus nephritis: pathologic features, epidemiology and a guide to therapeutic decisions. Lupus 2010; 19:557. [8]uptodate:Lupus nephritis: Diagnosis and classification






本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#狼疮#
73
#肾炎#
0