Nature Cell Biology:p300核胞浆穿梭是哈钦森-吉尔福德早衰综合征mTORC1过度激活的基础
2024-02-25 Jenny Ou MedSci原创 发表于上海
这些结果揭示了营养物质如何通过进出细胞核的阳性调节剂p300来调节mTORC1,一种细胞质复合物,以及这种途径如何在哈钦森-吉尔福德早衰综合征中失调,导致mTORC1过度活和自噬缺陷。

雷帕霉素复合物1(mTORC1)复合物的机械靶包括丝氨酸/肌镶蛋白激酶mTOR、mTOR的调节相关蛋白(通常称为猛禽)、哺乳动物致死与SEC13蛋白8(MLST8)、PRAS40和DEPTOR。它是核心细胞功能的中央调节器,包括生长、翻译和自噬,其活性受营养物质的正调节,包括氨基酸(AAs)和葡萄糖(Glc)。
哺乳动物mTORC1活性通过抑制结节性硬化复合物1和2受到生长因子和细胞内能量信号的刺激,这些复合物是阴性mTORC1调节剂。AAs通过Rag GTPases向mTORC1发出信号。当通过溶酶体表面的猛禽和Rag蛋白之间的相互作用与溶酶体连接时,mTORC1是活跃的。这允许mTOR与其激活剂RHEB结合。
有人提出多种途径来调节mTORC1活性,但这些主要来自对HEK293细胞的研究。最近,我们描述了亮氨酸(Leu)在我们分析的大多数原发性和癌细胞类型(少数例外,如HEK293细胞)中通过其代谢物乙酰辅酶A(AcCoA)调节mTORC1,这得到了体内相关数据的支持。高AcCoA水平刺激mTORC1活性,并通过猛禽乙酰化抑制自噬,这是其与Rag蛋白和mTORC1溶酶体定位的结合所必需的,这是响应营养补充的mTORC1激活的要求和驱动因素。
p300,而不是其他lysine乙酰转移酶(KATs),通过调节猛禽乙酰化是这个过程的关键媒介。mTORC1活性通过ULK1等关键调节剂的抑制性磷酸化来抑制宏观自噬(以下简称自噬)。不调节的mTOR信号与许多疾病有关,包括神经退化和衰老。哈钦森-吉尔福德早衰综合征(HGPS)是一种罕见的散发性常染色体显性加速衰老障碍。在9-24个月时,受影响的个体表现出惊人的生长延迟,并发展出特征性外观。
这种情况表现为许多衰老特征,包括皮肤弹性下降、脱发和冠状动脉疾病,这通常会导致青少年早期死亡。HGPS是由LMNA(1824C>T;G608G)中的无声点突变引起的,该突变编码内核膜内蛋白层蛋白A和C。Lamin A/C对于保持核结构完整性和染色质组织至关重要。HGPS LMNA G608G突变激活了一个神秘的拼接位点,产生蛋白(50 AA删除的层状A)的表达。这种较短形式的层状A仍然永久化,导致其与内核膜的构成性关联。
亲基因的积累诱发各种细胞缺陷,包括异常的核形态和有缺陷的DNA修复。此外,黄素聚集导致线粒体功能障碍和氧化应激以及表观遗传调节受损,完全导致细胞过早衰老。去除孕激素作为HGPS的治疗策略已被研究。例如,用mTORC1抑制剂、雷帕霉素及其类似物依夫罗利姆斯治疗人类HGPS成纤维细胞,该抑制剂增强自噬依赖性黄体素清除,改善核泡泡。mTORC1在HGPS中过度激活,尽管该机制尚未描述。
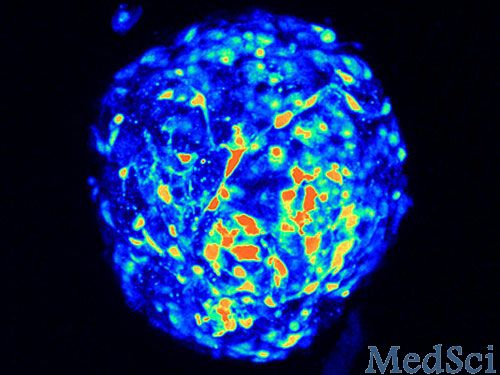
2024年1月24日发表在Nature Cell Biology的文章中,展示了p300定位如何调节mTORC1活性以响应营养状态。在大多数细胞类型和多样化的小鼠组织中,p300核-细胞质运输对于通过饥饿/再刺激进行mTORC1调节至关重要,p300进出核的贩运分别由AMP激活的蛋白激酶(AMPK)和蛋白磷酸酶2A(PP2A)调节。这种生物学在HGPS中受到干扰,导致细胞质p300和mTORC1过度激活增加。
在这里,我们描述了p300/EP300的细胞核细胞质穿梭调节mTORC1活性,以响应氨基酸或葡萄糖水平。研究结果显示,这些营养素的耗竭导致p300的细胞质到细胞核重新定位,从而减少mTORC1成分猛禽的乙酰化,从而降低mTORC1活性并激活自噬。这是由丝氨酸89时p300的AMP激活蛋白激酶依赖性磷酸化介导的。
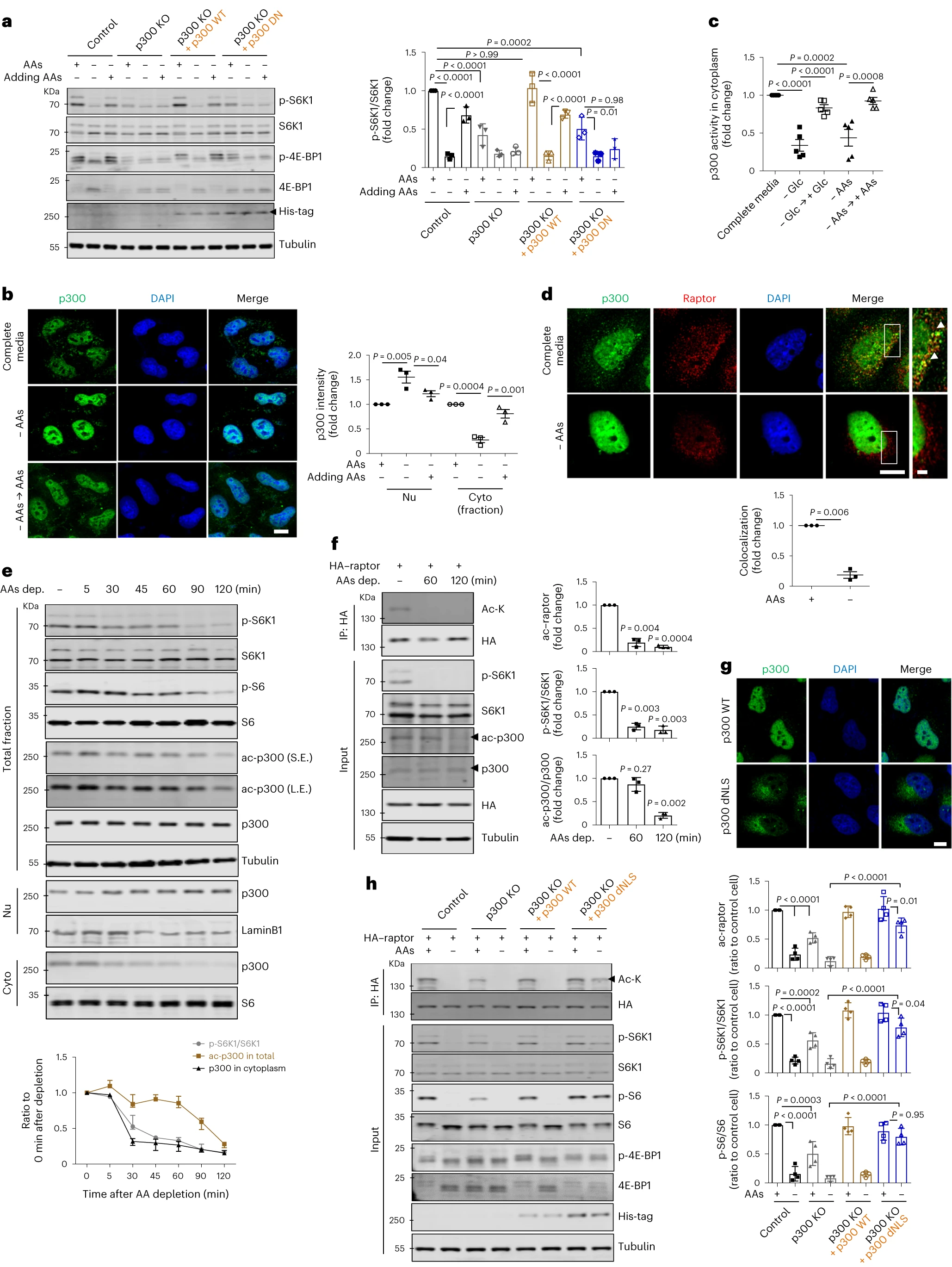
p300核细胞质穿梭取决于营养状态,并调节mTORC1
营养物质添加到饥饿细胞中,导致蛋白质磷酸酶2A依赖性核p300的脱磷酸化,使其CRM1依赖性出口到细胞质中,以介导mTORC1的重新激活。p300穿梭调节大多数细胞类型的mTORC1,并响应不同小鼠组织中营养素的改变。有趣的是,在哈钦森-吉尔福德早衰综合征患者的细胞中,p300细胞质-核穿梭被改变。p300被致病蛋白、孕激素错位,激活mTORC1并抑制自噬,通过调节p300穿梭而正常化的表型。
综上所述,我们的研究表明,p300穿梭进出细胞核的能力是mTORC1-自噬对营养素反应的关键决定因素,p300穿梭的调节可能是治疗HGPS的有用治疗靶点。
原文出处
Son, S.M., Park, S.J., Breusegem, S.Y. et al. p300 nucleocytoplasmic shuttling underlies mTORC1 hyperactivation in Hutchinson–Gilford progeria syndrome. Nat Cell Biol 26, 235–249 (2024). https://doi.org/10.1038/s41556-023-01338-y
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#mTORC1# #p300核胞浆# #哈钦森-吉尔福德早衰综合征#
94