Mol Autism:自闭症相关蛋白POGZ参与调控干细胞干性和神经诱导的分子机制
2022-06-13 MedSci原创 MedSci原创
POGZ是一个在小鼠早期胚胎发育时期广泛表达的转录因子,尤其在胚胎大脑皮层表达强烈,提示其在大脑发育过程中的重要作用。与另外一个自闭症高风险基因
近日,中国科学院水生生物研究所研究员孙玉华团队以小鼠胚胎干细胞(mouse embryonic stem cells,ESCs)为模型,揭示了POGZ通过染色质重塑复合物esBAF参与调控ESCs的干性和神经诱导的分子机制。
研究人员发现,ESCs中敲除POGZ后,ESCs的自我更新和增殖受到严重损害,伴随干性相关基因表达显著降低以及发育分化相关基因的表达显著升高(图1)。重要的是,在ESC向神经前体细胞诱导过程中,POGZ功能缺失显著抑制神经前体基因的表达,导致神经诱导和发育异常(图2)。全基因组结合分析发现,POGZ显著定位于基因的启动子和增强子区域(图3)。进一步研究发现,POGZ可以与SWI-SNF(esBAF)染色质重塑复合物的核心组分BRG1/BAF155互作(图4),并且在基因的启动子和增强子区域共定位。在干性条件下,POGZ通过与BRG1互作,通过调节增强子活性促进干性基因的表达,从而维持胚胎干细胞不分化;在神经诱导过程中,POGZ招募esBAF复合物到神经早期发育基因的增强子区域,促进基因的表达,确保神经诱导和分化的正常进行(图5)。
该研究发现POGZ通过与esBAF复合物互作参与神经诱导分化的机制,而BAF复合物活性异常已被广泛证实与多种神经系统发育缺陷有关。研究成果为POGZ突变导致的神经系统发育障碍性疾病提供了新的见解。
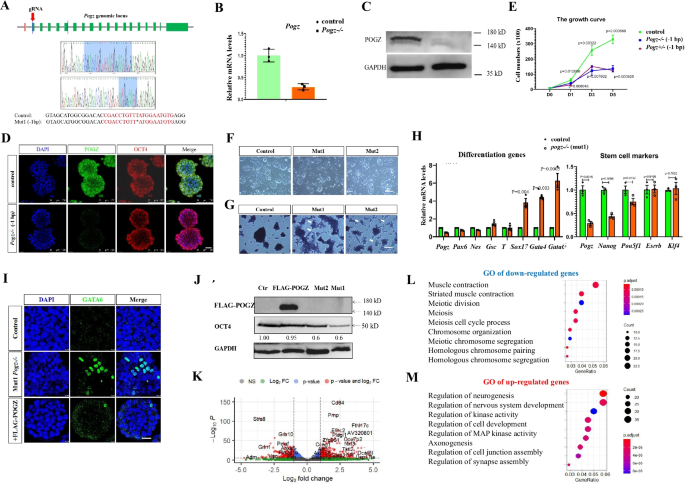
图1 POGZ缺失影响ESCs自我更新
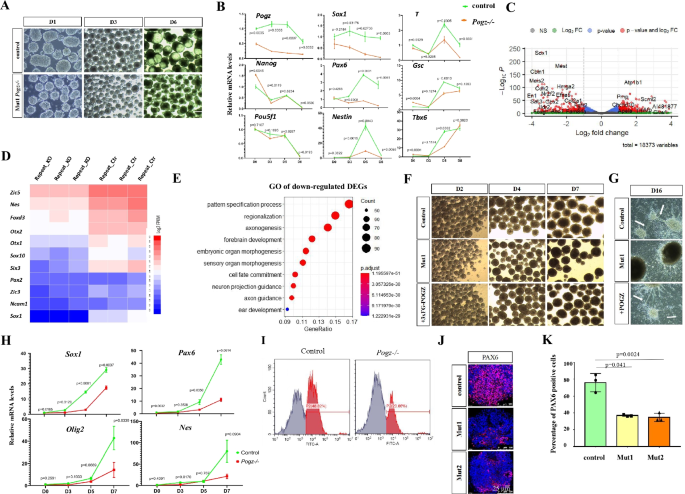
图2 POGZ缺失导致神经发育异常
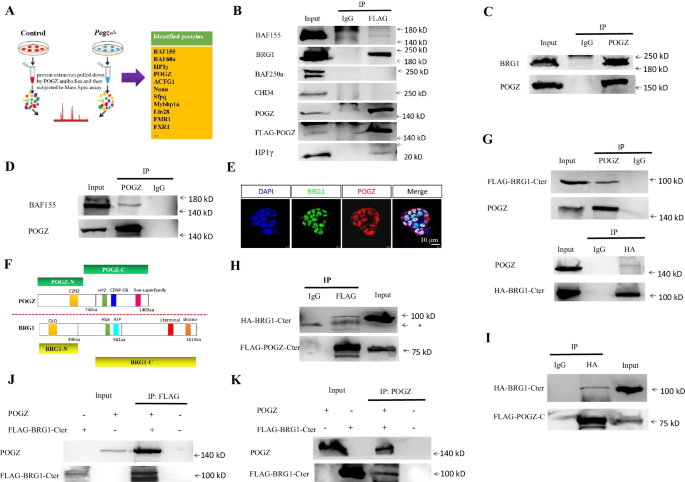
图3 POGZ主要定位于基因的启动子和增强子区域,以及POGZ与esBAF核心组分互作
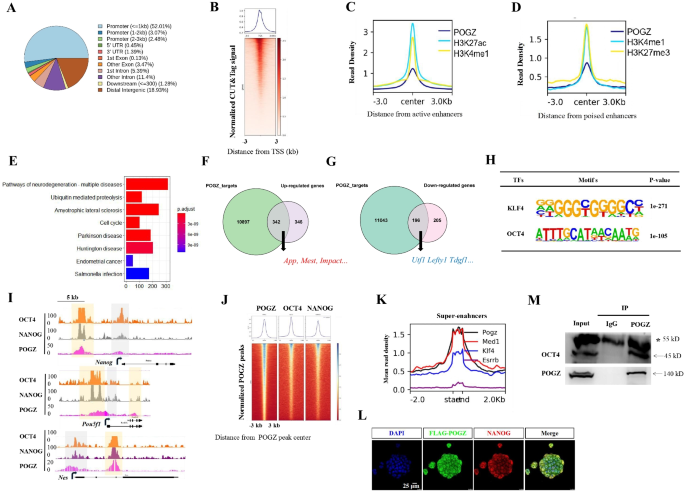
图4 甲基化调控机制
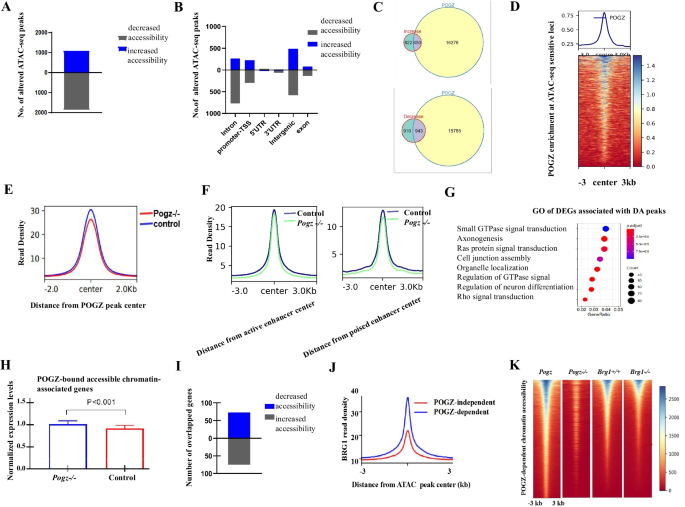
图5 POGZ招募BRG1促进神经诱导
相关成果近日以Autism-associated protein POGZ controls ESCs and ESC neural induction by association with esBAF为题在线发表在Molecular Autism上。该研究工作得到国家重点研发项目的资助。
原始出处:
Autism-associated protein POGZ controls ESCs and ESC neural induction by association with esBAF.Mol Autism (IF: 7.51; Q1). 2022 Jun 1;13(1):24. doi: 10.1186/s13229-022-00502-9
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#autism#
93
#调控干细胞#
83
#自闭#
89