树突状细胞是一类异质性的天然免疫细胞。主要的DC类型包括传统DC(cDCs),可分为不同的亚型、浆细胞样DC(pDCs)和炎症性DC(infDCs),它们具有不同的个体发生、免疫特性和特定作用。
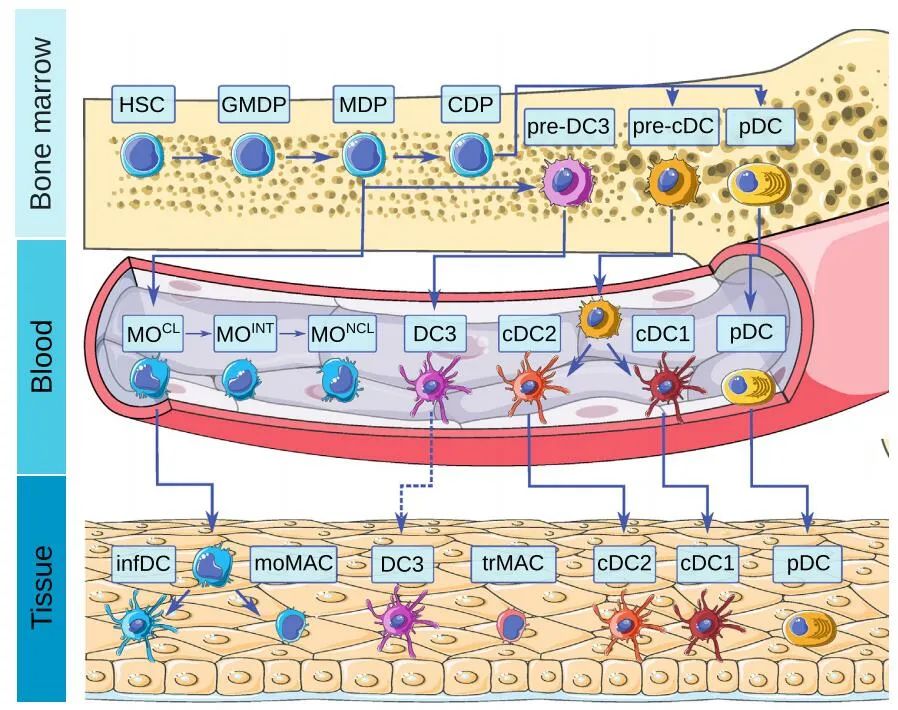
pDC分泌大量的I型干扰素以应对病毒,pDCs可以交叉递呈抗原,在形态上类似于产生抗体的浆细胞。
在人类中,cDCs由两个主要亚群(cDC1和cDC2)组成,最初分别以CD141(BDCA3)和CD1c(BDCA1)的表达为特征。人类cDC1细胞表达TLR3和TLR10,识别病毒和细胞内抗原,并产生III型干扰素。cDC2细胞表达TLR2、TLR4、TLR5、TLR6和TLR8。
另一组树突状细胞由所谓的炎性树突状细胞代表,炎症树突状细胞在从外周血中渗出的组织中分化。在稳定状态下,特别是在炎症状态下,在不同的组织中都可以检测到infDCs。
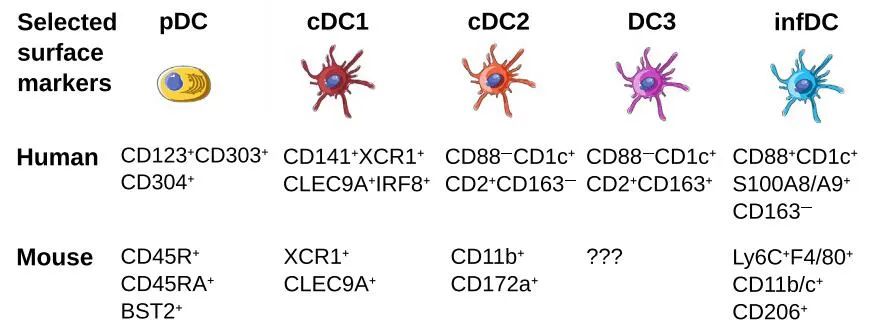
不同DC组的表达谱和表面标记不仅在物种之间不同,而且在同一生物体的不同组织中也不同。
树突状细胞通过膜结合模式识别受体(PRRs),如Toll样受体(TLRs),识别大量病原体相关分子模式(PAMPs)和损伤相关分子模式(DAMPs)。主要是处理并向T细胞提供抗原以刺激其分化。
树突状细胞不仅是协调免疫反应对抗威胁的核心,而且还需要在稳定状态下调节免疫系统和诱导免疫耐受。具体而言,树突状细胞与胸腺髓质上皮细胞通过MHC-II向自身反应的单个阳性CD4+T细胞呈递自身抗原,并在相互作用加强时促进其凋亡。
然而,这个过程不足以完全消除自身反应克隆。外周免疫耐受的其他机制有助于维持免疫系统的稳态,防止对“自我”或无害抗原的反应。同样,DCs是这一过程的关键。具体而言,不成熟树突状细胞(iDCs)具有比成熟树突状细胞(mDCs)更低的交叉表达能力和更少的共刺激分子表达的表型,这赋予了它们耐受性特征和在外周耐受中的关键作用。
树突状细胞也可以通过称为外周交叉耐受的机制促进自身反应性CD8+T细胞的外周耐受性,促进克隆清除、克隆无能和调节性T细胞(Tregs)的分化。
在人和小鼠中,tolDCs诱导耐受的机制有几种。首先,当T细胞通过T细胞受体(TCR)和MHC之间的相互作用识别tolDCs提供的抗原时,如果不存在共刺激信号(DCs中T细胞CD28与CD80/CD86结合),T细胞无法产生IL-2并增殖。
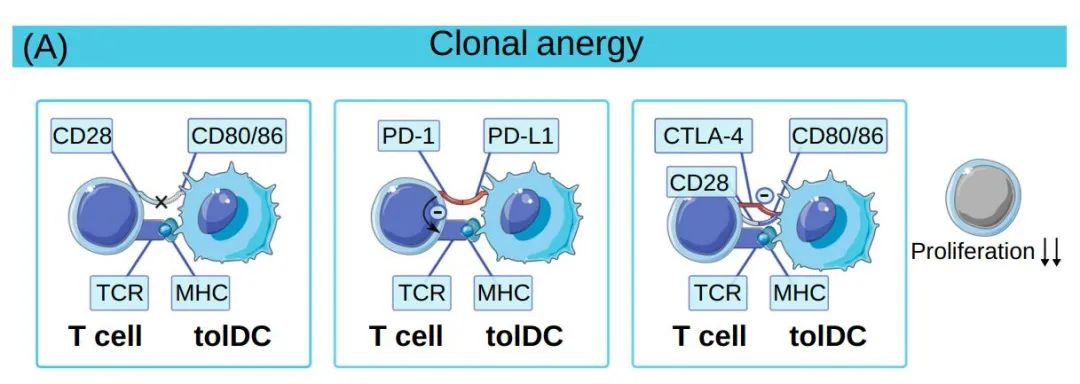
第二,tolDCs中共抑制分子的表达在T细胞中传播接触依赖性抑制信号,抑制增殖,促进克隆无能。例如,PD-L1是一种抑制性表面受体,DCs对其的表达参与了耐受诱导。此外,CTLA-4可以调节DCs表达的共刺激分子,损害幼稚T细胞的启动。
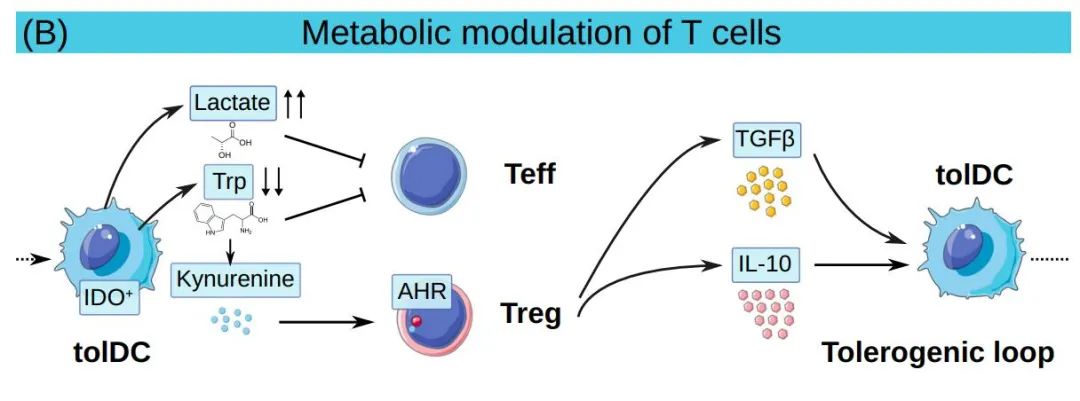
除了细胞-细胞接触依赖机制外,tolDCs还可以产生几种耐受性细胞因子和代谢物。各种类型的tolDC产生IL-10,并可在体外诱导效应和记忆CD4+T细胞无能,以及促进分泌IL-10、IFN-γ和TGF-β的Treg和Breg的分化。
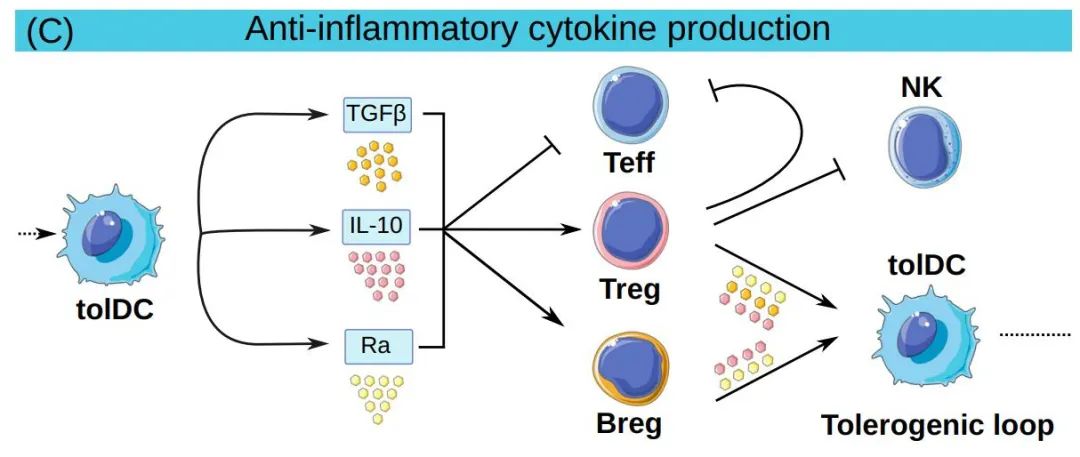
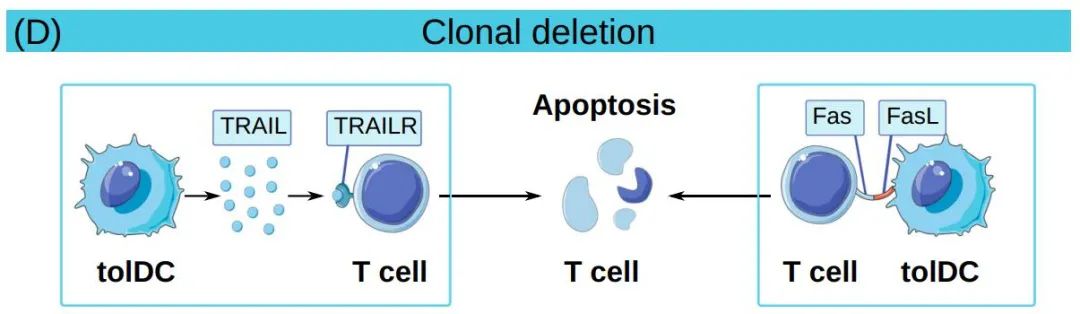
最后,tolDCs可以通过克隆清除直接消除T细胞。例如,树突状细胞肿瘤坏死因子(TNF)相关凋亡诱导配体(TRAIL)与T细胞死亡受体之间的相互作用可通过激活caspase途径促进其凋亡。同样,在T细胞活化过程中上调的Fas可与tolDCs中的FasL结合并促进小鼠T细胞凋亡。
免疫细胞分化,包括树突状细胞的免疫原性或耐受性,需要精确的转录调控,这主要依赖于转录因子(TFs)和表观遗传机制。在小鼠细胞和体外人类分化模型中已经鉴定出不同的TFs,例如,在小鼠中,TF PU.1被认为是cDC发育的主要调节因子。此外,一些TF与cDC亚群的极化有关:BATF3、IRF8、NFIL3、ID2、NOTCH2、IRF4和KLF4。
TFs与表观遗传酶共同作用,靶向特定的基因组位点,导致表观遗传修饰。众所周知,DNA甲基化和组蛋白翻译后修饰等表观遗传标记可直接或影响细胞表型和功能,一些研究已经证明了不同的表观遗传机制在获得DC耐受性中的作用。
例如,组蛋白脱乙酰基酶(HDAC)11负性调节人类和小鼠树突状细胞中IL10基因的表达。此外,在某些炎症反应过程中产生的氧化磷脂可使人单核细胞来源的树突状细胞在体外分化为耐受表型。特定的DNA甲基化变化也与获得耐受性有关,人单核细胞在前列腺素E2(PGE2)存在下的体外分化产生一种tolDC,其中PGE2诱导DNMT3A上调,后者介导免疫原性基因的甲基化和沉默,影响这些细胞在体外抑制CD8+T细胞增殖的能力。
慢性炎症性疾病的特点是免疫稳态的破坏和由特定的内源性或外源性抗原触发的长期或反复的炎症反应。目前的治疗方法可能涉及使用免疫调节剂和免疫抑制剂,从小分子如甲氨蝶呤到单克隆抗体,如Ocreizumab。
来源于单核细胞的耐受性DC细胞(mo-TolDCs)的治疗代表了一种富有前景的替代方案。mo-tolDCs有可能通过在不干扰保护性免疫的情况下消除病理性自身免疫或炎症反应来“重新教育”免疫系统,使其趋向于体内平衡。此外,tolDCs可能触发自我增强的耐受性回路,从而有理由期待这种疗法可能提供持久的有益效果,甚至是治疗性的。
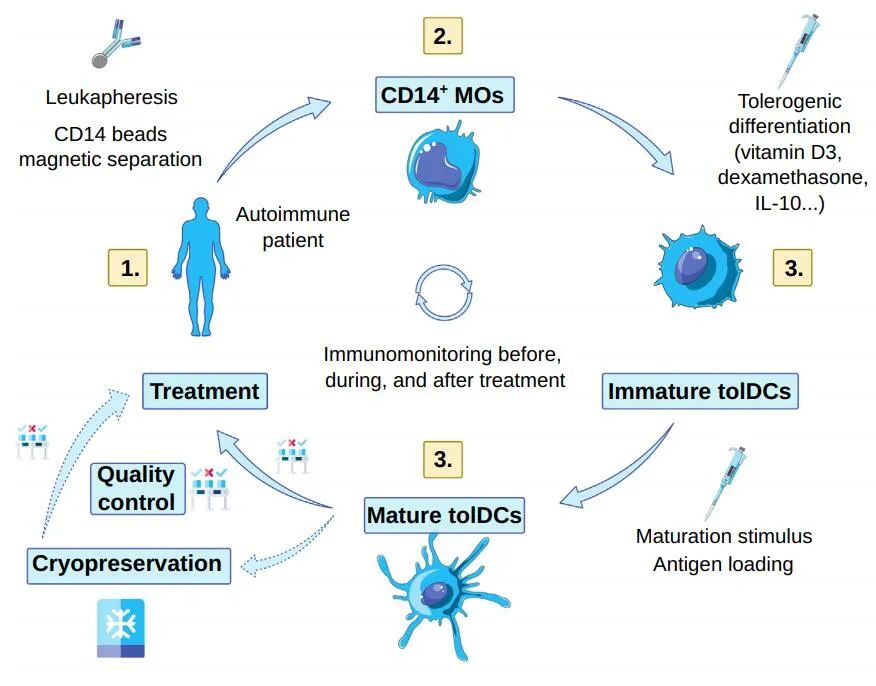
到目前为止,基于小鼠模型的tolDCs潜在治疗效果的概念证明已用于RA、T1D、MS和器官移植。基于tolDC生物学的不断深入了解和动物模型的良好结果,目前已有多个I期临床试验,正在评估自体免疫和移植中接受者来源的tolDC疗法的安全性和可行性。
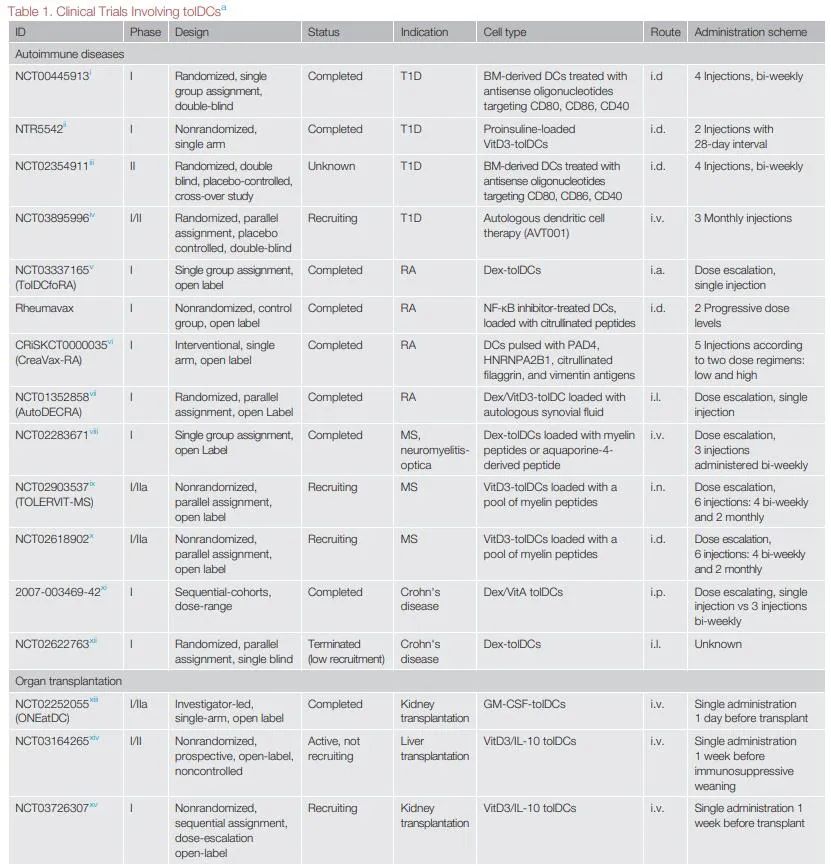
tolDCs真正应用于临床,需要解决许多问题。不同的tolDC生成方案、剂量、给药途径、靶向疾病和涉及的患者类型阻碍了试验数据的比较,并强调了协调未来临床分析的必要性。
此外,开发基于mo-tolDC治疗的一个关键考虑因素是从患者中分离的单核细胞可能具有不同于健康个体的表型,从而产生具有不同功能的tolDC。事实上,炎症可以在转录和表观遗传学水平上影响髓系细胞的频率和表型。
此外,产生具有不同表型和耐受性的tolDC的大量步骤的存在构成了一个巨大的挑战,需要建立强有力的质量控制指标,用以评估每个细胞产品的表型、效力和安全性。
这些需求推动了美国(免疫耐受网络)和欧洲(关注和加速基于细胞的耐受诱导疗法的行动)机构的行动,以协调涉及耐受性细胞产品的试验设计以及免疫监测。这些协同行动导致了六个I/II阶段临床试验,评估了各种调节细胞产品在肾移植中的使用;除此以外,目前还有正在进行的剂量递增一期试验,调查多发性硬化症患者皮内与经皮给药VitD3-tolDCs的对比研究。
近年来,有关tolDC生物学与耐受机制等方面的研究已经取得了进展,特别是,在转录组和表观基因组水平上形成这些细胞耐受性程序的途径正在得到更好的理解。此外,一期临床试验表明,基于tolDC的治疗对于某些疾病是安全可行的。
进一步的研究需要我们提高对tolDCs生物学的深入认识,其目的是更好地了解在不同疾病的背景下调节tolDCs免疫特性的潜力。在针对肿瘤的细胞治疗中,环境对特定治疗的成功起着关键作用,这表明需要更好地控制tolDCs发挥作用的病理环境。与此方法一起,对从特定疾病患者中分离的单核细胞的特征的分析,可能在优化第二代tolDC疗法中起着关键作用。此外,对于诱导免疫耐受,表观遗传学改变和基于表观遗传学的治疗可能为调节tolDCs的适应性提供新的靶点。
最后,必须规范临床试验和免疫监测方案,这有助于进一步优化tolDCs在临床上的转化,从而理想地治疗各种病理状况,包括某些自身免疫和炎症性疾病。
参考文献:
1.Tolerogenic Dendritic Cells in Autoimmunity and InflammatoryDiseases. Trends Immunol. 2020 Dec 5; S1471-4906(20)30259-3.
2. Decoding the Heterogeneity of Human Dendritic Cell Subsets. TrendsImmunol. 2020 Dec;41(12):1062-1071.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言