Sci Transl Med:3篇!花芳等多团队合作发现维持非小细胞肺癌干性和化学耐药的新机制
2023-12-18 iNature iNature 发表于上海
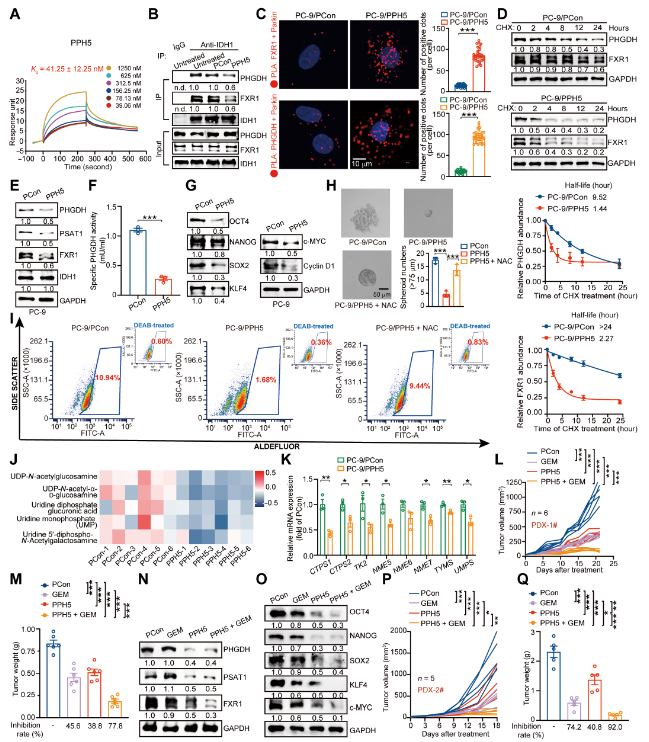
该研究揭示了IDH1WT在丝氨酸代谢中的作用,强调了IDH1WT作为NSCLC中根除TICs和克服吉西他滨化疗抗性的潜在治疗靶点。
肿瘤启动细胞(TICs)通过重新调整其代谢特征以满足其生物能量、生物合成和氧化还原需求。野生型异柠檬酸脱氢酶1(IDH1WT)在非小细胞肺癌(NSCLC)中作为潜在的诊断和预后生物标志物的作用,但IDH1WT如何调节NSCLC的进展仍然不明确。
2023年12月13日,中国医学科学院/北京协和医学院花芳及谭锋维共同通讯在Science Translational Medicine 在线发表题为“Wild-type IDH1 maintains NSCLC stemness and chemoresistance through activation of the serine biosynthetic pathway”的研究论文,该研究报告IDH1WT通过增强磷酸甘油酸脱氢酶(PHGDH)和磷酸丝氨酸氨基转移酶1(PSAT1)的表达,即新生丝氨酸合成途径的第一和第二个酶,来激活丝氨酸的生物合成。增加的丝氨酸合成导致谷胱甘肽/ROS失衡,并支持嘧啶生物合成,维持肿瘤起始能力并增强吉西他滨的化疗抗性。
从机制上讲,该研究通过共免疫沉淀实验和邻近连接实验确定IDH1WT与磷酸甘油酸脱氢酶和脆性X相关蛋白1(FXR1)相互作用并稳定它们,阻碍它们与E3泛素连接酶帕金的结合。随后,稳定的FXR1支持PSAT1 mRNA的稳定性和翻译,通过链霉亲霉素D追踪实验和体外翻译实验进行了确定。破坏IDH1WT-PHGDH和IDH1WT-FXR1的相互作用在肺癌移植瘤模型中协同减少了NSCLC干细胞特性,并使NSCLC细胞对吉西他滨和缺乏丝氨酸/甘氨酸饮食疗法的敏感性增强。总体而言,该研究揭示了IDH1WT在丝氨酸代谢中的作用,强调了IDH1WT作为NSCLC中根除TICs和克服吉西他滨化疗抗性的潜在治疗靶点。
2022年1月5日,中国医学科学院北京协和医学院药物研究所花芳及中国医学科学院/北京协和医学院国家肿瘤中心/国家肿瘤临床研究中心/肿瘤医院张海增共同通讯在Science Translational Medicine 在线发表题为“TRIB3 reduces CD8+ T cell infiltration and induces immune evasion by repressing the STAT1-CXCL10 axis in colorectal cancer”的研究论文,该研究证明了 TRIB3 在各种 CRC 小鼠模型中抑制 CD8+ T 细胞浸润。该研究发现 TRIB3 被乙酰转移酶 P300 乙酰化,从而抑制了 TRIB3 的泛素化和随后的蛋白酶体降解。异位表达的 TRIB3 通过增强表皮生长因子受体信号通路抑制信号转导和转录激活因子 1 (STAT1) 激活和 STAT1 介导的 CXCL10 转录,导致肿瘤浸润性 T 细胞减少。Trib3 的遗传消融或用 P300 抑制剂加速 TRIB3 降解的药理学加速 T 细胞募集增加并使 CRC 对免疫检查点阻断疗法敏感。总之,这些发现将 TRIB3 鉴定为 CRC 中 CD8+ T 细胞浸润的负调节剂,突出了治疗免疫学“冷”CRC 的潜在治疗靶点。
2021年3月24日,中国医学科学院北京协和医学院胡卓伟,花芳及李珂共同通讯在Science Translational Medicine 在线发表题为”Faciogenital Dysplasia 5 supports cancer stem cell traits in basal-like breast cancer by enhancing EGFR stability“的研究论文,该研究进行了基于BLBC组织芯片的免疫组织化学分析,并显示了Faciogenital发育异常5(FGD5)蛋白的丰度与BLBC的不良预后相关。该研究将FGD5鉴定为肿瘤起始细胞的正调节剂,并提出了BLBC亚型乳腺癌的潜在治疗选择。

肿瘤启动细胞(TICs)被认为是肿瘤发生的推动力,被认为是复发、远程转移和治疗抵抗的根源。新的证据表明,TICs表现出代谢的可塑性,并可以重新调整它们的代谢状态以适应恶劣的微环境和生物合成需求)。代谢表型的改变是非TICs获得干细胞样特征的一种方式。对TICs代谢依赖性的新见解将为根除TIC群体提供潜在的治疗策略。
非小细胞肺癌(NSCLC)约占所有肺癌病例的85%,其特征是高度异质的营养利用和代谢。一些TICs已知更倾向于糖酵解而不是线粒体氧化磷酸化来获得干细胞特性。肺鳞状癌细胞表现出升高的葡萄糖转运蛋白1表达,增加了葡萄糖摄取和糖酵解通量。除了葡萄糖外,维持干细胞多能性和分化能力的某些氨基酸对于一些癌症至关重要。Trp53缺失诱导的NSCLC显示增加的支链氨基酸(BCAA)摄取以维持肿瘤形成。来自NSCLC的TICs对甲硫氨酸循环通量高度依赖,导致对外源甲硫氨酸的依赖性。丝氨酸甘氨酸和一碳途径(SGOCP)在肿瘤中反复上调,并与NSCLC的肿瘤起始能力相关联。丝氨酸是主要的一碳供体。
因此,丝氨酸的可用性或其新生合成在控制SGOCP活性和功能方面起着决定性的作用。细胞外丝氨酸摄取可以控制表皮干细胞的干细胞命运和肿瘤起始。在磷酸甘油酸脱氢酶(PHGDH)抑制后,用丝氨酸补充是不足以挽救细胞缺陷的,这表明丝氨酸合成途径可能对某些类型的癌症是必要的。关键的丝氨酸或甘氨酸生物合成酶,如PHGDH、磷酸丝氨酸氨基转移酶1(PSAT1)和丝氨酸羟甲基转移酶2(SHMT2),在NSCLC细胞中高度表达,并与临床侵袭性相关联。然而,高丝氨酸合成途径的选择压力尚不明确。
异柠檬酸脱氢酶1(IDH1)是一种在代谢重编程、表观遗传重编程、氧化还原平衡和DNA修复中发挥作用的关键酶。作为IDH家族成员(IDH1、IDH2、IDH3),IDH1催化异柠檬酸的氧化脱羧为α-酮戊二酸(α-KG),同时产生还原型烟酰胺腺嘌呤二核苷酸磷酸酯(NADPH)。IDH1热点突变因其在多种恶性肿瘤中的促癌作用而受到广泛关注,包括但不限于急性髓系白血病(AML)、胶质瘤、胆管癌和软骨肉瘤。这些突变发生在一个单一的氨基酸残基,即精氨酸132(R132),导致IDH1新的催化活性,产生致癌代谢产物2-羟基戊二酸(2-HG)。已经批准或正在开发用于治疗携带IDH1热点突变的恶性肿瘤的小分子抑制剂有几种。
近年来,人们逐渐认识到野生型IDH1(IDH1WT)的肿瘤促进作用。IDH1WT在各种恶性肿瘤中高度表达,并与治疗抵抗、肿瘤细胞存活优势和患者预后不佳相关。IDH1WT通过支持脂质生物合成和氧化还原平衡帮助胶质母细胞瘤(GBM)细胞实现代谢适应。值得注意的是,在65%的原发性GBM中,IDH1WT的表达升高,有利于癌症的增殖和复发。在肺癌中,对1924个肺癌标本的下一代测序研究显示NSCLC中IDH1突变率很低。然而,IDH1WT在肺腺癌中高度表达,并与患者预后不佳相关。这些观察结果突显了IDH1WT在NSCLC中的肿瘤促进潜力。
靶向IDH1支架作用抑制非小细胞肺癌的起始、进展和使吉西他滨治疗增敏(图片源自Science Translational Medicine )
该研究报告IDH1WT通过激活丝氨酸新生合成途径推动TICs并促进NSCLC的进展。IDH1通过增强丝氨酸生物合成酶PHGDH和PSAT1的表达,独立于IDH1酶活性,改善丝氨酸代谢。在机制上,IDH1与PHGDH和脆性X相关蛋白1(FXR1)相互作用,阻碍它们与E3泛素连接酶帕金的结合,导致PHGDH和FXR1的稳定。随后,PHGDH和FXR1诱导的PSAT1促进新生丝氨酸合成,增强谷胱甘肽(GSH)合成,并增强NSCLC的干细胞特性。遗传抑制IDH1或药物消除其支持丝氨酸代谢的作用可以阻止NSCLC的进展,并增强NSCLC对吉西他滨和丝氨酸/甘氨酸饥饿疗法的抗肿瘤效应。这些发现表明,IDH1WT的非酶作用角色是一个可用于治疗NSCLC的可靶向的“代谢检查点”。
原文链接:
https://www.science.org/doi/10.1126/scitranslmed.ade4113
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#非小细胞肺癌# #吉西他滨# #肿瘤启动细胞# #化学耐药#
85