浙大ACS Nano:纳米铈递送环孢素A治疗干眼症
2024-04-29 BioMed科技 BioMed科技 发表于上海
体外研究表明Cs@P/CeO2不仅可抑制细胞活性氧的产生,从而维持线粒体的完整性,而且下调炎症过程并使巨噬细胞复极。
干眼症(DED)已经越来越频繁地影响着全世界范围内人们的正常生活。目前的单靶向DED管理受到眼部微环境中氧化应激-炎症恶性循环和复杂细胞间串扰的严重阻碍。
在本研究中,浙江大学韩海杰研究员、姚克教授和计剑教授等人开发了基于纳米酶的滴眼液,即负载环孢菌素A的纳米氧化铈(Cs@P/CeO2)。Cs@P/CeO2具有可再生的抗氧化活性和环孢菌素A(CsA)的持续释放而展现出了长期抗氧化和抗炎能力。体外研究表明Cs@P/CeO2不仅可抑制细胞活性氧的产生,从而维持线粒体的完整性,而且下调炎症过程并使巨噬细胞复极。此外,使用流式细胞术和单细胞测序数据系统地证明了,Cs@P/CeO2 可以较少的炎症巨噬细胞极化重新平衡角膜微环境中的免疫-上皮通讯,抑制了氧化应激,并增强了上皮再生。总之,上述数据证明了抗氧化和抗炎Cs@P/CeO2可以为DED管理提供治疗见解。相关工作以“Nanoceria-Mediated Cyclosporin A Delivery for Dry Eye Disease Management through Modulating Immune–Epithelial Crosstalk”为题发表在ACS Nano。

【文章要点】
纳米二氧化铈,也称为二氧化铈纳米酶,源于氧空位的存在导致的铈(III)和铈(IV)之间的可逆切换,可表现出自再生抗氧化能力。因此,作者用聚乙二醇(PEG)壳修饰纳米二氧化铈(表示为P/CeO2),以提高生物相容性和亲水性。同时,作者还将临床药物如Restasis和Cequa的主要成分环孢菌素A(CsA)依次加载到PEG封端的纳米氧化铈的有机层上形成Cs@P/CeO2(图1),以发挥抗氧化剂和免疫调节剂的双重作用。
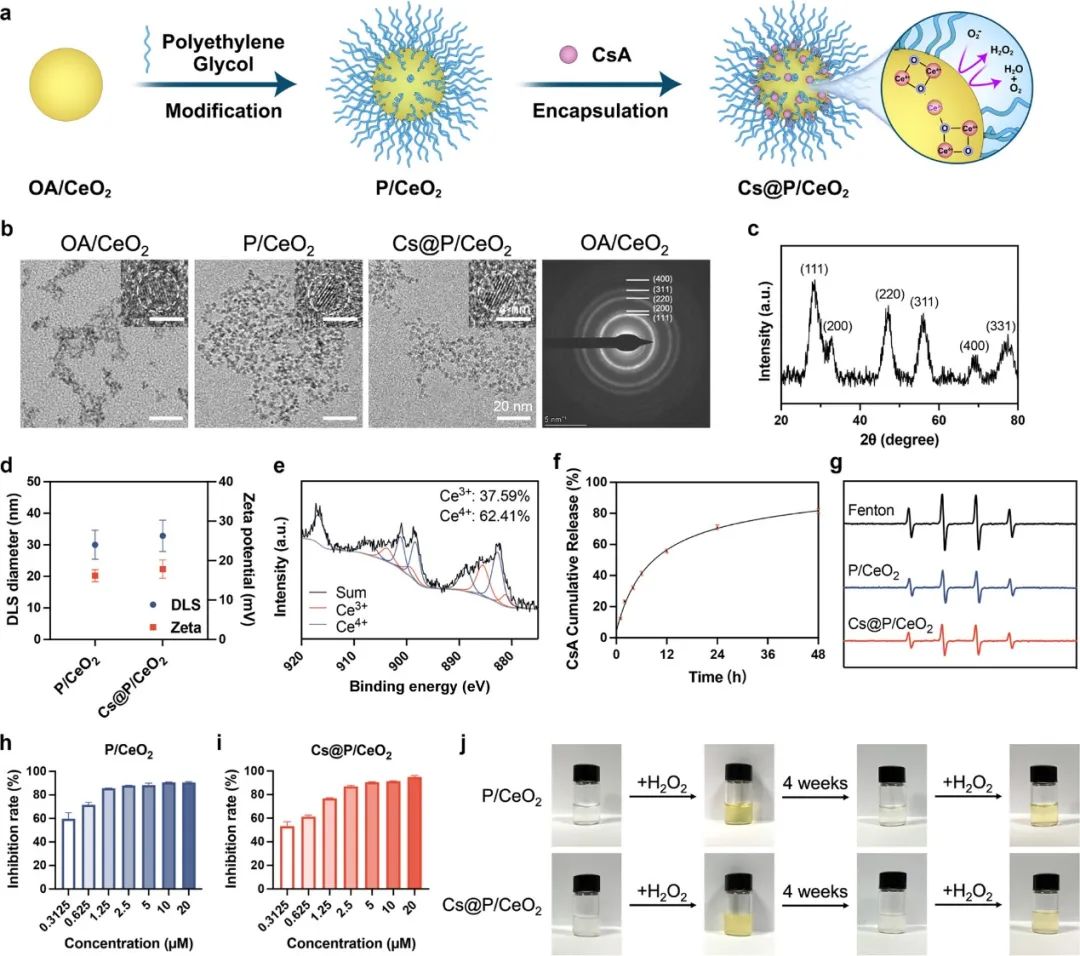
图1 Cs@P/CeO2的制备表征
作者使用上皮细胞和巨噬细胞来证实Cs@P/CeO2的作用。机制研究进一步显示了其对线粒体的保护作用。此外,作者还使用单细胞测序系统地描述了有/无Cs@P/CeO2处理的DED进展过程中角膜微环境的变化。结果表明,纳米氧化铈可以协调角膜微环境中的各种细胞类型,调节促炎/伤口愈合巨噬细胞的极化,促进角膜上皮细胞再生。细胞-细胞相互作用分析进一步证明了纳米氧化铈给药后免疫-上皮串扰的微调,这对组织再生和炎症缓解至关重要(图2)。该研究为DED和其他氧化应激和炎症相关疾病的有效治疗提供了见解。
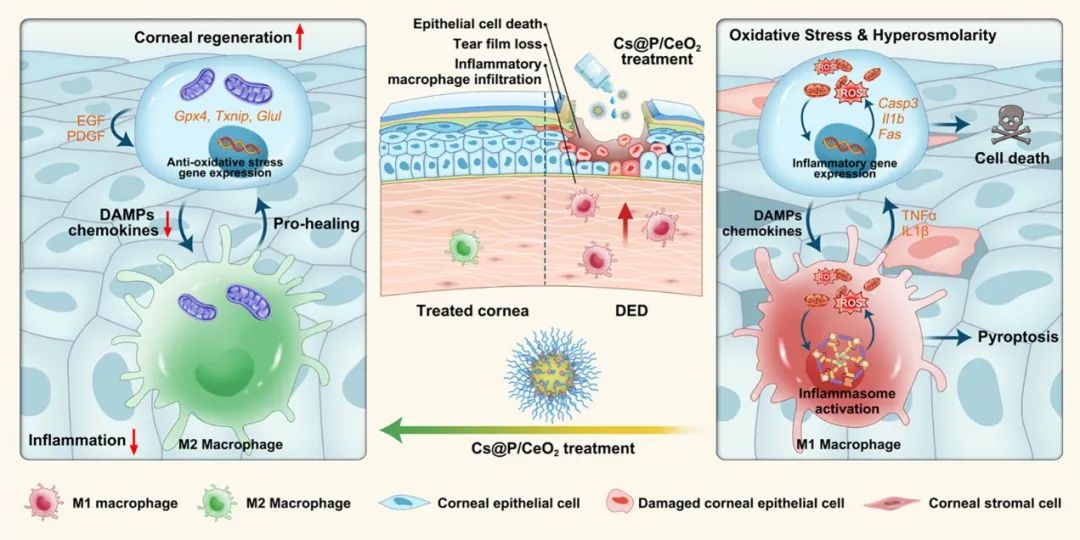
图2治疗DED的机制示意图
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.3c11514
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#干眼症# #环孢菌素A#
78