Nature:竞争太激烈了!“女神”发现2个CRISPR新系统
2016-12-25 佚名 生物探索
12月22日,在线发表于Nature杂志上的一项研究中,科学家们又为CRISPR家族找到了新的成员:CRISPR-CasX 和CRISPR-CasY。加州大学伯克利分校的Jillian F. Banfield教授和CRISPR先驱Jennifer A. Doudna 教授是这一研究的共同通讯作者。CasX仅由980个氨基酸组成据悉,CasX仅由980个氨基酸组成,远小于其它Cas蛋白。最常使用
12月22日,在线发表于Nature杂志上的一项研究中,科学家们又为CRISPR家族找到了新的成员:CRISPR-CasX 和CRISPR-CasY。加州大学伯克利分校的Jillian F. Banfield教授和CRISPR先驱Jennifer A. Doudna 教授是这一研究的共同通讯作者。

CasX仅由980个氨基酸组成
据悉,CasX仅由980个氨基酸组成,远小于其它Cas蛋白。最常使用的Cas9共包含1368个氨基酸。而CasY由约1200个氨基酸组成。Banfield说:“这两种新型的Cas蛋白真的非常小,尤其是CasX。这意味着,它可能更加有用。”以色列魏茨曼科学研究所的Rotem Sorek表示,这是非常重要的发现。从基因编辑的角度,递送小基因到细胞内要比递送大基因容易得多。
通过与Jennifer Doudna合作,Banfield的研究小组证明了CasX 和 CasY的功能性。研究人员在大肠杆菌中重建了CasX 和CasY系统,发现它们能够对细菌起到保护作用,阻止外源DNA转化。Doudna的研究小组正在调查这两个系统是如何工作的,希望它们能够成为基因编辑的补充工具。

Banfield gathering data at the Rifle site in Colorado, where she collected bacteria that were found to contain a new CRISPR-CasX system never before seen. (Roy Kaltschmidt photo, 2014)
发现过程
微生物利用多种CRISPR-Cas系统组成了它们的免疫力,其中,II类CRISPR系统(特别是基于核酸酶Cas9的系统)已成为最热门的基因编辑工具。值得注意的是,过去,科学家主要是基于在实验室中可培养的细菌开发CRISPR系统。而此次,CRISPR-CasX 和 CRISPR-CasY是在不可培养(uncultivated)的微生物中发现的。这类群体有望成为新型基因编辑系统的潜在来源。
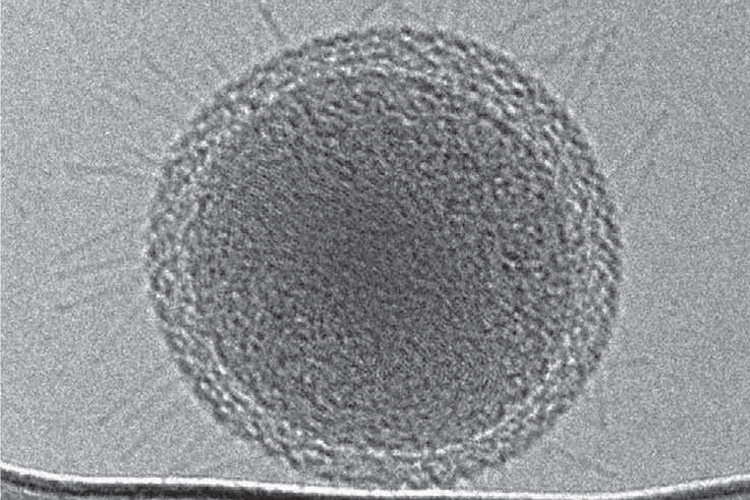
An uncultivable bacteria, probably symbiotic and living off other microbes in groundwater, has small hair-like pili covering its outer surface. It is about 250 nanometers in diameter, among the smallest known microbes. (Banfield lab image)
在过去的十年中,Banfield和同事从多个地方收集微生物,提取它们的DNA,重建它们的基因组。研究小组希望能够找到新的CRISPR系统。通过分析宏基因组数据库(包含成千上万的微生物基因组,大多数为不能培养的细菌和古生菌),寻找与编码Cas9蛋白序列相似的基因序列,研究小组最终发现了CRISPR-CasX 和 CRISPR-CasY。Banfield说:“我们搜索了包括1.55亿个蛋白的数据,只找到了CasX 和 CasY。”
此外,他们还在古生菌基因组中找到了Cas9的序列。值得注意的是,科学家先前只发现古生菌使用I类CRISPR系统,而II类CRISPR系统仅在细菌中被发现。
强大的基因编辑家族
近几年,基因编辑工具家族可谓是越来越壮大。目前II类系统中已经实验证明能够切割DNA的酶包括Cas9、Cpf1 和 C2c1;此外,C2c2被证明能够切割RNA;另一个假定的系统CRISPR- C2c3可能能用于切割DNA。
CRISPR-Cpf1
CRISPR-Cpf1系统最早由张锋等人在去年的一篇Cell文章中提出。本月发表在Nature Biotechnology上的最新成果(论文:Multiplex gene editing by CRISPR–Cpf1 using a single crRNA array)证实,CRISPR-Cpf1系统能够克服Cas9靶向多个基因位点的限制。使用单个定制的CRISPR阵列,研究人员实现了在哺乳动物细胞中同时编辑多达4个基因,在小鼠大脑中同时编辑3个基因。【详细】
CRISPR-C2c1
本月,Cell杂志发表了一篇关于CRISPR-C2c1系统的新成果(论文:PAM-Dependent Target DNA Recognition and Cleavage by C2c1 CRISPR-Cas Endonuclease)。中国科学院生物物理研究所高璞课题组与美国Sloan研究所 Dinshaw J. Patel课题组合作,揭示了CRISPR-C2c1响应外源DNA的作用机制。
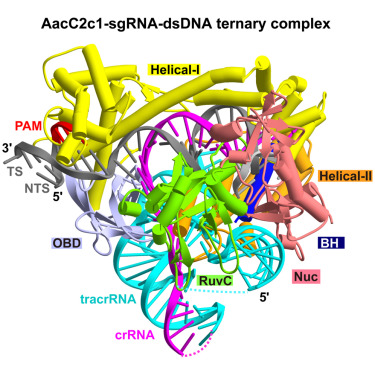
具体来说,研究中,科学家们首先解析了C2c1-sgRNA二元复合物及C2c1-sgRNA-DNA多种三元复合物结构。通过结构分析,揭示了C2c1不同于Cas9和Cpf1的独特target DNA识别和切割方式。研究首次明确了C2c1对双链DNA的切割会产生7nt的粘性末端。这是目前所有用于基因组编辑的CRISPR-Cas系统所能产生的最长粘性末端,将有希望提高切割后的连接效率。
CRISPR-C2c2
今年6月,发表在Science上的一项研究中(论文:C2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector),张锋等人描述了一种具有靶向和降解RNA能力的RNA导向酶(RNA-guided enzyme)C2c2,并描述了该酶的功能特征。研究表明,仅靶向RNA的CRISPR/C2c2系统能够帮助细菌对抗病毒感染。
小编说
这两年,Jennifer Doudna与张锋在CRISPR领域的竞争极为激烈。除了仍未有结论的专利之争,两个人在科研领域和商业领域都在你追我敢。此次,新系统发现后,加州大学抓紧申请了专利,已向美国专利与商标局提交了临时专利申请( Provisional Patent )。
最后,回到技术本身,小编想引用Jennifer A. Doudna在接受Cell采访时说过的话:CRISPR技术让科学家们以前所未有的轻松度、准确度以及效率,真正实现了编辑任何有机体的遗传信息,包括人类细胞。CRISPR的多功能性为能够改善人类生活的生物学和医学研究带来了新的、更广泛的可能。
参考资料:
The-scientist:New CRISPR-Cas Enzymes Discovered
Berkeley News:Compact CRISPR systems found in some of world’s smallest microbes
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#Nat#
61
#CRISPR#
54
加州大学伯克利分校的教授受人崇拜。
89