Acta Neuropathologica:多发性硬化的髓鞘再生受损的病变阶段相关原因分析
2020-08-23 MedSci原创 MedSci原创
多发性硬化症(MS)是中枢神经系统最常见的炎症和脱髓鞘疾病,它影响了全世界约230万人。病程10-15年后,约有50%的患者需要助行器。社会经济成本巨大。 2013年,MS在美国的年度成本估计约为每年
多发性硬化症(MS)是中枢神经系统最常见的炎症和脱髓鞘疾病,它影响了全世界约230万人。病程10-15年后,约有50%的患者需要助行器。社会经济成本巨大。 2013年,MS在美国的年度成本估计约为每年100亿美元。在组织病理学上,MS的特点是多灶性脱髓鞘病变,炎性浸润(巨噬细胞,T细胞和B细胞),轴突受损和数量减少以及少突胶质细胞丢失。根据血液来源的单核细胞和中枢神经系统驻留的小胶质细胞(随后总结为髓样细胞)的密度和分布,可以根据更新的MS组织学分类中的描述区分活动性,非活动性和混合病灶。脱髓鞘的轴突要么髓鞘再生,要么保持长期脱髓鞘,使它们特别容易受到免疫系统的伤害。轴索损伤和丢失已经在早期MS病变阶段出现,并且是疾病进展的根本原因。脱髓鞘后,轴突周围会形成新的髓鞘,称为髓鞘再生,代表了内源性修复过程,可恢复动作电位的传导,为轴突提供营养支持,并防止轴突损伤。另外,最近的组织学和影像学研究表明髓鞘再生有助于临床恢复。在来自同一患者的不同病变中,髓鞘再生程度可能会发生显着变化,并且病变部位可能会影响髓鞘再生程度。
在动物实验中,成功进行再髓鞘化需要少突胶质前体细胞(OPC)的增殖和迁移,以及它们分化为成熟的有髓鞘的少突胶质细胞。这些复杂的过程受OPC和少突胶质细胞与神经元和轴突,星形胶质细胞以及免疫细胞(例如巨噬细胞/小胶质细胞,T细胞和B细胞)相互作用的调节。在进行性MS中,OPC仍存在于MS病变中,尽管数量减少且分布不均匀,而成熟的少突胶质细胞几乎完全缺乏。这些发现导致少突胶质细胞分化受损的概念成为慢性MS髓鞘再生受限的因素。在动物研究中,已经确定了几种信号传导级联,抑制OPC分化为成熟的髓鞘少突胶质细胞,其可能被MS病变中的炎症细胞激活。相反,在实验动物研究中,M2(抗炎)表型的髓样细胞促进少突胶质细胞分化。为了确定促进少突胶质细胞分化和通过髓鞘再生的药物,已经进行了广泛的研究和药物开发工作。在鉴定出的药物中,有抗-Lingo-1抗体和clemastine在临床II期试验中进行了测试。两种化合物在几种脱髓鞘动物模型中均成功地促进了髓鞘再生。但是,它们在临床II期试验中的作用很小。
作者证明在活跃/脱髓鞘的白质病变中,成熟的少突胶质细胞得以保留,这些病变的一部分显示出明显的髓鞘再生。在混合性和非活动性病变中,少突胶质细胞损失在病变中心最为明显,这表明延长的脱髓鞘时间导致少突胶质细胞死亡。混合病变几乎完全缺乏髓鞘形成,而这种缺乏髓鞘形成与TMEM119 +小胶质细胞和iNOS +髓样细胞的相对增加有关。此外,体外实验表明,来自M1(促炎性)极化的原代人小胶质细胞的上清液不会损害M2或M0(未刺激的)极化的小胶质细胞。
方法:研究收集了62例患者的石蜡埋脑活检和尸检组织标本。包括来自32名患者的38个活检组织样本和来自30名患者尸检的113个MS病变(81个组织块)。研究包括的所有病变都位于大脑白质内,符合公认的MS诊断组织学标准。病变分类基于Kuhlmann等人更新的MS病变组织学分类。用免疫组织化学(IHC)检测髓鞘脱髓鞘,CD68测定髓系细胞(包括血来源的单核细胞和中枢神经系统的小胶质细胞)的数量和分布。活动性病变为高细胞病变,其特征是整个病变区弥漫性浸润,可见大量CD68+髓样细胞。这些细胞的密度高于邻近病变的周边白质(PPWM)和离病变较远的正常白质(NAWM)。在活检病变中,NAWM和PPWM被总结为非脱髓鞘白质(NDWM),因为活检标本经常是碎片状的,而且病变与非脱髓鞘白质之间的距离并不总是明确的。活动性病变进一步分为活动性/脱髓鞘性病变和活动性/脱髓鞘后病变。在活动性/脱髓鞘病变中,大量髓样细胞胞浆中含有MBP+髓鞘降解产物,而活动性/脱髓鞘病变中的髓样细胞缺乏这些髓鞘降解产物。混合性活动/非活动性病变(以前称为慢性活动性病变,包括所谓的阴燃性和缓慢扩张性病变)的特点是病变中心低细胞,病灶边缘有一圈活化的髓样细胞,而病灶中心几乎完全没有髓系细胞。为了简单起见,非活动性病变在整个病变区内呈低细胞状态,仅有少量髓样细胞存在。非活动性病变的髓系细胞密度较低。
在活检和尸检中,使用半定量评分评估所有病变中的髓鞘再生程度。在活检中,髓鞘再生被鉴定为利用IHC不规则形成的髓鞘。因为活检样品经常仅显示病变的一部分,所以作者使用以下类别来量化髓鞘再生的程度:0 =完全不存在髓鞘再生,1 =单个少突胶质细胞扩展髓鞘再生过程,2 =斑块状髓鞘再生,3 =整个采样病变区域的髓鞘再生。在尸检病例中,通过IHC的MBP薄髓鞘鞘和Luxol固蓝(LFB)-碘酸席夫(PAS)染色中的浅色染色确定了髓鞘再生区域。在大多数尸检病例中,对完整的病变进行了采样。因此,根据病变区域的髓鞘再生百分比对病变进行分类:0 =无髓鞘再生或仅在占整个病变区域的10%的病变边界处存在,1 =在超过10的区域发现了髓鞘再生,但少于整个病变区域的50%,2 =超过50%的病变为髓鞘再生,3 =完全重新髓鞘的病变。
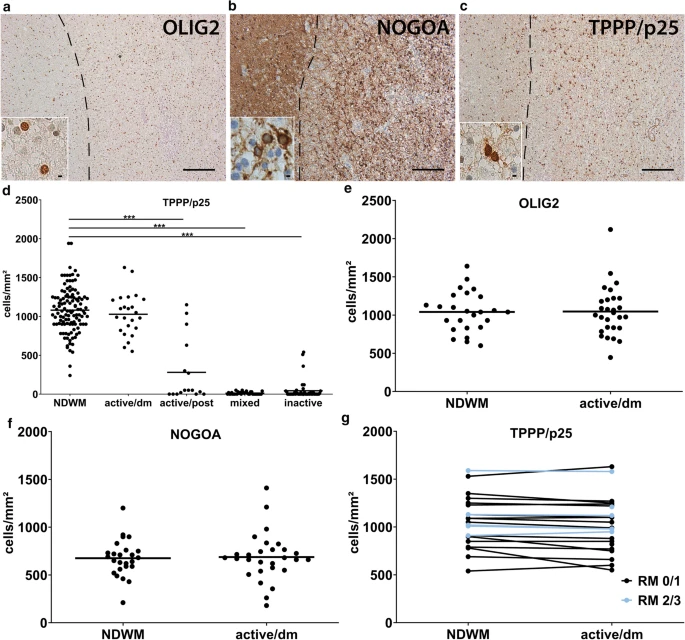
结果:使用不同的少突胶质标记(例如OLIG2,NOGOA和微管蛋白聚合促进蛋白(TPPP / p25))检查了MS组织切片中少突胶质细胞的数量。 OLIG2标记OPC以及成熟的少突胶质细胞,而NOGOA和TPPP / p25仅由成熟的少突胶质细胞表达(图1a,b)。但是,数据表明,NOGOA和TPPP / p25不能标记出完全相同的少突胶质细胞群,因为NOGOA +和TPPP / p25 +细胞的绝对数量不同。第一步,量化了NDWM(n = 117),活动/脱髓鞘(n = 24),活动/脱髓鞘后(n = 16),混合(n = 34)的TPPP / p25 +少突神经胶质谱系细胞的数量和非活动性病变(n = 46)。与NDWM相比,活动性/脱髓鞘性,混合性和非活动性病变中TPPP / p25 +少突胶质细胞的数量显着减少,而活动性/脱髓鞘性病变中TPPP / p25 +少突胶质细胞的数量却减少了(图1d)。为了验证TPPP / p25的数目并进一步鉴定NDWM中少突胶质细胞谱系以及活跃/脱髓鞘病变的细胞数目,作者对OLIG2 +和NOGOA +少突胶质细胞的数量进行了定量,未观察到显着差异(图1e,f)。同样,当比较包含NDWM和活动/脱髓鞘病变区域的单个病变时,也未观察到少突胶质细胞数量的明显减少(图1g)。
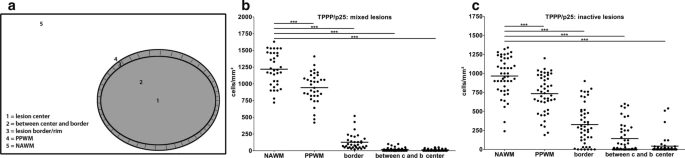
分析了混合病变中的胶质细胞数目,从中可以更详细地了解总病变区域。在福尔马林固定石蜡包埋的尸检材料中,TPPP / p25比OLIG2或NOGOA更可靠地标记少突胶质谱系细胞,这表明TPPP / p25表位比由适当抗体鉴定的NOGOA和OLIG2表位更稳定。因此专注于TPPP / p25来量化尸检材料中少突胶质细胞的数量。确定了病变边界处,病变边界与中心之间以及病变中心中NAWM,PPWM中TPPP / p25 +少突胶质细胞的数量(图2a)。在混合性病变中,边界代表含有髓样细胞的边缘。观察到与NAWM相比,包括边界以及PPWM在内的不同病变区域的少突胶质细胞数量明显减少(图2b)。在非活动性病变中也观察到了少突胶质细胞数目的类似变化。然而,与非活动性病变相比,少突胶质细胞损失在混合边界处更为明显。
作者的数据表明,MS髓鞘再生失败的根本原因取决于病变阶段。在活动/脱髓鞘病变中,缺乏髓鞘形成会导致髓鞘再生失败,在非活动性和混合性病变中少突胶质损失和不利的组织环境可能会阻止成功的髓鞘再生。由于仅专注于促进少突胶质细胞分化以增强髓鞘再生的药理方法可能会失败,因此应考虑针对成功的再髓鞘化所需的多个步骤的治疗策略,即少突胶质细胞增殖,迁移,分化,髓鞘形成和存活。作者的数据还表明,与以活动性病变为特征的RRMS相比,在混合性和非活动性病变占优势的进行性MS中促进髓鞘再生可能需要不同的治疗方法。为了了解预防髓鞘再生的分子机制并开发成功促进MS髓鞘再生的新治疗方法,需要更好的动物模型来模拟不同病变类型的病理特征。
原文链接:Heß, K., Starost, L., Kieran, N.W. et al. Lesion stage-dependent causes for impaired remyelination in MS. Acta Neuropathol 140, 359–375 (2020). https://doi.org/10.1007/s00401-020-02189-9
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#髓鞘#
99
#CTA#
74
#髓鞘再生#
93
#Pathol#
79
#pathologic#
70
#多发性#
66
学习了
0
学习
124
需要更好的动物模型来模拟不同病变类型的病理特征。
111
学习
117