拒绝失控生长!发现造成肝纤维化的关键分子
2022-10-06 生物探索 生物探索
肝纤维化则是其各种慢性肝病向肝硬化发展过程中的一个重要病理生理环节,但目前尚没有针对性的治疗药物。研究人员则希望通过探明肝纤维化的机制来为将来潜在的药物确定靶点。
慢性肝病的发生率在中国居高不下。数据统计,2020年中国慢性肝病患者人数可能超过4.47亿。我国曾一度是乙肝感染率最高的国家,1992年全国血清流行病学调查显示,我国的乙肝病毒表面抗原携带率高达9.75%,乙肝病毒感染者约1.2亿。虽然近30年的乙肝防治工作让情况大为改观,但据2018年《柳叶刀》发布的报告显示,中国乙肝仍有约8000万的病毒携带者,包括2000万人的确诊病例。另一方面,脂肪肝的患病人数在不知不觉中超过了两亿。这种因为“吃喝”导致的肝病负担与不断提高的生活生平呈正相关趋势。2020年武汉大学人民医院研究团队发表在Hepatology的研究“Epidemiological Features of NAFLD From 1999 to 2018 in China”[1]显示,中国非酒精性脂肪性肝病(NAFLD)已跃居为我国最常见的肝脏疾病。2018年的患病率达到32.9%(95%CI:28.9%-36.8%),与中国肥胖的上升趋势平行。
不过,即便体重正常,脂肪肝依然有可能找上门,据统计,在所有BMI<23的人群中,脂肪肝约有3%-30%的概率。全球NAFLD人群中约40%的被归类为非肥胖人群。饮酒则是中国诱发肝脏疾病的另一大原因。根据2018年更新的《酒精性肝病防治指南》,长期饮酒超过5年,折合乙醇量男性≥40g/d,女性≥20g/d;或2周内有大量饮酒史,折合乙醇量≥80g/d,则可引起酒精性肝炎。而根据世卫组织《2018全球酒精与健康报告》,2016年,中国15岁及以上人群人均年摄入纯酒精高达7.2升。
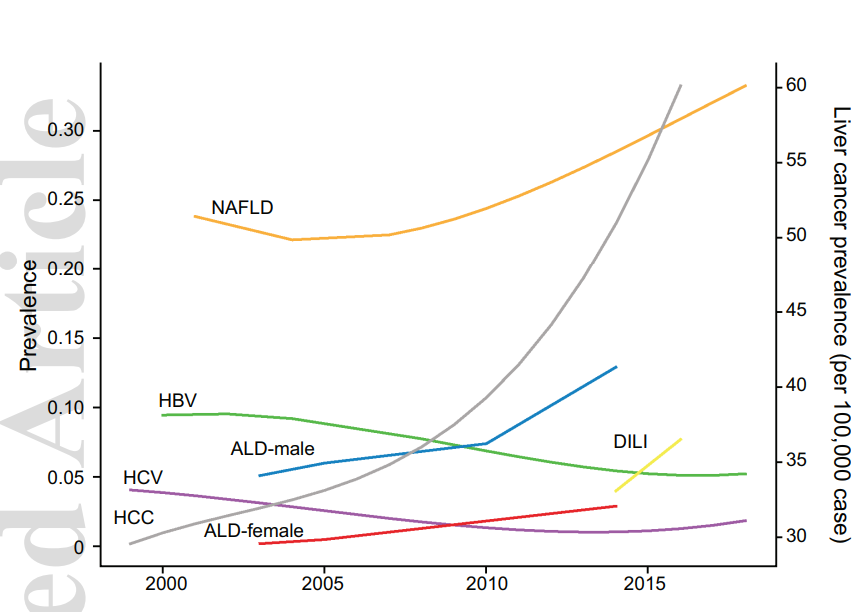
图1 中国1999-2018各类肝病趋势(图源:[1])
许多慢性肝脏疾病均可引起肝脏纤维化。肝脏纤维化是由于肝脏对慢性损伤进行病理性修复,而导致肝脏内结缔组织(包括胶原、糖蛋白和蛋白多糖等)发生弥漫性的过度沉积与异常增生。就好比皮肤受伤会结痂来自我修复,肝纤维化也是一种“疤痕”。如果肝脏长期发生损伤,肝脏发生纤维化的程度就会越来越深,肝细胞运作受到阻碍,正常的代谢功能难以发挥,到演变为肝硬化时则事态无法逆转且将危及生命。
双能肝祖细胞可以分化为胆管细胞或肝细胞,支持肝脏再生。胆道损伤将触发胆管细胞增殖以弥补胆管损失。密歇根大学安娜堡分校分子与综合生理学教授Liangyou Rui博士解释说:“在肝脏疾病条件下,胆管细胞会受到损伤,肝脏必须不断地再生新的胆管细胞。这些细胞有时会出现故障,导致炎症和纤维化。”过量的胆管细胞扩张即导管反应(ductular reaction),会促进肝病恶化。

图2 Liangyou Rui博士(图源:密歇根大学官网)
那么,有没有办法能够扭转这一进程, 遏制肝纤维化的加深,缓解肝病患者的病情?2022年8月30日,Liangyou Rui博士团队在Nature Communications上发表题为“Biliary NIK promotes ductular reaction and liver injury and fibrosis in mice”的文章[2]。研究确定了一种名为NIK的分子在故障胆管细胞中高度激活,能够被病毒、药物或其他损害劫持,导致导管反应。使用阻断NIK作用的抑制剂治疗小鼠,则能改善它们的肝病状况。

图3 研究成果(图源:[2])
过去的研究证明,肝脏中的NF-κB诱导激酶(NF-κB-inducing kinase,NIK)会在肥胖和慢性肝病情况下上调,其异常激活还将加剧肝毒素诱导的肝功能衰竭。本项研究则探索了胆道NIK在被胆管结扎术(Bile duct ligation,BDL)、胆管细胞毒物3,5-二乙氧基羰基-1,4-二氢可力丁(3,5-diethoxycarbonyl-1,4-dihydrocollidine,DDC)或α-萘基-异硫氰酸酯(α-naphtyl-isothiocyanate,ANIT)诱发导管反应、肝脏炎症和纤维化的小鼠身上所起到的作用。
研究表明:
1、胆道NIK上调可作为胆道损伤的标志
对野生型(NIK+/+)小鼠和全局NIK敲除(NIK-/-)小鼠进行DDC喂食,并使用抗NIK抗体和胆管细胞标志物keratin-19(K19)对肝脏切片进行免疫染色,结果发现在NIK+/+小鼠中很容易检测到表达NIK的细胞。在患有原发性胆汁性胆管炎、原发性硬化性胆管炎、乙型肝炎、丙型肝炎和酒精性肝硬化的人体样本中,检测出了更多表达NIK的细胞、胆管细胞、和表达NIK的胆管细胞。ANIT喂养的小鼠显示了类似的结果。不论病因如何,在患有慢性肝病的小鼠和人类中,胆道NIK水平上调。胆道NIK上调可作为胆道损伤的标志。
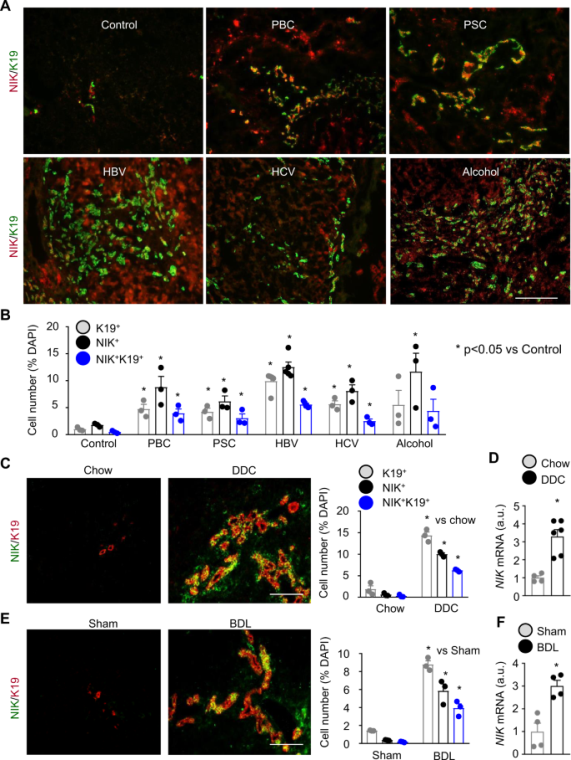
图4 慢性肝病与胆管细胞中NIK上调有关(图源:[2])
2、NIK的胆管细胞特异性敲除可抑制胆管细胞毒物诱导的导管反应
他莫昔芬(tamoxifen)处理的NIK的胆管细胞特异性敲除(NIKΔK19)实验组小鼠和用橄榄油处理的对照组(NIKf/f)小鼠相比,DDC喂养使得两组小鼠体重均有所降低,但对照组小鼠的降低程度更甚。解剖肝内胆管的结果发现,两组小鼠的总胆管重量都增加了,但对照组小鼠显著更高。肝脏切片染色的结果同样验证了预期,实验组小鼠的胆管细胞数量急剧减少,且检测不到表达NIK的胆管细胞。ANIT的喂养和DDC喂养类似,对照组小鼠的一些导管反应指标相对实验组升高,表明NIK是导管反应不可或缺的内在诱导剂,NIK的缺失将对胆管细胞毒物诱导的导管反应起到抑制作用。

图5 胆道NIK的消融减弱了DDC诱导的胆管反应(图源:[2])
3、无细胞系统中特定噬菌体可在60-90分钟内完成
使用抗K19和Ki67(增殖标志物)或K19和cleaved caspase-3(细胞凋亡标志物)的抗体对肝切片进行共免疫染色结果显示,实验组小鼠胆管细胞增殖显著降低,胆管细胞死亡则高于对照组,对NIK缺陷型胆管细胞系和非缺陷型细胞系施加TWEAK(一种NIK刺激细胞因子,可刺激胆管细胞增殖)刺激,TWEAK只能使得后者的胆管细胞数量增加,进一步说明胆道NIK通过调节胆管细胞增殖和凋亡来促进胆管反应。
病理学检查发现,喂食DDC后,实验组小鼠的血浆丙氨酸氨基转移酶(Alanine aminotransferase,ALT)、碱性磷酸酶(Alkaline phosphatase,ALP)和胆红素显著低于DDC饮食的对照组小鼠,肝损伤和免疫细胞浸润(炎症)明显低于对照组小鼠,肝脏纤维化的程度也更低,ANIT喂养以及胆管结扎的结果类似,表明实验组小鼠对于多种因素诱导的肝损伤、炎症和纤维化均具有显著抵抗力,胆管细胞固有的NIK极可能通过诱导导管反应来促进这些病变。
测量TWEAK刺激下NIK+/+和NIK-/-胆管细胞培养物各种已知与肝脏炎症和纤维化有关的细胞因子的表达水平发现,与NIK+/+相比,NIK-/-的表达显著更低,暗示胆道NIK能有效地刺激胆管因子的分泌,激活肝巨噬细胞和肝星状细胞,从而促进肝脏炎症和纤维化。进一步评估NIK选择性抑制剂化合物33(Compound33,C33)在肝病治疗中的潜力发现,在实验条件下部分抑制了NIK,血浆ALT、ALP和胆红素水平显著降低。
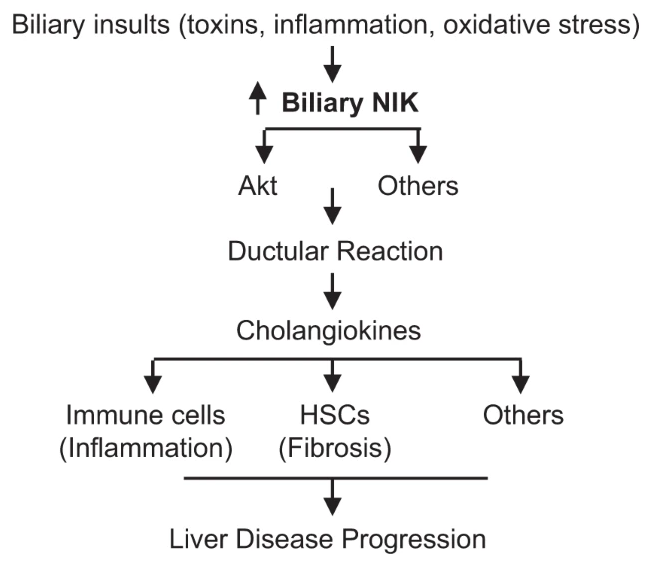
图6 胆道损伤导致肝病恶化的通路示意图(图源:[2])
这项研究明确地指出了胆管细胞固有NIK是连接胆道损伤与导管反应、肝损伤、炎症和纤维化的分子桥梁。NIK的胆管细胞特异性消融或使用C33对NIK进行药理学抑制均可以减轻小鼠的疾病反应。由于人类多种慢性肝病中也存在胆道NIK上调现象,通过对与小鼠类似的胆道NIK-导管反应-肝脏炎症-肝纤维化级联反应进行干预来治疗人类肝脏疾病也成为了可能。不过,NIK的全局或胸腺上皮特异性缺失会对小鼠造成其他的损害,关于NIK抑制剂的安全性还有待未来更全面地考察。
参考资料:
[1]Zhou J, Zhou F, Wang W, et al. Epidemiological Features of NAFLD From 1999 to 2018 in China. Hepatology. 2020 May;71(5):1851-1864. doi: 10.1002/hep.31150. PMID: 32012320.
[2]Zhang, Z., Zhong, X., Shen, H. et al. Biliary NIK promotes ductular reaction and liver injury and fibrosis in mice. Nat Commun 13, 5111 (2022). https://doi.org/10.1038/s41467-022-32575-8
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











阻断NIK的药物现在有吗?
0