【协和医学杂志】《2023年JCS心肌炎诊断和治疗指南》解读
2024-04-27 协和医学杂志 协和医学杂志 发表于陕西省
本文对该指南的重要更新内容进行解读,以期提高我国临床医师对心肌炎的关注度与认知度,进一步提升临床诊疗水平。
心肌炎以局灶性或弥漫性心肌炎症为特征,其病因复杂、临床症状轻重不一、病理特征多样,目前临床尚缺乏统一规范的诊疗方案。2023年4月,日本循环学会(JCS)发表了《2023年JCS心肌炎诊断和治疗指南》(下文简称“2023年指南”),其依据患者不同的临床特征重新定义了心肌炎分型,并纳入最新研究进展和诊治观点[1]。为更好指导临床实践,本文对该指南的重要更新内容进行解读,以期提高我国临床医师对心肌炎的关注度与认知度,进一步提升临床诊疗水平。
心肌炎临床分型更新
自1837年Sobernheim首次提出“心肌炎”的概念以来,人类认识心肌炎的历史已近2个世纪[2]。既往欧洲和美国所发表的立场声明及专家共识通常将心肌炎分为急性心肌炎、慢性心肌炎和慢性炎症性心肌病,而随着病毒基因组学和组织病理学检查方法的普及应用,临床医师对心肌炎病因学、病理学等的认识随之不断深入,并促使其临床分型进行了相应更新[2-3]。
1.1 急性心肌炎起病时间
2023年指南将急性心肌炎起病时间定义为<30 d,不再以起病时间<3个月作为急性心肌炎的判断标准。更新后的时间定义与急性心肌梗死、急性肺栓塞的判断标准相一致,从而更加符合临床实践并有助于治疗策略的制订。
1.2 临床分型
基于临床实践,2023年指南提出了全新的心肌炎临床分型方法。依据起病方式和病程将心肌炎分为急性心肌炎、慢性活动性心肌炎、慢性心肌炎、慢性炎症性心肌病(包括炎症性扩张型心肌病)和心肌炎后心肌病5种类型。为更好地理解此5种心肌炎,笔者对其进行了归纳总结:
|
1 |
诊断心肌炎需具备组织病理学心肌炎症细胞浸润这一标准; |
|
2 |
急性心肌炎和慢性活动性心肌炎还需合并心肌细胞损伤(心肌细胞变性/坏死); |
|
3 |
慢性心肌炎不合并心肌细胞损伤,无心功能障碍,可视为急性心肌炎向慢性炎症性心肌病的过渡阶段; |
|
4 |
慢性炎症性心肌病虽不合并心肌细胞损伤,但患者已出现心功能下降; |
|
5 |
炎症性扩张型心肌病是指临床诊断为扩张型心肌病,心肌组织病理学提示有炎症细胞浸润,无新发心肌细胞损伤,2023年指南认为其为慢性炎症性心肌病的一种类型; |
|
6 |
2023年指南首次将心脏活动性炎症改善但存在持续性心室重构,并进展为扩张型心肌病样特征的病变定义为心肌炎后心肌病,此概念为首次提出,其与扩张型心肌病具有完全相同的临床和病理表现,可根据临床病史对二者进行鉴别,若患者既往有明确的心肌炎病史,应考虑为心肌炎后心肌病。 |
值得注意的是,心肌炎的临床分型常存在交叉,故单纯以病因学、病理学和临床特征对心肌炎进行分型时通常无法做到精准归类,还应结合其他特征进行综合判断(表1)。
表1 《2023年JCS心肌炎诊断和治疗指南》对不同临床分型心肌炎的定义

1.3 暴发性心肌炎
《AHA 2020关于暴发性心肌炎识别和管理的科学声明》[4]将暴发性心肌炎定义为一种罕见的以心源性休克、室性心律失常或多器官衰竭等突发严重的心肌炎症反应为特征的疾病。该定义是以临床表现为主的排除性诊断,需遵循心源性休克的诊断流程并排除其他急性循环系统疾病(主要为急性冠脉综合征)。
2023年指南则对暴发性心肌炎的定义提出了不同见解,其认为心肌炎临床病程变化速度存在较大异质性,建议将突发血流动力学崩溃伴或不伴机械循环支持的致命性急性心肌炎定义为暴发性心肌炎。该定义强调暴发性心肌炎最主要的特点是血流动力学不稳定,从而使临床判断更为简洁,便于临床快速制订抢救策略,从而提高患者生存率。
心肌炎流行病学和病因学更新
2.1 流行病学
目前仍缺乏真实世界中病毒性心肌炎的确切发病率数据。2013年全球疾病负担研究显示,心肌炎年发病率为2.2/10万,多见于20~40岁男性[5]。随着心脏磁共振(CMR)应用的推广,急性心肌炎诊断率有所提升,新近研究显示心肌炎年发病率增至(9.5~14.4)/10万[4]。
此外,药物引起的心肌炎也不容忽视,主要药物包括抗精神病药物、细胞毒性药物、免疫治疗药物、疫苗和水杨酸盐等,其中抗精神病药物和免疫治疗药物诱发的心肌炎分别占药物性心肌炎的54.7%和29.5%[6]。
2023年指南在流行病学方面最大的更新是观察到SARS-CoV-2病毒及其疫苗可导致心肌炎。2019年COVID-19疫情的暴发,已引起数亿人感染,数据显示SARS-CoV-2相关心肌炎发病率为(2.4~4.1)/10万[7]。
在SARS-CoV-2疫苗广泛接种后,基于美国和以色列人群的报道显示,SARS-CoV-2疫苗相关心肌炎发病率为(0.3~5)/10万[8-9],主要好发于接种第二剂mRNA疫苗后一周内,40岁以下男性患者多见[10]。荟萃分析显示,SARS-CoV-2疫苗相关老年心肌炎患者的死亡率约为0.2%~4.5%,但由于当前随访时间较短,此类患者的长期预后仍需进一步验证[11]。目前国内尚缺乏SARS-CoV-2灭活疫苗导致心肌炎的研究报道。
2.2 病因
心肌炎病因可分为感染性和非感染性2类。其中感染性病因主要包括病毒、细菌、真菌、立克次体、螺旋体、原虫及寄生虫等,而非感染性病因包括化学因素(如药物、疫苗、非化学损伤等)、超敏反应、系统性疾病(如胶原病、Kawasaki病、结节病等)、辐射、热射病、未知病理因素等。病毒感染仍是心肌炎最常见的病因,主要病原体包括腺病毒、肠道病毒(如柯萨奇病毒)、嗜血管病毒(如细小病毒B16)、嗜淋巴病毒(如巨细胞病毒、EB病毒和疱疹病毒6型)、心肌毒性病毒(如人类免疫缺陷病毒、流感病毒)、冠状病毒(如SARS-CoV-2)等。
心肌炎诊断标准及诊断流程更新
3.1 诊断标准
20世纪70年代,心内膜心肌活检(EMB)开始应用于心肌炎的临床诊断,目前该检查已成为心肌炎诊断的金标准[12]。1987年世界卫生组织(WHO)发布的Dallas标准认为,心肌内浸润的组织学证据为心肌存在炎症细胞浸润及心肌细胞变性或坏死[13]。1995年WHO推荐,应根据EMB组织病理学、免疫学和免疫组化结果对心肌炎进行诊断。
2013年欧洲心脏病学会(ESC)对诊断心肌炎的免疫组化标准进行了定义,即白细胞≥14个/mm2,其中单核细胞≥4个/mm2,且伴CD3+ T淋巴细胞≥7个/mm2。为提升CMR诊断心肌炎的准确性,2018年美国心脏病学会杂志对CMR诊断标准即Lake Louise标准进行了更新,新增T2映射、T1加权信号强度和细胞外容积作为心肌损伤的评估指标,新标准可将CMR诊断心肌炎的灵敏度由74%提升至88%,特异度由86%提升至96%。这些诊断标准的发布推动着心肌炎临床诊治水平的不断进步。
2023年指南建议在对患者症状和体征评估的基础上,结合非侵入性(包括Echo和CMR等)和侵入性(包括EMB和心脏导管)检查方法进行病理诊断,其主要目的在于针对患者是否存在心肌细胞损伤证据进行临床分型,以便为患者后续进入不同的治疗流程提供指导意见。
3.2 急、慢性心肌炎诊断流程
按照临床特征,2023年指南将疑诊心肌炎患者分为2类,并提供了诊断流程。其强调EMB需在病程早期、由高手术容量的术者完成,并依据是否存在心肌细胞损伤将慢性心肌炎判定为慢性活动性心肌炎或慢性炎症性心肌病(图1,2)。
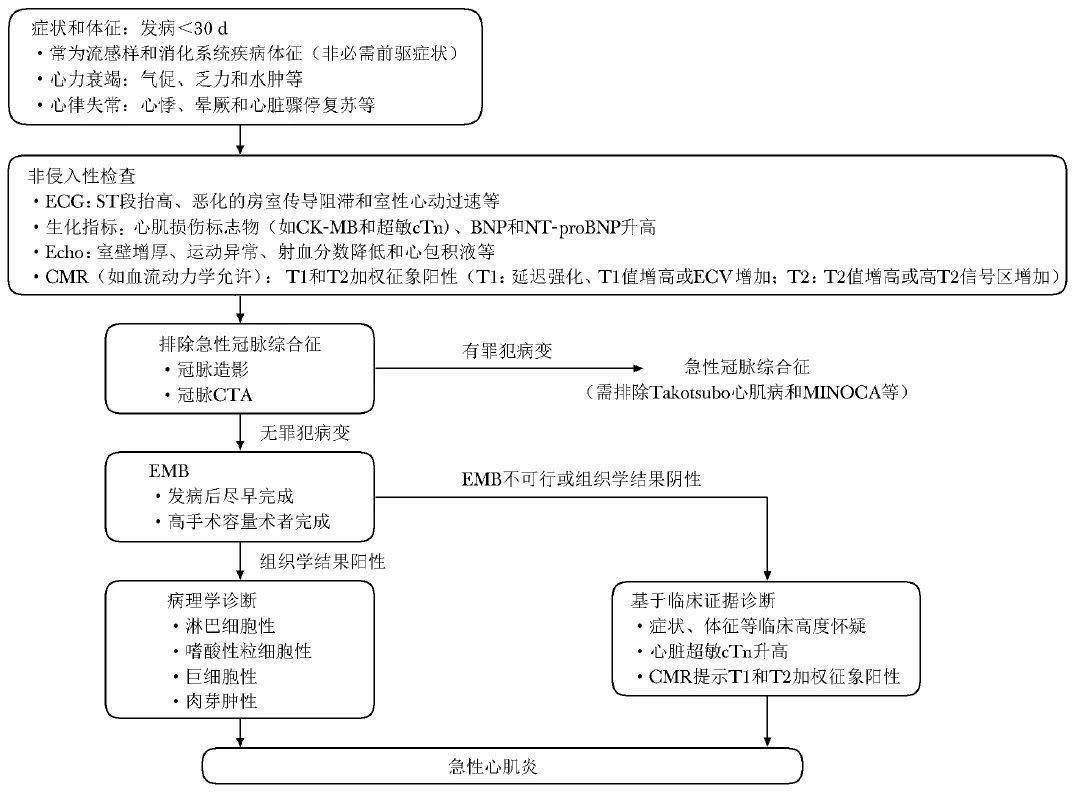
图1 《2023年JCS心肌炎诊断和治疗指南》推荐的急性心肌炎诊断流程
BNP(brain natriuretic peptide):B型钠尿肽;CK-MB(creatine kinase-MB):肌酸肌酶同工酶MB型;CTA(computed tomography angiography):电子计算机断层扫描血管造影;ECG(electrocardiogram):心电图;Echo(echocardiography):心脏超声;ECV(extracellular volume):细胞外容积;MINOCA(myocardial infarction with no obstructive coronary atherosclerosis):非冠状动脉阻塞性心肌梗死;NT-proBNP(N terminal pro B type natriuretic peptide):N末端B型钠尿肽前体;CMR、EMB、cTn:同表1
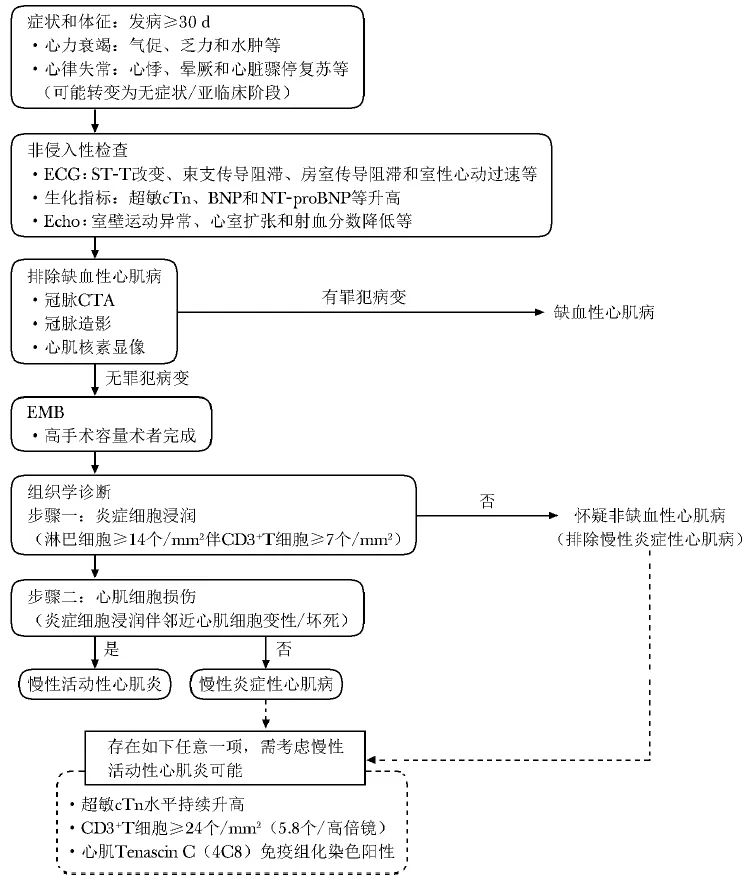
图2 《2023年JCS心肌炎诊断和治疗指南》推荐的慢性活动性心肌炎和慢性炎症性心肌病诊断流程
BNP、CTA、ECG、Echo、NT-proBNP:同图1;EMB、cTn:同表1
心内膜心肌活检
EMB是唯一可提供心肌炎诊断直接证据的检查方法,也被认为是诊断心肌炎的金标准,EMB可确定心肌炎病理亚型,如淋巴细胞性、嗜酸性粒细胞性、巨细胞性心肌炎或心脏结节病,从而指导临床治疗和预后评估。当疑诊急性心肌炎时,一般认为发病2周内行EMB的诊断效率最高。心内膜心肌活检前,应通过冠脉造影排除急性冠脉综合征,必要时通过右心导管进行血流动力学评估。
4.1 EMB适应证
虽然不同共识或指南的推荐内容略有差异,但汇总分析后发现对于疑诊心肌炎的患者均应积极行EMB,见表2。
表2 《2023年JCS心肌炎诊断和治疗指南》推荐心肌炎行EMB的情形

4.2 并发症
虽然EMB并发症较少见,但无法完全避免。在术中影像学的引导下,EMB围术期并发症发生率约为1%[14],主要包括死亡(0~0.07%)、心脏穿孔/心脏压塞(0~6.9%)、气胸/空气栓塞(0~0.8%)、血栓栓塞(0~0.32%)、瓣膜损伤(0.02%~1.1%)、严重心律失常/房室传导阻滞(0~11%)[15]。建议由年手术量20~50台的EMB术者及中心开展该项操作[14]。
4.3 组织病理学
EMB术中需从右心室/左心室的不同部位至少采集5块样本,用于组织病理检测、免疫组化、聚合酶链式反应等,以降低对心脏局灶性病变或心内肿瘤患者错误采样的可能。除组织病理学和免疫组化评估外,推荐对EMB标本行聚合酶链式反应或原位杂交技术进行病毒基因组筛查,以明确病原学诊断。急性病毒性心肌炎患者心脏组织中miRNA表达谱与健康人群存在显著差异[16],如病毒基因组结果阳性但未发现炎症细胞浸润,则心肌炎的诊断不成立。
心肌炎治疗更新
心肌炎的治疗包括针对心律失常、心力衰竭的对症治疗和针对原发病的对因治疗两方面。2023年指南建议首先需明确患者的血流动力学特征,再针对不同的病因学分类采取相应的治疗原则。
5.1 基础治疗和管理
5.1.1 暴发性心肌炎
首要治疗原则是维持血流动力学稳定,与急性心力衰竭的治疗药物相似,可常规予以利尿剂、血管扩张剂和正性肌力药物以纠正血流动力学状态。对于合并心力衰竭和肺水肿者,推荐首选多巴酚丁胺和3型磷酸二酯酶抑制剂;对于合并心源性休克者,推荐去甲肾上腺素治疗,也可予以多巴胺(由于缺乏循证医学证据支持,其推荐级别低于去甲肾上腺素)。
若药物治疗效果不佳,应立即启动机械循环支持。建议伴心源性休克和致命性心律失常患者首选静脉-动脉体外膜肺氧合(VA-ECMO)治疗,或将其与主动脉内球囊反搏(IABP)/IMPELLA联合应用;由于暴发性心肌炎患者常存在室性心动过速、心脏骤停或严重的右心衰竭,以致IABP/IMPELLA置入困难或无法提供足够的心输出量支持,故2023年指南不建议合并致命性心律失常、右心衰竭和明显呼吸衰竭者单独应用IABP/IMPELLA治疗。
5.1.2 血流动力学稳定的急性心肌炎
虽然其5年死亡及心脏移植率显著低于血流动力不稳定患者(0比14.7%),但仍建议此类患者至少留院观察48 h[1,17]。对于急性心肌炎是否应采用指南指导的心力衰竭药物治疗(GDMT),2023年指南认为,目前应用GDMT(包括RASS抑制剂或β受体阻滞剂等)治疗急性心肌炎能否获益需根据左心室射血分数(LVEF)降低程度具体分析。
对于LVEF≥50%的患者,虽建议早期应用此类药物,但其对延缓病情进展及心功能下降的作用并不确定。对于LVEF<50%的患者,如GDMT治疗后LVEF迅速恢复正常,则应维持用药至少6个月,以助于尽早恢复心功能;如LVEF未恢复正常,应复查心肌肌钙蛋白(cTn)和EMB,以明确是否为慢性活动性心肌炎或慢性炎症性心肌病,必要时启用免疫抑制剂治疗。
5.1.3 致命性心律失常
|
1 |
心动过缓致血流动力学不稳定者建议植入临时起搏器; |
|
2 |
急性期结束后仍持续存在症状性心动过缓者可植入永久起搏器; |
|
3 |
对于存在交感电风暴者,可考虑给予镇静剂; |
|
4 |
对急性期存在致命性心律失常(特别是交感电风暴时)者,建议植入VA-ECMO; |
|
5 |
对于急性期室性心律失常发作或猝死高风险者,可考虑植入可穿戴式心脏除颤器; |
|
6 |
急性期或痊愈3~6个月后仍具有室性心律失常发作或猝死高风险者,可考虑植入埋藏式心律转复除颤器(ICD)或心脏再同步治疗除颤器(CRT-D)。 |
5.2 免疫抑制剂治疗
免疫抑制剂是心肌炎重要的治疗手段,但对不同病理分型的疗效不同。嗜酸性粒细胞性心肌炎、巨细胞性心肌炎、心脏结节病可从早期免疫抑制剂(单用糖皮质激素或与硫唑嘌呤/环孢素联合)治疗中获益,尤其是巨细胞性心肌炎的生存率可得到明显提升,而淋巴细胞性心肌炎能否从免疫抑制剂治疗中获益仍缺乏高质量研究证据支持。
5.2.1 急性淋巴细胞性心肌炎
多数急性淋巴细胞性心肌炎可自愈,即使合并严重心力衰竭者也可从标准抗心力衰竭治疗中逐渐恢复,由于至今尚缺乏激素治疗急性淋巴细胞性心肌炎的临床试验,故2023年指南不建议常规给予免疫抑制剂治疗。只有疑诊慢性活动性心肌炎、自身免疫性疾病相关心肌炎、暴发性心肌炎且排除病毒感染后,方可给予免疫抑制剂治疗。
在初始激素冲击后,可转为泼尼松龙0.5~1.0 mg/(kg·d)治疗,随后逐渐减量(每隔7天减量5 mg),直至停药。对于初始治疗反应不佳者,可考虑联合应用环孢素(100~150 μg/L)或他克莫司(5~10 μg/L)或硫唑嘌呤[1.5~2.0 mg/(kg·d)]治疗。免疫抑制剂治疗1年后,如cTn水平、影像学(包括心脏超声和CMR等)、EMB未见心肌炎症和损伤的证据,则可考虑将免疫抑制剂减量或停药。
5.2.2 急性嗜酸性粒细胞性心肌炎
此类患者对免疫抑制剂反应较好,已应用正性肌力药物或机械循环支持者也可快速缓解症状。激素仍是首选药物,通常将吗替麦考酚酯和硫唑嘌呤作为二线药物。需根据患者的潜在病因,如特发性/超敏性嗜酸性心肌炎、嗜酸性肉芽肿性血管炎和嗜酸性粒细胞增多综合征等,制订针对原发病的免疫抑制治疗方案。
5.2.3 急性巨细胞性心肌炎
急性巨细胞性心肌炎是一类预后相对较差的心肌炎,但其通常对免疫抑制剂治疗反应较好。常规可选择:
|
1 |
泼尼松龙0.5~1.0 mg/(kg·d)治疗,随后每隔7天减量5 mg,直至最小剂量5 mg并长期维持; |
|
2 |
环孢素起始量150~300 μg/L治疗3个月,随后减量为100~150 μg/L至12个月,或他克莫司起始量10~15 μg/L治疗6个月,随后减量为5~10 μg/L至12个月。 |
对于上述方案反应不佳者,可联合应用吗替麦考酚酯1.5~2.0 mg/(kg·d)或硫唑嘌呤1.0~2.0 g/d治疗。在后期维持治疗阶段,可根据是否存在复发症状及药物不良反应综合考虑减量(环孢素:75~100 μg/L,他克莫司:5~10 μg/L)。
5.3 免疫调节/抗病毒治疗
免疫球蛋白(IVIG)等免疫调节药物可通过抑制心肌细胞炎症反应、减轻心肌损害,继而改善患者临床症状和预后。但目前仍缺乏IVIG改善心肌炎患者临床预后的大型临床研究证据,亦缺乏统一的IVIG治疗方案。目前急性心肌炎患者予以抗病毒治疗是否可获益仍存争议。对于腺病毒、肠道病毒、EMB取样确定的病毒感染者及慢性炎症性心肌病患者,干扰素治疗有助于恢复心功能;而EB病毒、巨细胞病毒或人类疱疹病毒6型感染者,可考虑使用抗病毒药物。
预后
6.1 急性心肌炎
虽然多数急性心肌炎患者可临床自愈,但部分急性心肌炎可进展为慢性活动性心肌炎或慢性炎症性心肌病,增加预后不良的风险,而对于暴发性心肌炎特别是伴心力衰竭和致命性心律失常者的预后通常较差。
来自欧洲注册人群的数据显示,急性心肌炎患者心源性休克发生率约为8.6%,院内死亡率约为2.7%[18]。对于伴心功能不全(LVEF<50%)、持续性室性心动过速和心输出量减低的急性心肌炎患者,其30 d心脏相关疾病死亡率约为10.4%。研究发现,年轻、心动过速、低血压、循环CK/cTn/白细胞介素-10升高、传导异常、LVEF降低和心室壁向心性肥厚是暴发性心肌炎患者预后不良的独立预测因素[18]。
6.2 慢性活动性心肌炎/慢性炎症性心肌病
与不伴炎症细胞浸润的扩张型心肌病患者相比,EMB发现炎症细胞浸润的慢性活动性心肌炎/慢性炎症性心肌病患者的预后更差,提示其预后不良的因素包括浸润性炎症细胞数目高、病毒基因核酸阳性、人类白细胞抗原(HLA)-DR阳性、QRS波≥120 ms、CMR钆延迟强化等[17]。心肌炎急性期好转出院患者较少发生死亡,而慢性活动性心肌炎或慢性炎症性心肌病患者的远期预后仍缺乏高质量研究证据。
小结
心肌炎是较为常见的心血管疾病,由于其临床表现异质性强,缺乏无创简便的诊断手段,治疗领域亦缺乏严谨的随机对照临床试验提供高级别循证医学证据,且缺乏权威指南可借鉴,以致各国家/地区制定的指南/规范及医学中心采用的诊治标准尚不统一,因此心肌炎的临床管理颇具挑战。
近10年来,美国及日本等医学发达国家先后发布了多部心肌炎临床诊治指南,为我国临床医师重新认识和规范心肌炎诊治带来了良好启示。2023年,结合最新研究进展,JCS在心肌炎定义、分类、诊断、治疗等多维度对指南进行了修订与更新。本文主要针对该指南的新修订部分及临床应用易混淆部分进行解读,以期帮助我国临床医师更好地掌握其核心内容,推动我国心肌炎领域诊疗规范化发展,助力临床诊治水平的进一步提升。
参考文献
[1]Nagai T, Inomata T, Kohno T, et al. JCS 2023 guideline on the diagnosis and treatment of myocarditis[J]. Circ J, 2023, 87(5): 674-754.
[2]Weinstein C, Fenoglio J J. Myocarditis[J]. Hum Pathol, 1987, 18(6): 613-618.
[3]邱露虹, 刘颖娴, 徐希奇. 不容忽视的心肌炎:来自《2021年ESC急慢性心力衰竭诊断与治疗指南》的启示[J]. 协和医学杂志, 2022, 13(4): 530-534.
[4]Kociol R D, Cooper L T, Fang J C, et al. Recognition and initial management of fulminant myocarditis: a scientific statement from the American Heart Association[J]. Circulation, 2020, 141(6): e69-e92.
[5]Pahuja M, Adegbala O, Mishra T, et al. Trends in the incidence of in-hospital mortality, cardiogenic shock, and utilization of mechanical circulatory support devices in myocardi-tis (analysis of national inpatient sample data, 2005—2014)[J]. J Card Fail, 2019, 25(6): 457-467.
[6]Nguyen L S, Cooper L T, Kerneis M, et al. Systematic analysis of drug-associated myocarditis reported in the World Health Organization pharmacovigilance database[J]. Nat Commun, 2022, 13(1): 25.
[7]Ammirati E, Lupi L, Palazzini M, et al. Prevalence, characteristics, and outcomes of COVID-19-associated acute myocarditis[J]. Circulation, 2022, 145(15): 1123-1139.
[8]Witberg G, Barda N, Hoss S, et al. Myocarditis after COVID-19 vaccination in a large health care organization[J]. N Engl J Med, 2021, 385(23): 2132-2139.
[9]Mevorach D, Anis E, Cedar N, et al. Myocarditis after BNT162b2 mRNA vaccine against COVID-19 in Israel[J]. N Engl J Med, 2021, 385(23): 2140-2149.
[10]Patone M, Mei X W, Handunnetthi L, et al. Risks of myocarditis, pericarditis, and cardiac arrhythmias associated with COVID-19 vaccination or SARS-CoV-2 infection[J]. Nat Med, 2022, 28(2): 410-422.
[11]Karlstad Ø, Hovi P, Husby A, et al. SARS-CoV-2 vaccination and myocarditis in a Nordic cohort study of 23 million residents[J]. JAMA Cardiol, 2022, 7(6): 600-612.
[12]Lie J T. Myocarditis and endomyocardial biopsy in unexplained heart failure: a diagnosis in search of a disease[J]. Ann Intern Med, 1988, 109(7): 525-528.
[13]Aretz H T. Myocarditis: the Dallas criteria[J]. Hum Pathol, 1987, 18(6): 619-624.
[14]Seferovic' P M, Tsutsui H, McNamara D M, et al. Heart Failure Association of the ESC, Heart Failure Society of America and Japanese Heart Failure Society position statement on endomyocardial biopsy[J]. Eur J Heart Fail, 2021, 23(6): 854-871.
[15]Yilmaz A, Kindermann I, Kindermann M, et al. Compara-tive evaluation of left and right ventricular endomyocardial biopsy: differences in complication rate and diagnostic performance[J]. Circulation, 2010, 122(9): 900-909.
[16]Corsten M F, Papageorgiou A, Verhesen W, et al. MicroRNA profiling identifies microRNA-155 as an adverse mediator of cardiac injury and dysfunction during acute viral myocarditis[J]. Circ Res, 2012, 111(4): 415-425.
[17]McDonagh T A, Metra M, Adamo M, et al. 2021 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure[J]. Eur Heart J, 2021, 42(36): 3599-3726.
[18]Ammirati E, Cipriani M, Moro C, et al. Clinical presenta-tion and outcome in a contemporary cohort of patients with acute myocarditis: multicenter lombardy registry[J]. Circulation, 2018, 138(11): 1088-1099.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#心肌炎# #治疗指南#
87